| المجلد 6 ,
العدد 9
, جمادى الأولى 1434 - نيسان(أبريل) 2013 |
| |
| دراسة مستويات ST2 المصلية لدى مرضى فشل قلب سوريين |
| Serum ST2 Levels in Syrian Heart Failure Patients |
| د. حسن البني، أ. د. إميل شاهين وأ. د. فايزة القبيلي |
| Albony H; Chahine E. and Al-Quobaili F. |
كلية الصيدلة، جامعة دمشق
Faculty of Pharmacy, Damascus University.
|
| الملخص Abstract |
على الرغم من الاكتشاف القديم لجين ST2 ومنتجاته، إلا إن دوره المرضي لم يفهم بشكل كامل إلى أن اكتشف لجينه its ligand النوعي IL-33 عام 2005، الأمر الذي سهل فهم دوره في العديد من الأمراض وخاصةً الأمراض الوعائية القلبية.
شملت دراستنا 90 شخصاً، 68 مرضى فشل قلب و22 شخصاً من الشواهد. جرت مقايسة مستويات ST2 وNT-proBNB المصلية لدى أفراد الدراسة جميعهم. وأظهرت نتائجنا ارتفاعاً يعتد به في مستويات ST2 المصلية لدى مرضى فشل القلب، مقارنة مع المجموعة الشاهدة. وكانت هذه الزيادة في مستويات ST2 المصلية مترافقة أيضاً مع تفاقم الأعراض السريرية لفشل القلب، تبعاً لتصنيفNYHA ومع تراجع أداء عَضَلُ القَلْب. وارتبطت مستويات ST2 المصلية مع قيم NT-proBNB المصلية.
|
Despite the fact that it has been long time since ST2 gene and its products were discovered, the pathological role of ST2 has not been fully understood until the discovery of its specific ligand IL-33 in 2005, which helps to understand its role in many diseases, especially cardiovascular diseases.
Our study included 90 subjects, 68 of heart failure patients and 22 of the control subjects. In all 90 subjects, serum ST2 and NT-proBNP levels had measured. Our results showed a significant increase of serum ST2 levels in heart failure patients, compared with control subjects. This increase of serum ST2 levels was also accompanied with worsening clinical symptoms of heart failure, according to New York Heart Association (NYHA) classification, as well as, with a decline in the performance of the myocardium. And the serum ST2 levels correlated with serum NT-proBNB values.
|
| المقدمة Introduction |
اكتشف جين Stromelysin2 (ST2) عام 1989 من قبل مجموعتين بحثيتين مستقلتين بتحري مكتبة الدَّنا التميمي cDNA library من الخطوط الخلوية للأرومات الليفية المأخوذة من الفئران 3T3، بعد تحفيز الانقسام الفتيلي بالتعبير الزائد عن الجين الورمي ras (1). واعتبر ST2 مستقبلاً لا لجين له orphan receptor حتى اكتشف ارتباطه بالإنترلوكين IL-33 في عام 2005 وهذا ما سمح بفهم دوره بشكل أفضل (2). يبلغ طول جين ST2 2.7kb ويملك موقعي ابتداء initiation sites ويرمز هذا الجين لبروتين مؤلف من 337 حمضاً أمينياً وحجم يتراوح بين 37.7 و38.5 كيلودالتون. يماثل هذا البروتين مستقبل IL-1 بشكل كبير، إلا أنه لا يملك الوحدة عبر الغشائية والوحدة الهيولية ولذلك يسمى ST2 الذواب soluble ST2 (sST2). عزل الدنا التميمي cDNA البشري الخاص بجين sST2 من مكتبة DNA الخلايا المحببة granulocyte بتقصي جين ST2 بمسبار probe مستحصل من تتالي sST2 الفأري قبل أن يجري تحديد تتاليه sequencing في الخلايا T المساعدة. يشابه البروتين النهائي الناتج sST2 الفأري بنسبة 68%. ويتوضع جين sST2 الفأري على الصبغي 1 على مقربة من توضع جين IL-1r1، في حين يتوضع جين ST2 البشري على مقربة من توضع IL-1r على الصبغي 2q12-13. تفرز الخلايا المعداة بجين ST2 الذواب بروتيناً داخل خلوي يتراوح وزنه بين 45-60 كيلودالتون، وبروتين خارج خلوي ST2L يتراوح وزنه بين 60-70 كيلودالتون، عند غلكزته (ارتباطه بالغلوكوزيل) glycosylation. ويعود اختلاف الحجم إلى اختلاف درجة الارتباط بالغلوكوزيل.
يدعى المنتج الثالث لجين ST2 بالـ ST2V ولقد جرى عزله من الخطوط الخلوية للخلايا التائية المساعدة. يشبه هذا المنتج sST2 ويختلف عنه باستبدال ذيل كاره للماء hydrophobic tail بإحدى الغلوبلينات المناعية خارج الخلوية وهو مجهول الوظيفة (الشكل 1) (3).
يحفز AP-1 التعبير عن كل من sST2 وST2L. إلا أن تحفيز إنتاج ST2L يكون ضئيلاً جداً إذا ما قورن بتحفيز sST2. تحث السيتوكينات الالتهابية، مثلPMA ، TNFα،IL-1α ،IL-β على زيادة التعبير عن sST2 بهذه الآلية المتواسطة بـ AP-1. وتثبط السيتوكينات المضادة للالتهاب، مثل IL-4،IL-5 ، IL-13 إفراز السيتوكينات الالتهابية، وبالتالي فهي تثبط إنتاج sST2 بشكل غير مباشر.
أظهرت الدراسات المعتمدة على استخدام أضداد ST2L النوعية، أو استخدام sST2 المأشوب نقصاً واضحاً في تراكيز IL-4 و IL-5 وازدياد تراكيز IFNγ من قبل الخلايا التائية CD4+. وهذا يُفَسَّرْ بدور ST2L في تنبيغ الإشارة المسؤولة عن زيادة إنتاج السيتوكينات المضادة للالتهاب (4).
يسبب ارتباط ST2L بلجينه IL-33 تعزيزاً (جلباً) recruitment لجزيئات MyD88 إلى القطاع الهيولي لمستقبلات (TIR) Toll-interleukin-1 receptor. ويسبب ذلك تفعيل عوامل انتساخ داخل خلوية مثل NF-κB وAP-1 عبر تفعيل العديد من الكينازات، مثل IRAK ، TRAF6، MAP kinases (5).
تحث هذه الإشارة على إنتاج السيتوكينات المضادة للالتهاب، في الخلايا التائية المساعدة Th2. وتثبط حدوث تليف واستماتة وإعادة هيكلة في العضلة القلبية بآليات غير مفهومة بشكل كامل. وبما أن sST2 مستقبل ذواب فهو قادر على إيقاف تنبيغ هذه الإشارة (6).
|
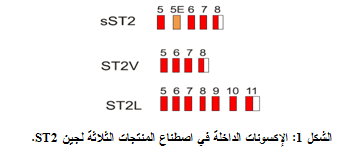 |
| المواد والطرق Materials and Methods |
شملت الدراسة 90 فرداً (68 مريضاً و 22 من الأشخاص الأصحاء ظاهرياً)، تراوحت أعمارھم بين 39-77 عاماً، وجرى جمع العينات في الفترة بين أيلول 2009 ونيسان 2010 من المراكز التالية:
- مستشفى الأسد الجامعي.
- مركز جراحة القلب والأوعية الدموية.
- مستشفى المواساة.
استبعدنا في هذه الدراسة كلاً من المرضى السكريين، سواء كانوا من النمط الأول أو الثاني، والمرضى الذين يعانون من اضطرابات كلوية والمشخصين بمستويات كرياتنين تساوي أو أكبر من 1.5 ملغ/دل ومرضى الأورام. وكذلك المرضى الذين يعانون من الأمراض الالتهابية وأمراض المناعة الذاتية.
أجريت مقايسة ST2 باستخدام عتيدة Human MMP-10 ELISA المنتجة من قبل شركة RayBio® الأمريكية. تقيس هذه العتيدة مستويات ST2 البشري بشكليه الطليعة والفعال، في المصل والبلازما (المأخوذة على الهيبارين وليس على EDTA أو سيترات الصوديوم) والسائل الطافي للمزارع الخلوية والبول، باستخدام أضداد ST2 البشري النوعية المغلفة لآبار الصفيحة. وأجريت مقايسة NT-proBNB باستخدام عتيدة NT-proBNP المصنعة من قبل شركة Biomedica السلوفاكية لمقايسة NT-proBNB في عينات المصل والبلازما (المأخوذة على EDTA). وتعتمد هاتين العتيدتين على مبدأ المقايسة الإنزيمية بالشطيرة.
جرى التعبير عن القيم بالمتوسط الحسابي والانحراف المعياري. اعتمد اختبار T-Student لتحديد ما إذا كان الفارق بين المتوسطات ناجماً عن المصادفة أم حقيقياً. اعتمد معامل Person للارتباط لدراسة علاقة الارتباط بين متثابتات المجموعة الواحدة. اعتمدت P<0.05 كقيمة يعتد بها إحصائياً.
قسم المشاركون في هذه الدراسة على النحو التالي (الشكل 2):
- المجموعة الشاهدة.
- مجموعة مرضى فشل القلب.
جرى توزيع المرضى حسب تصنيف NYHA الوظيفي إلى المجموعات التالية (الشكل 3):
مرحلة الصنف الثاني class II 23 مريضاً، مرحلة الصنف الثالث III class 23 مريضاً، مرحلة الصنف الرابع class IV 22 مريضاً.
|
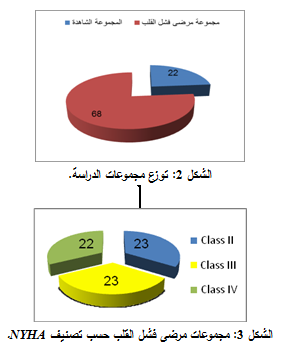 |
| النتائج Results |
أظهرت نتائجنا وجود ارتفاع واضح في مستويات ST2 المصلية لدى مرضى فشل القلب. وكان هذا الارتفاع متناسباً مع تصنيف NYHA الوظيفي المعتمد على الأعراض، حيث وجد فارق يعتد به إحصائياً (P=0.0019) بين المجموعة الشاهدة ومجموعة مرضى فشل القلب من الصنف NYHA II. كما وجد فارق يعتد به إحصائياً (P<0.001) بين مجموعة مرضى فشل القلب من الصنف II NYHA ومن الصنف III NYHA، وكذلك وجد فارق يعتد به احصائياً (P<0.001) بين مجموعة مرضى فشل القلب من الصنف III NYHA ومجموعة مرضى فشل القلب من الصنف NYHA IV (الشكل 4).
كما أظهرت دراسة العلاقة بين مستويات ST2 المصلية وحجم الجزء المقذوف لدى مرضى فشل القلب وجود ارتباط عكسي بين مستويات ST2 المصلية (ng/ml) وحجم الجزء المقذوف (%) (R=-0.47) وكانت هذه العلاقة معتداً بها إحصائياً (P<0.001) (الشكل 5).
لدى دراسة علاقة الارتباط بين مستويات ST2 وNT-proBNP لدى مرضى فشل القلب تبين وجود علاقة ارتباط طردية، وكان معامل الارتباط R=0.5 وهي علاقة يُعتد بها إحصائياً P<0.001 (الشكل 6). |
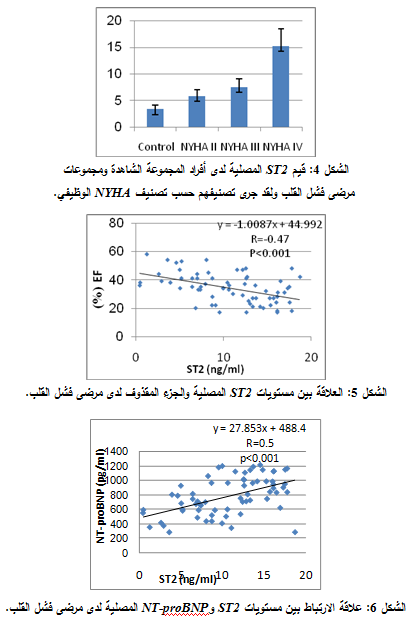 |
| المناقشة Discussion |
يُفْرَزْ ST2 من العديد من أعضاء الجسم، كالكبد والرئتين ونقي العظام. ومن خلايا الجهاز المناعي، كالوحيدات واللمفاويات البائية والتائية، ومن الأرومات الليفية وخاصة في القلب. ويزداد افراز ST2 استجابة للسيتوكينات الالتهابية.
ولقد أظهرت نتائجنا ارتفاعاً واضحاً في مستويات ST2 المصلية لدى مرضى فشل القلب (X±SD: 9.7±4.744 ng/ml) مقارنة مع المجموعة الشاهدة 3.3±1.3 ng/ml) (X±SD: وبفارق معتد به إحصائياً P< 0.0001)). كما بينت نتائجنا ارتفاع مستويات ST2 المصلية لدى مرضى فشل القلب تبعاً لترقي درجة المرض لدى هؤلاء المرضى، اعتماداً على تصنيف NYHA الوظيفي، وبالتالي يترافق هذا الارتفاع مع سوء إنذار المريض، كما هو مبين تبعاً للقيم التالية:
Control: 3.3± 1.3, NYHA II: 5.8± 3.1, NYHA III: 11.02±3.15, NYHA IV: 15.22±2.53
ولقد توافق ذلك مع دراسة Broch وزملائه (7) عام 2012، ومع دراسة Manzano-Fernandez وزملائه (8) عام 2011 ومع دراسة Rehman وزملائه (9) عام 2008 وهذا ما تأكد لدينا بعد مقارنة مستويات ST2 المصلية لدى هؤلاء المرضى مع بيانات صورة صدى القلب لديهم، إذ بينت النتائج وجود علاقة ارتباط عكسية بين مستويات ST2 المصلية والجزء المقذوف EF (%) (R=-0.47) وكان الفارق معتداً به إحصائياً (P<0.001)، وهذا يتوافق مع دراسة Ravi وزملائه (10) عام 2009 الذين أكدوا أن مستويات ST2 المصلية المرتفعة لدى مرضى فشل القلب يترافق مع انخفاض قيمة EF، وتدهور حالة المريض، وإنذار سيء للوفاة لدى هؤلاء المرضى.
كما بينت دراستنا وجود ارتباط بين ST2 وNT-proBNP كواصم كيميائي حيوي معتمد لتشخيص وتقييم فشل القلب (R=0.5) وبفارق إحصائي معتد به (P<0.001). وقد يُفَسَّر ذلك بازدياد الإنتاج الذي يحفزه الشد الميكانيكي mechanical stretch الذي يحدث عند مرضى فشل القلب. وتوافقت هذه النتائج مع دراسة Rehman (9) ومع دراسة Bartunek وزملائه(11) وكذلك مع دراسة Martinez-Rumayor وزملائه (12) عام 2008.
أكد Weinberg وزملاؤه (13) عام 2002 وJavier (14) عام 2008 أن كلاً من الشد الميكانيكي لخلايا عضلة قلبية معزولة والقيم المصلية المرتفعة لـ IL-1β يزيد من التعبير الجيني لـ ST2. وبما أن فرط الحمل الدموي الملاحظ لدى مرضى فشل القلب يسبب ضغطاً ميكانيكياً على جدران البطين الأيسر، فإن هذا يزيد التعبير الجيني عن ST2 وبالتالي يسهم في رفع مستوياته الدموية لدى مرضى فشل القلب. وكذلك أكد Vicenov? وزملاؤه عام 2009 (5) ارتفاع مستويات IL-1β لدى مرضى فشل القلب. وهذه السيتوكينات تفعل AP-1 الذي يحث انتساخ ST2.
تؤثر مستويات ST2 المصلية المرتفعة سلباً على عضلة القلب وذلك من خلال العوامل التالية:
- ارتباط ST2 الذواب بلجينه IL-33 وبالتالي قطع تنبيغ إشارة IL-33 التي تؤدي إلى تحفيز انتساخ الانترلوكينات المضادة للالتهاب (IL-4،IL-5 ، IL-13) (6). وتُثَبِط هذه الانترلوكينات حدوث استماتة وتليف خلايا العضلة القلبية. وهذا يُفَسِّر الترافق الواضح بين تراجع وظيفة العضلة القلبية ومستويات ST2 المصلية المرتفعة لدى مرضى فشل القلب.
- يتظاهر كل ذلك بتدهور حالة المريض بسبب تراجع أداء عضلة القلب، نتيجة انخفاض قيم السيتوكينات المضادة للالتهاب وارتفاع قيم السيتوكينات الالتهابية. وهذا ما يدعم سوء التكيف الوظيفي maladaptive الملاحظ لدى مرضى فشل القلب، الذي تشارك فيه العديد من الهرمونات كالهرمونات العصبية وجملة رينين- أنجيوتنسين- ألدوستيرون.
استثنينا في هذه الدراسة الاضطرابات المترافقة مع مستويات مصلية مرتفعة من ST2 جميعها وفقاً للدراسات العالمية، فلقد استثنينا مرضى فشل القلب الذين يعانون من الداء السكري (سواءٌ كانوا من النمط 1 أو من النمط 2) ومرضى الفشل الكلوي، والمرضى الذين يعانون من الربو أو الْتِهابُ المَفاصِلِ الرُّوماتويديّ أو الذِئْبَةٌ الحُمامِيَّةٌ ، ليكون ارتفاع مستويات ST2 المصلية لدى مرضى فشل القلب مستقلاً عن أية حالة التهابية أو مرضية ومتعلقاً بحالة فشل القلب فقط.
|
| الاستنتاج Conclusion |
- حدوث ارتفاع في مستويات ST2 لدى مرضى
فشل القلب وبشكل متناسب مع شدة المرض حسب تصنيف NYHA الوظيفي.
- وجود علاقة ارتباط طردية بين مستويات ST2 وNT-proBNP والذي يشكل أحد أهم واصمات اختطار فشل القلب.
|
| المراجع References |
1-Werenskiold A.K., Hoffmann S. and Klemenz R.
Induction of a mitogen responsive gene after expression of the Ha-ras oncogene in NIH 3T3 fibroblasts.
Mol. Cell Biol; 9: 5207-5214, 1989.
2-Tominaga S.
A putative protein of a growth specific cDNA from BALB/c- 3T3 cells is highly similar to the extracellular portion of mouse interleukin1 receptor.
FEBS Lett; 258: 301-304, 1989.
3-Schmitz J; Owyang A; Oldham E; Song Y; Murphy E; McClanahan T.K; Zurawski G; Moshrefi M; Qin J; Li X; Gorman D.M; Bazan J.F; Kastelein R.A.
IL-33, an interleukin-1-like cytokine that signals via the IL-1 receptor-related protein ST2 and induces T helper type 2-associated cytokines.
Immunity; 23: 479-490, 2005.
4-Miller A.
Role of IL-33 in inflammation and disease.
Journal of Inflammation, 8: 22, 1-3, 2011.
5-Vicenov? B; Vop?lensk? V; Bur??ek L. and POsp??e M.
Emerging Role of Interleukin-1 in Cardiovascular Diseases.
Physiol. Res, 58(5): 481-494, 2009.
6-Kakkar R. and Lee R.
The IL-33/ST2 pathway: therapeutic target and novel biomarker.
Nature, 7(2): 833-836, 2008.
7-Broch K; Ueland T; Nymo SH; Kjekshus J; Hulthe J; Muntendam P; McMurray JJ; Wikstrand J; Cleland JG; Aukrust P. and Gullestad L.
Soluble ST2 is associated with adverse outcome in patients with heart failure of ischaemic aetiology.
Eur J Heart Fail; 14(3): 268-277, 2012.
8-Pascual-Figal DA; Manzano-Fern?ndez S; Boronat M; Casas T; Garrido IP; Bonaque JC; Pastor-Perez F; Valdés M. and Januzzi JL.
Soluble ST2, high-sensitivity troponin T- and N-terminal pro-B-type natriuretic peptide: complementary role for risk stratification in acutely decompensate heart failure.
Eur J Heart Fail; 13(7): 718-725, 2011.
9-Rehman S; Mueller T. and Januzzi J.
Characteristics of the Novel Interleukin Family Biomarker ST2 in Patients with Acute Heart Failure.
J American College of Cardiology, 52 (18): 1459-1466, 2008.
10-Ravi S; Chen-Tournoux A; Picard M. and Roland R.
Serum Levels of the Interleukin-1 Receptor Family Member ST2, Cardiac Structure and Function, and Long-Term Mortality in Patients With Acute Dyspnea.
Circ Heart Fail; 2; 311-319, 2009.
11-Bartunek J; Delrue L; Van Durme V; Olivier M; Casselman F; Wiest B; Croes R; Verstreken S; Goethals M; Raedt R; Sarma J; Joseph L; Vanderheyden M. and Weinberg E.
Non-Myocardial Production of ST2 Protein in Human Hypertrophy and Failure is Related to Diastolic Load. Am Coll Cardiol, 16; 52(25): 2166-2174, 2008.
12-Martinez-Rumayor A; Camargo C; Green S; Baggish A; O’Donoghue M. and Januzzi J.
Soluble ST2 Plasma Concentrations Predict 1-Year Mortality in Acutely Dyspneic Emergency Department Patients With Pulmonary Disease.
Am J Clin Pathol; 130: 578-584, 2008.
13-Weinberg E; Shimpo M; Hurwitz S; Tominaga S; Rouleau J. and Lee R.
Identification of Serum Soluble ST2 Receptor as a Novel Heart Failure biomarker.
Circulation, 107: 721-726, 2003.
14-D?´ez J.
Serum Soluble ST2 as a Biochemical Marker of Acute Heart Failure.
J American College of Cardiology, 52(18): 1467-1468, 2008.
|
| |
| |
| المجلد 6 ,
العدد 9
, جمادى الأولى 1434 - نيسان(أبريل) 2013 |
|
|
|
