| المجلد 6 ,
العدد 9
, جمادى الأولى 1434 - نيسان(أبريل) 2013 |
| |
| دراسة التأثير المضاد للإلتصاق الجرثومي للمركبات المستخدمة في معالجة
مرضى القثاطر البولية تجريبياً
|
| Empirical Study of Anti-adherent Effect of Chemotherapeutic Compounds Used in the Treatment of Patients with Urethral Catheters |
| د. مهند الحمش و أ. د. مصطفى العموري |
| AL Hmesh M. and AL Amouri M. |
كلية الصيدلة، جامعة دمشق
Faculty of Pharmacy, Damascus University.
|
| الملخص Abstract |
| إن التراكيز المثبطة تحت الأصغرية من المضادات الحيوية، على الرغم من عدم قدرتها على قتل الجرثوم، يمكنها تعديل الخصائص الفيزيائية الكيميائية والبنية الفراغية للسطح الخارجي للجراثيم وقد تتداخل مع بعض الوظائف الجرثومية كالالتصاق. تم في هذه الدراسة تقييم تأثير التراكيز تحت المثبط الأصغري (1/8، 1/4، 1/2 sub-MIC) لمركبات تستخدم عادةً في معالجة مرضى القثاطر البولية. أُجريت الدراسة باستخدام كلٍ من الأميكاسين والليفوفلوكساسين والسيفترياكسون والنتروفورانتوئين كمطهرات بولية، والديكلوفيناك الصودي، مسكن ألم شائع الاستخدام في مثل هذه الحالات. تمت دراسة تأثير هذه المواد على التصاق خمس ذراري، تضمنت الإيشريكية القولونية، والكلبسيلا الرئوية، والزائفة الزنجارية. عُزلت الذراري من مرضى القثاطر البولية المستقرة. أظهرت نتائجنا أن الأميكاسين والليفوفلوكساسين والسيفترياكسون كانت ذات فعاليةٍ جيدة في إنقاص الالتصاق الجرثومي للذراري الحساسة للمضادات الحيوية ومتوسطة الحساسية، في حين أن النتروفوانتوئين كان أقل تأثيراً حتى مع الذراري الحساسة. وفي الذراري المقاومة كان الليفوفلوكساسين هو المضاد الأكثر فعاليةً في إنقاص الالتصاق الجرثومي، بينما كانت المضادات الأخرى والديكلوفيناك الصودي غير فعالة. |
| Sub-minimum inhibitory concentrations (sub-MICs) of antibiotics, although not able to kill bacteria, can modify their physicochemical characteristics and the architecture their outermost surface, and may interfere with some bacterial functions such as adherence. In this study the effects of sub-MIC (1/2, 1/4, 1/8) of Compounds normally used in treatment patients with urethral catheters were evaluated. The study was done using Amikacin, Levofloxacin, Ceftriaxon and Nitrofurantoin as urethral antiseptic, and sodium Diclofinac, a common analgesic used in such cases. The effect of these compounds on bacterial adhesion of five strains, including Klebsiella pneumonia, Escherichia coli, Pseudomonas aeruginosa, was studied. The strains were taken from patients with indwelling urethral catheters. our results revealed that Amikacin, Levofloxacin and Ceftriaxon were of good effect in reducing bacterial adhesion for susceptible and intermediate susceptible strains, however Nitrofurantoin was less effect even on susceptible strains. In resistant strains, Levofloxacin was the most effective antibiotic in reducing bacterial adhesion, while the other antibiotics and Diclofinac were ineffective . |
| المقدمة Introduction |
| تُعدُ العدوى المرافقة للأجهزة الطبية المساعدة أوالمعاوضة كالقثاطر البولية من أكثر العداوى شيوعاً (40، 42، 43)، حيث يترافق إدخال هذه الأجهزة مع دخول جراثيم إلى الجهاز البولي لتتكاثر وتتضاعف مشكلةً فلماً حيوياً biofilm (16، 22، 24، 33-35، 41). وتشير دراسات عديدة أجريت في الأحياء وفي المختبر إلى أن المعالجة بالمضادات الحيوية لعدوى السبيل البولي المترافقة مع القثاطر البولية تؤدي إلى إزالة الجراثيم من البول لكنها لا تزيل الفلم الحيوي المرافق للقثطرة البولية (12-15، 25، 28، 32، 38). يؤكدُ الباحثون أن المعالجة الناجحة للفلم الحيوي تكون إما باستخدام عواملٍ تسمحُ باختراقه أو منع الالتصاق الأولي للجرثوم بسطح القثطرة وبالتالي منع تشكله أصلاً.وأجريت دراسات عديدة لمنع هذا الالتصاق من خلال تبديل الخواص الكيميائية لسطح القثطرة (19)، وتغطية القثاطر بالعوامل المطهرة مثل البوفيدون - اليود – حمض الساليسليك (2، 29، 26، 30)، أوالمعادن مثل الفضة وأكسيد الفضة والتنغستين والزنك (3، 11، 20، 27، 36، 39)، واستخدام الأمواج فوق الصوتية أو التيار الكهربائي بالمشاركة مع المضادات الحيوية (4، 8-10، 31، 37)، أوتطبيق sub-MIC من المضاد الحيوي. وهذه التراكيز يمكن الوصول إليها في الجسم بإعطاء المريض جرعاتٍ بسيطةٍ من المضاد الحيوي، وهذه التراكيز لا تقتل الجرثوم ولكنها تتمتع بقدرتها على تبديل الخصائص الفيزيئية الكيميائية ومكونات السطح الخارجي للجرثوم، وبالتالي تؤثر في وظائف مهمة للجرثوم، أهمها الالتصاق - القدرة على الحركة - تشكُل الأهداب والنتيجة ضعف في القدرة الإمراضية (الفوعة) (5، 6، 17، 18، 21، 29، 46)، وتشكيل الفلم الحيوي، حيثُ يعد التصاق الجرثوم الخطوة الأولى لتشكلها، ومن هنا جاءت دراستنا لتحري تأثير التراكيز تحت المثبطة الأصغرية من بعض المضادات الحيوية على الالتصاق الجرثومي لذرارٍ جرثومية معزولة من مرضى القثاطر البولية، وتحديد إمكان التطبيق السريري لهذه التراكيز تحت المثبطة الأصغرية عند مرضى القثاطر البولية للوقاية من عدوى السبيل البولي المرافقة للقثاطر البولية بدلاً من انتظار حدوثها وتتميز هذه التراكيز بجرعتها الصغيرة والمعالجة طويلة الأمد. |
| المواد والطرق Materials and Methods |
المضادات الحيوية: ]أميكاسين (اوبري؛ سورية)، ليفوفلوكساسين (Hoechst Marion Roussel؛ الهند) نترفورانتوئين (Goldshield؛ انكلترا)، سيفترياكسون صودي (الفا؛ سورية)، أقراص ورقية مشبعة بالمضادات الحيوية[، مصل فيزيولوجي بتركيز 0.9 ملغ/ مل (الديماس للأدوية؛ سورية)، قثاطر بولية 22Fr (Greetmed؛ الصين) كرات زجاجية متعددة الوجوه، أوساط زرعية.
الجراثيم المدروسة: تمت الدراسة على ثلاث ذراري جرثومية من الإِشْريكِيَّةُ القولونِيَّة E.coli، وذرية من الكلِبْسيلَّةُ الرِّئَوِيَّة K.pneumoniae، وذرية من الزائفة الزنجارية P.aeruginosa من مرضى القثاطر البولية المستقرة في مستشفى المواساة، وأُجريت اختبارات التحسس للمضادات الحيوية شائعة الاستعمال بطريقة التفشي من الأقراص (كيربي باور) والـ MIC لهذه الذراري وفق طريقة التمديد بالمرق المغذي المرجعية.
اختبار الالتصاق الجرثومي: تعتمد طريقتنا في دراسة الالتصاق الجرثومي على جهازٍ يحاكي جهاز البول عند الإنسان مؤلف من كيس مصل ملحي عقيم يحوي 1000 مل من NaCl 0.9 غ/ل، يضاف إليه 1 مل من معلقٍ للجرثوم المدروس بتركيز CFU/ml109-108 (تم التحضير بطريقة Kirby-Bauer) بحيث يصبحُ التركيز في المعلق الناتج CFU/ml106-105، يُسرب المحلول السابق الحاوي على الجرثوم المدروس عبر قثطرة بولية وتستمر عملية تسريب المحلول 7 أيام وفي درجة حرارة 37م (الجهاز كله في الحاضنة)، وكما هو الحال عند الإنسان تلتصق بعض هذه الجراثيم بسطح القثطرة البولية كمقدمة لتشكل الفلم الحيوي الخاص بها. ولتقييم قدرة الجرثوم على الالتصاق نلجأ إلى عملية عدّ الجراثيم الملتصقة بـ 1 سم من القثطرة البولية (بطريقة عد العيوش the viable count). بعد تحريرها بواسطة الرج بجوار الكرات الزجاجية في جهاز الـ Vortex، يؤخذ 1 سم من القثطرة في اليوم الأول بعد الحضن وتكرر العملية في اليوم الثالث والخامس والسابع بعد الحضن، ولدراسة تأثير المضادات المقترحة قمنا بإضافة تراكيز Sub-MIC وهي 1/8 MIC, 1/4 MIC, 1/2 MIC)) إلى الكيس الذي يحوي المعلق الجرثومي وتم العمل كما في التجربة الشاهدة السابقة، تمت التجارب في مختبر الدراسات العليا - كلية الصيدلة - جامعة دمشق.
|
| النتائج Results |
1- دراسة التأثير المضاد للالتصاق للمضادات الحيوية ضد الذراري المعزولة
تم العمل على ثلاث ذرارٍ من الإِشْريكِيَّةُ القولونِيَّة وذرية واحدة من الكلِبْسيلَّةُ الرِّئَوِيَّة وذرية واحدة من الزائفة الزنجارية وكانت النتائج كما يلي:
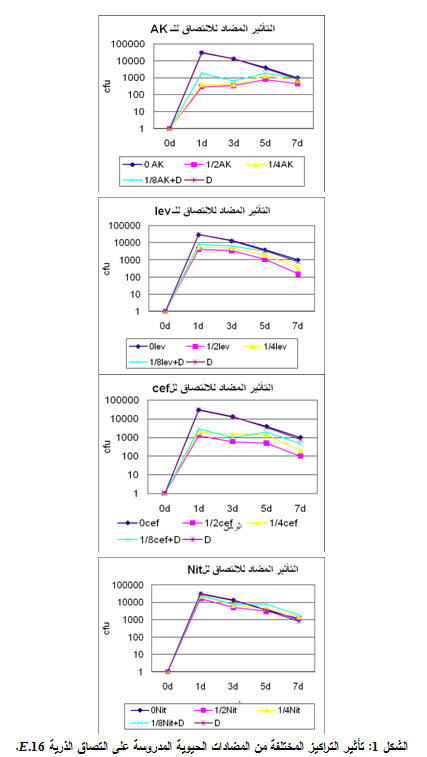
2- الـ E. Coli 16
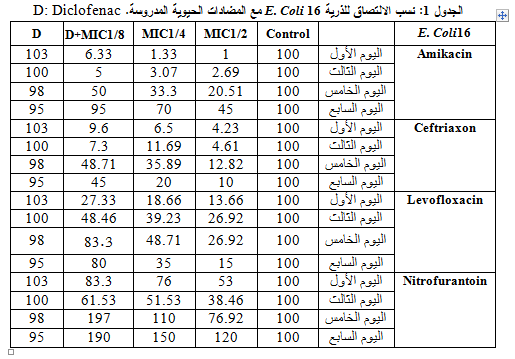
أعطت كل المضادات المستخدمة فعالية مضادة للالتصاق وبخاصة التركيز 2/1MIC، وكانت الفعالية أقل مع التراكيز الأخرى كما أظهرت مقارنة نسب الالتصاق للذرية المدروسة في هذا التركيز أن السفترياكسون هو الأفضل بنسبة التصاق وسطية 7.91%، تلاه الأميكاسين ثم الليفوفلوكساسين وكان النتروفورانتوئين الأقل فعالية، كما لم تبد مشاركة ديكلوفيناك الصوديوم مع المضادات المدروسة الفعالية المرجوة منها، مع العلم أن الذرية كانت حساسةً للأميكاسين والسفترياكسون والليفوفلوكساسين ومقاومةً للنتروفورانتوئين، وهذا ما يوضحه الجدول 1 والشكل 1:
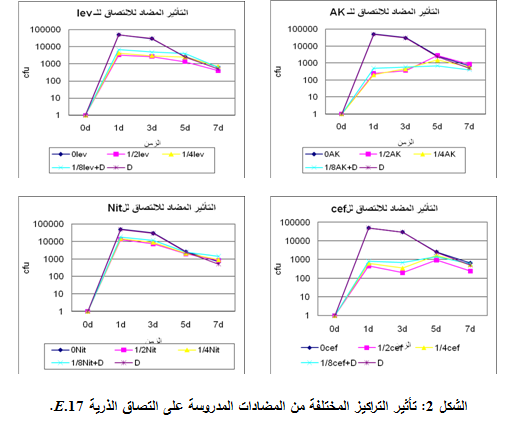
3- الـ 17E. Coli
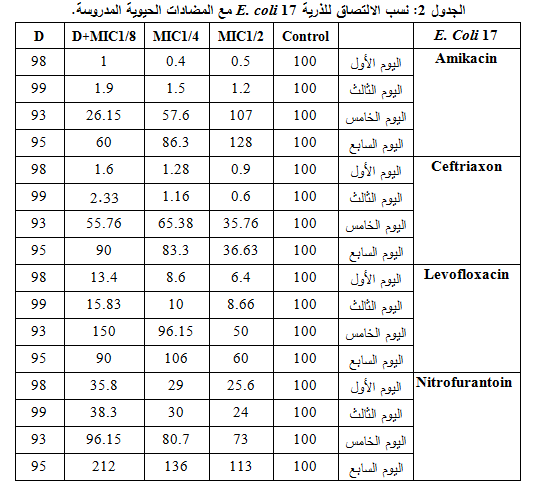
أعطى التركيز 2/1MIC التأثير الأعظمي المضاد للالتصاق وذلك مع كل المضادات المستخدمة، وتبين من خلال مقارنة نسب الالتصاق في هذا التركيز أن السفترياكسون هو الأكثر فعاليةً بنسبة التصاق وسطية 18.4%، تلاه الليفوفلوكساسين ثم النتروفورانتوئين والأميكاسين بفعالية أقل، كما لم تبد مشاركة ديكلوفيناك الصوديوم مع المضادات المدروسة الفعالية المرجوة منها، مع العلم أن الذرية كانت حساسةً للنتروفورانتوئين والسفترياكسون والليفوفلوكساسين ومقاومةً للأميكاسين، وهذا ما يوضحه الجدول 2 والشكل 2.
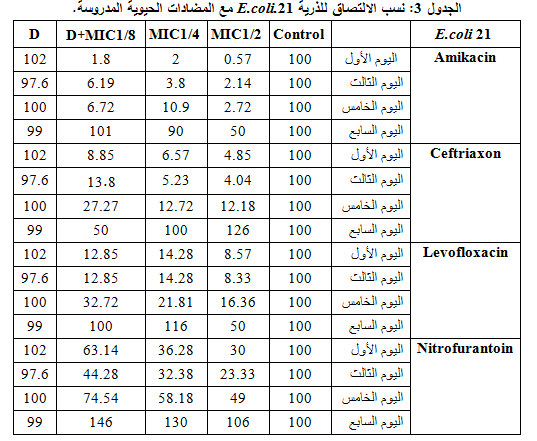
3- الـ 21E. coli.
كانت الذرية حساسةً للأميكاسين والليفوفلوكساسين والنتروفورانتوئين ومتوسطة الحساسية للسفترياكسون، وتبين من خلال مقارنة نسب الالتصاق خلال فترة التجربة، في التركيز 2/1MIC، أن الأميكاسين الأفضل بنسبة التصاق وسطية 13.85%، تلاه الليفوفلوكساسين بنسبة التصاق وسطية 20.8%، ثم السفترياكسون والنتروفورانتوئين بفعالية أقل، كما لم تبد مشاركة ديكلوفيناك الصوديوم مع المضادات الحيوية المدروسة الفعالية المرجوة منها، وهذا ما يوضحه الجدول 3 والشكل 3.
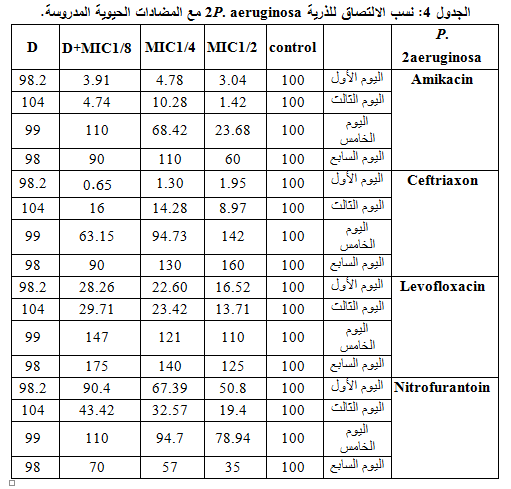
4- الـ 2 P. aeruginosa
لوحظت فعالية مضادة للالتصاق مع كل المضادات المدروسة بتراكيزها المختلفة وبخاصة التركيز 2/1MIC، كما شهدت التراكيز المختلفة تناقصاً طردياً للفعالية المضادة للالتصاق مع تناقص التركيز من 2/1MIC إلى 8/1MIC، وكذلك كان الأمر مع مرور الزمن من اليوم الأول إلى اليوم السابع. أظهرت مقارنة نسب الالتصاق في التركيز 2/1MIC أن الأميكاسين هو الأكثر فعاليةً وكانت الفعالية أقل مع المضادات الحيوية الأخرى، مع حصول تحريض لالتصاق الذرية في بعض الحالات. كما لم تبد مشاركة ديكلوفيناك الصوديوم مع المضادات المدروسة الفعالية المرجوة منها، مع العلم أن الذرية كانت متوسطة الحساسية للنتروفورانتوئين والأميكاسين ومقاومةً لليفوفلوكساسين والسفترياكسون، وهذا ما يوضحه الجدول 4 والشكل 4.
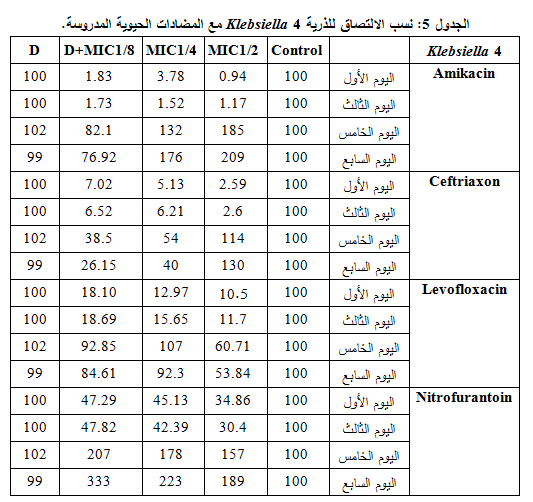
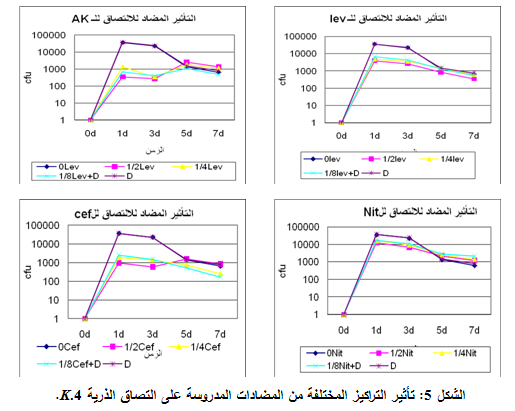
5- الـ 4 Klebsiella:
أنقصت المضادات الحيوية المدروسة قدرة هذه الذرية على الالتصاق وبخاصةٍ في التركيز 2/1MIC من اليومين الأول والثالث، كما أظهرت مقارنة نسب الالتصاق خلال فترة التجربة، في هذا التركيز، أن الليفوفلوكساسين هو الأكثر فعاليةً، تلاه السفترياكسون ثم الأميكاسين والنتروفورانتوئين بفعالية أقل، كما لم تبد مشاركة ديكلوفيناك الصوديوم مع المضاادات الحيوية المدروسة الفعالية المرجوة منها، مع العلم أن الذرية كانت متوسطة الحساسية لليفوفلوكساسين ومقاومةً للنتروفورانتوئين والسفترياكسون والأميكاسين، وهذا ما يوضحه الجدول 5 والشكل 5.
|

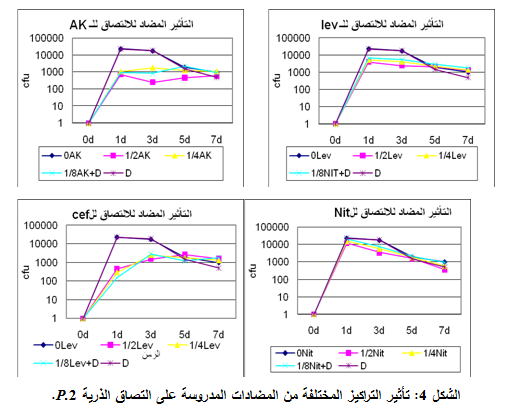
|
| 4- المناقشة Discussion |
| أظهرت نتائجنا أن المضادات الحيوية الأميكاسين والسيفترياكسون والليفوفلوكساسين أعطت نتائجً جيدةً في منع التصاق الذراري المدروسة، وكانت نسب الالتصاق الجرثومي خلال فترة التجربة، في التركيز 1/2MIC، مساوية 23.67%، 24.14%، 26.54%، على الترتيب. أما بالنسبة للنتروفورانتوئين فلقد كانت الفعالية أقل ونسبة الالتصاق هي 52.35% وذلك بالنسبة للجراثيم الحساسة ومتوسطة الحساسية لهذه المضادات الحيوية المدروسة. ويفسر تأثير الأميكاسين المثبط للالتصاق الجرثومي بقدرة هذا المضاد المثبط لاصطناع البروتين على إحداث نقصٍ في وحيدات الخمل pili (الشُعيرات) البروتينية والتي تدخلُ في تركيب الخمل. وبالتالي تشكُل خملٍ غير وظيفي (2003(Hostacka and Aiznar; . وتشير دراسة 2007 Wojnicz et al; إلى أن الأميكاسين يُحدث تبدلاتٍ بنيويةٍ في الخلية الجرثومية تتمثلُ بالخلايا الخيطية Filamentous والشبحية ghost والتي تمتلك فرصةً للالتصاق ضعيفةً أو معدومةً وتؤثر كل هذه العوامل في تثبيط الالتصاق الجرثومي. أما بالنسبة للسيفترياكسون فإن لهذا المضاد الحيوي خاصةً والبيتالاكتام عامةً القدرة على إحداث تبدلات بنيوية في الخلية الجرثومية كتشكل خلايا العناقيد وهي خلايا كبيرة تحوي بداخلها أعداداً كبيرةً من الخلايا الجرثومية لا تستطيع الانفصال عن بعضها في حالة إيجابيات الغرام، وتشكل الخلايا الخيطية والشبحية في حالة سلبيات الغرام. وهذه الأشكال شاذة وغير قادرة على الالتصاق (1997 Braga et al;). أما بالنسبة لليفوفلوكساسين فإن هذا المضاد الحيوي يؤثر في مستوى DNA مؤدياً إلى نقص في تشكُل الخمل على سطح الجرثوم، بالإضافة إلى تبدلاتٍ بنيوية في الخلية الجرثومية تتمثلُ بتشكل الخلايا الخيطية والشبحية وتطوي الجدار الخارجي وانكماش الهيولى، وتؤثر هذه التبدلات على قدرة الخلية الجرثومية على الالتصاق (Oviedo et al; 2000)، أما النتروفورانتوئين فإنه لا يؤثر بشكل مباشر على اصطناع البروتين في الخلية الجرثومية. وتشير دراسة 1972 Lorian et al; إلى أن التبدلات الشكلية آنفة الذكر تظهرُ بشكل أقل في حالة النتروفوانتوئين، كما تستمر الخلايا الجرثومية بإنتاج وحيدات الخمل حتى بوجود تراكيز تحت المثبطة من النتروفورانتوئين. وأما بالنسبة للذراري المقاومة للمضادات الحيوية المدروسة فأظهرت نسب الالتصاق الجرثومي للمضادات الحيوية المدروسة خلال فترة التجربة، في التركيز 1/2MIC، أن الليفوفلوكساسين هو الأكثرُ فعاليةً تلاهُ النتروفورانتوئين وحرض السيفترياكسون والأميكاسين التصاق الذراري المدروسة خاصةً في اليومين الخامس والسابع من التجربة. نلاحظ أن الليفوفلوكساسين هو الأفضل في حالة الجراثيم المقاومة ويعود ذلك إلى قدرة الفلوركينولونات عامةً على اختراق الفلم الحيوي الجرثومي خاصةً عندما يكون فتياً بعمر أقل من 48 ساعة (2000(Oviedo et al; ، أما بالنسبة للنتروفورانتوئين، ففي حالة الجراثيم الحساسة لم ينقص من قدرتها على الالتصاق، وفي حالة الجراثيم المقاومة كان الحال كذلك، كما أنه لم يحرض الجراثيم على زيادة الالتصاق، كما هو الحال مع الأميكاسين والسيفترياكسون. وبالنسبة للسيفترياكسون فإن مضادات البيتالاكتام تفقدُ فعاليتها على الطبقات السطحية من الفلم الحيوي دون أن تنفُذ من خلاله ( 2003et al; (Anderl، أما بالنسبة للأميكاسين فإنه يحملُ شحنةً موجبةً كما هو حال كل الأمينوغليكوزيدات ليتجاذب مع شحنة الفلم الحيوي السالبة فيتعطل مفعوله بذلك (2003Walters et al; ). أما بالنسبة لتحريض هذين المضادين الحيويين على زيادة الالتصاق فيعود إلى أن وجود المضاد الحيوي هو حالةُ شدةٍ تطورُ الخلايا الجرثومية استجابةً لها مورثاتٍ مسوؤلة عن زيادة الالتصاق، كما هو الحال في المكورات العنقودية Staphylococcus المقاومة للسيبروفلوكساسين حيثُ تؤدي معالجة هذه المكورات بتراكيز تحت المثبطة من السيبروفلوكساسين إلى زيادة التعبير عن البروتين الرابط للفيبرينوكتين، وبالتالي زيادة قدرتها على الالتصاق )1998(Braga, . وتؤدي معالجة الزائفة الزنجارية Pseudomonas aeruginosa بمضادات حيوية مقاومة لها أصلاً إلى إنتاج فلمٍ حيوي بسماكة أكبر يصعُبُ على المضاد الحيوي نفوذها (Whiteley et al; 2001) وهذا ما يفسر نسب الالتصاق العالية في حالة الأميكاسين والسيفترياكسون بالنسبة للجراثيم المقاومة لها., ولابد من الإشارة إلى أن نتائج الالتصاق الجرثومي للمضادات الحيوية المدروسة في اليومين الأول والثالث كانت أفضل من النتائج في اليومين الخامس والسابع، بالنسبة للجراثيم الحساسة والمقاومة على السواء، ويعود ذلك إلى أن التأثيرات التي تسببها المضادات الحيوية كالتبدلات الشكلية وتبدل مكونات السطح الخارجي للخلية الجرثومية مرتبطة بكون الخلية في حالتها الحرة Planktonic في بداية تشكُل الفلم الحيوي، ولكن ومع مرور الزمن من اليوم الأول إلى اليوم السابع تتحول الخلايا إلى حالة الفلم الحيوي وتنتجُ عديدات السكاريد خارج الخلوية والتي تجعل تأثير المضاد الحيوي على هذه الخلايا أضعف، كما إن تحول الخلية الجرثومية أيضاً نتيجة لوجودها في وسط عقيم من طور النمو إلى طور الاستقرارStationary phase يلعب دوراً مهماً في تحمل الجراثيم للمضادات الحيوية (Anderl et al; 2003). |
| 5- التوصيات والمقترحات |
1- يفضل استخدام المضادات الحيوية كالأميكاسين والسيفترياكسون والليفوفلوكساسين بجرعاتٍ تؤمن تراكيز تحت مثبطة، على الأقل في البول، في محاولة لمنعُ التصاق الجراثيم الممرضة.
2- العلاج المبكر بالمضادات الحيوية يجب أن يسبُقُ وضع القثطرة وعدم انتظار ظهور الأعراض العدوائية، لأن علاج الجراثيم في حالة الفلم الحيوي الفتي وفي حالتها الحرة أفضل من علاجها في حالة الفلم الحيوي الناضج.
|
| المراجع References |
1-Anderl J. N; Zahller J. and Roe F.
Role of nutrient limitation and stationary-phase existence in klebsiella pneumoniae biofilm resistance to ampicillin and ciprofloxacin.
JAC. 47: 1251-1256, 2003.
2-Bandara BM, Sankaridurg PR. and Willcox MDP.
Non-steroidal anti inflammatory agents decrease bacterial colonisation of contact lenses and prevent adhesion to human corneal epithelial cells.
Curr Eye Res; 29: 245-251, 2004.
3-Bechert T; Boswald M; Lugauer S; Regenfus A; Greil J; Guggenbichler J.P.
The Erlanger silver catheter: in vitro results for antimicrobial activity.
Infection. 27 (Suppl 1), 24-29, 1999.
4-Blenkinsopp S.A; Khoury A.E. and Costerton J.W.
Electrical enhancement of biocide efficacy against Pseudomonas aeruginosa biofilms.
Appl. Environ. Microbiol. 58: 3770-3773, 1992.
5-Braga P.C; Sasso M.D; Maci S.
Cefodizime: effects of sub-inhibitory concentrations on adhesiveness and bacterial morphology of Staphylococcus aureus and Escherichia coli: comparison with cefotaxime and ceftriaxone.
Journal of Antimicrobial Chemotherapy. 39, 79-84,1997.
6-BRAGA P.C; DAL SASSO M. and SALA M.T.
Sub-MIC concentrations of Cefodizime interfere with various factors affecting bacterial virulence.
J. Antimicrob. Chemother. 45, 15-25 2000.
7-Braga P.C.
Effects of subinhibitory concentrations of seven macrolides and four fluoroquinolones on adhesion of Staphylococcus aureus to human mucosal cells.
Chemotherapy, 40: 304-310. 1998.
8-Carmen J.C. Nelson J.L. Beckstead B.L. Runyan C.M. Robison R.A. Schaap A.P. and Pitt W.G.
Ultrasonic-enhanced gentamicin transport through colony biofilms of Pseudomonas aeruginosa and Escherichia coli.
J. Infect. Dis. 10, 2004.
9-Carmen J.C. Roeder B.L. Nelson, J.L. Beckstead B.L. Runyan C.M. Schaalje G.B. Robison R.A. and Pitt W.G.
Ultrasonically enhanced vancomycin activity against Staphylococcus epidermidis biofilms in vivo.
J. Biomater. Appl. 18, 237-245, 2004.
10-Carmen J.C; Roeder B.L; Nelson J.L; Ogilvie R.L; Robison R.A; Schaalje G.B. and Pitt W.G.
Treatment of biofilm infections on implants with low frequency ultrasound and antibiotics.
Am. J. Infect. Control. 33, 78-82, 2005.
11-Choi O; Deng KK; Kim NJ; Ross L JR; Surampalli RY. and Hu Z.
The inhibitory effects of silver nanoparticles, silver ions and silver chloride colloids on microbial growth.
Water Res. 42, 3066-3074. 2008.
12-Davey M.E; and O’Toole G.A.
Microbial biofilms: from ecology to molecular genetics.
Microbiol. Mol. Biol. Rev. 64, 847-867, 2000.
13-Donlan RM.
Biofilms: microbial life on surfaces.
Emerg Infect Dis, 8: 881-890, 2002.
14-Donlan R.M. and Costerton J.W.
Biofilms: survival mechanisms of
clinically relevant microorganisms.
Clin. Microbiol. Rev. 15, 167-193, 2002.
15-Donlan R.M.
Biofilm formation: a clinically relevant microbiological process.
Clin. Infect. Dis; 33(8), 1387-1392, 2001.
16-Getliffe K.and Newton R.
Catheter-associated urinary tract infections in primary and community health care.
Age and Aging, 35: 447-481, 2006.
17-Hostacka A. and Aiznar I.
Some properties of Plesiomonas shigelloides with aminoglycosides.
Folia Microbiol. 48, 659-663, 2003.
18-Hostacka A; Aiznar I; Slobodn?kov? L. and Kotulov? D.
Clinical Pseudomonas aeruginosa: potential factors of pathogenicity and resistance to antimicrobials.
Folia Microbiol. 51, 633-638, 2006.
19-Huttinger K.J; Rudi H. and Bomar M.T.
Influence of surface chemistry of the substrate on the adsorption of Escherichia coli.
Zentralbl. Bakteriol. Mikrobiol. Hyg. B, 184: 538-547, 1999.
20-Jones N; Binata R; Ranjit K. and Manna AC.
Antibacterial activity of ZnO nanoparticle suspensions on broad spectrum of microorganisms.
FEMS Microbiol. lett. 279, 71-76. 2008.
21-Kawamura-Sato K; Iinuma Y; Hasegawa T; Horii T; Yamashino T. and Ohta M.
Effect of subinhibitory concentrations of macrolides on expression of flagellin in Pseudomonas aeruginosa and Proteus mirabilis.
Antimicrob Agents Chemother 44(10): 2869-72, 2000.
22-Kunin C.
Nosocomial urinary tract infections and the indwelling catheter: What is new and what is true?
Chest; 120: 10-12. 2001.
23-Lorian V. and Popoola B.
The effect of nitrofurantoin on the morphology of gram-negative bacilli.
J. Infect. Dis. 125: 187-189, 1972.
24-Maki DG; Tambyah PA.
Engineering out the risk for infection with urinary catheters.
Emerg Infect Dis; 7: 342-7, 2001.
25-Maki DG; Knasinski V. and Tambyah PA.
Risk factors for catheterassociated urinary tract infection: a prospective study showing the minimal effects of catheter care violations on the risk of CAUTI.
Infect Control Hosp Epidemiol; 21: 165, 2000.
26-Mazumdar N.A; Rattan A.
Iodine incorporatied latex catheters In vitro Antimicrobial studies.
Trends biomatter. artif. Organs, 17: 33-28, 2003.
27-Mills S.A. and Marletta M.A.
Metal binding characteristics and role of iron oxidation in the ferric uptake regulator from Escherichia coli.
Biochemistry, 44: 13553-13559, 2005.
28-Niel-Weise BS. and van den Broek PJ.
Urinary catheter policies for shortterm bladder drainage in adults.
Cochrane Database Syst Rev; (3): CD 004203, 2005.
29-Oviedo P; Quiroga M; Pegels E; Husulak E. and Vergara M.
Effects of subinhibitory concentrations of ciprofloxacin on enterotoxigenic Escherichia coli virulence factors.
J. Chemother. 12, 487-490, 2000.
30-Polonio R.E, Mermel L.A, Paquette G.E. and Sperry J.F.
Eradication of biofilm-forming Staphylococcus epidermidis (RP62A) by a combination of sodium salicylate and vancomycin.
Antimicrob Agents Chemother 45, 3262-3266, 2001.
31-Roeder B.L; Nelson J.L; Robison R.L; Schaalje G.B; Robison R.A.and Pitt W.G.
Pulsed ultrasound enhances the killing of Escherichia coli biofilms by aminoglycoside antibiotics in vivo.
Antimic. Agents and Chemotherapy. 44 (3), 771-772, 2000.
32-Saint S. et al.
Preventing Hospital-Acquired Urinary Tract Infection in the United States:
A National Study Clin Infect Dis; 46: 243-250, 2008.
33-Saint S.
Clinical and economic consequences of nosocomial catheter-related bacteriuria.
Am J Infect Control; 28: 68-75, 2000.
34-Saint S; Wiese J; Amory JK. et al.
Are physicians aware of which of their patients have indwelling urinary catheters?
Am J Med; 109: 476-480, 2000.
35-Saint S; Kaufman SR; Rogers MAM; Baker PD; Boyko EJ. and Lipsky B.
Risk factors for nosocomial urinary tract related bacteremia: a case-control study.
Am J Infect Control; 34: 401-407, 2006.
36-Samuel U. and Guggenbichler JP.
Prevention of catheter-related infections: the potential of a new nano-silver impregnated catheter.
Int J Antimicrob Agents. 23Suppl 1: S75-8, 2004.
37-Stewart P.S; Wattanakaroon W; Goodrum L; Fortun S.M. and McLeod B.R.
Electrolytic generation of oxygen partially explains electrical enhancement of tobramycin efficacy against Pseudomonas aeruginosa biofilm, Antimicrob.
Agents Chemother. 43: 292-296, 1999.
38-Stickler D.J.
Bacterial biofilms in patients with indwelling urinary catheters.
Nature Clinical Practice Urology, 5; 598-604, 2008.
39-Syed M.A; Manzoor U; Shah I. and Bukhari H.A.
Antibacterial effects of Tungsten nanoparticles on the Escherichia coli strains isolated from catheterized urinary tract infection (UTI) cases and Staphylococcus aureus.
New Microbiologica, 33, 329-335, 2010.
40-Tambyah PA. and Maki DG.
Catheter-associated urinary tract infection is rarely symptomatic.
Arch Intern Med; 160: 678-687, 2000.
41-Tambyah P.A; Knasinski V. and Maki DG.
The direct costs of nosocomial catheter-associated urinary tract
infection in the era of managed care.
Infect Control Hosp Epidemiol; 23: 27-31, 2002.
42-Tissot E; Limat S; Cornette C. and Capellier G.
Risk factors for catheter associated bacteriuria in a medical intensive care unit.
Eur J Clin Microbiol Infect Dis; 20: 260-262. 2001.
43-Trautner B. and Darouche R.
Catheter-Associated Infections: Pathogenesis Affects Prevention.
Arch Intern Med; 164: 842-850. 2004.
44-Walters M.C; Roe F; Bugnicourt A; Franklin M.J. and Stewart P.S.
Contributions of antibiotic penetration, oxygen limitation, and low metabolic activity to tolerance of Pseudomonas aeruginosa biofilms to ciprofloxacin and tobramycin.
Antimicrob. Agents Chemother. 47, 317-323, 2003.
45-Whiteley M; Bangera M.G; Bumgarner R.E. et al.
Gene expression in pseudomonas aeruginosa biofilms.
Nature, 413, 860-864, 2001.
46-Wojnicz D; Klak M; Adamski R. and Jankowski S.
Influence of Subinhibitory Concentrations of Amikacin and Ciprofloxacin on Morphology and Adherence Ability of Uropathogenic Strains.
Folia Microbiol. 52 (4), 429-436 2007.
|
| |
| المجلد 6 ,
العدد 9
, جمادى الأولى 1434 - نيسان(أبريل) 2013 |
|
|
|
