| المجلد 6 ,
العدد 9
, جمادى الأولى 1434 - نيسان(أبريل) 2013 |
| |
| بروتين الصدمة الحرارية 60 ودوره في الداء القلبي التاجي |
| Heat Shock Protein 60 (HSP60)
and its Role in Coronary Heart Disease
|
| د. فجر عمر و أ.د. سحر الشماع |
| Omar F. and AL-Shamaa S. |
كلية الصيدلة- جامعة دمشق- سورية
Faculty of Pharmacy, Damascus University.
|
| الملخص Abstract |
| بروتين الصدمة الحرارية 60 (HSP60) هو شابيرونين متقدري، يُحتبس ضمن المتقدرات بصورة رئيسة. ووزنه الجزيئي 60 كيلودالتون، لكن يُعبَّر عنه على سطح الخلايا المجهدة ويجري إطلاقه إلى الدوران. HSP60 هو المسؤول عن تطوي البروتينات والتخلص من البروتينات ذات التطوي الخطأ. ويعد بروتين HSP60 واحد من أهم البروتينات التي تنطلق من الخلايا الظهارية المجهدة إلى الدوران ويؤدي إلى ضرر التهابي قوي لتلك الخلايا، الأمر الذي يُعجل في التصلب العصيدي. لهذا يعد HSP60 عامل اختطار للداء القلبي التاجي (CHD). جرت مقايسة المستويات المصلية لـلـ HSP60 بالطريقة المناعية الإنزيمية عند 84 شخصاً (53 مريضاً بداء قلبي تاجي coronary heart disease "CHD" و31 شخصاً صحيحاً ظاهرياً). وجدت مستويات HSP60 مصلية أعلى بشكل يُعتد به لدى مرضى القلب التاجي مقارنة مع مجموعة الأصحاء [P=0.0001]. نستنتج من هذه الدراسة أن مستويات البروتين HSP60 ترتفع في التصلب العصيدي وأمراض القلب التاجية. |
| HSP60 is a mitochondrial chaperonin, it is trapped essentially into mitochondria. Its molecular weight is 60 Kd, but expressed on stressed cells and released to circulation. HSP60 is responsible for protein folding and eliminating miss folded proteins. It has been reported that HSP60 is one of the most important proteins that releases from stressed endothelium cells to circulation, and leads to strong inflammation harmful to that cells, the matter which accelerates atherosclerosis. So HSP60 is considered a risk factor of CHD. Serum HSP60 levels were measured by enzyme immunoassay in 84 subjects (53 CHD patients, 31apparently healthy subjects). Serum HSP60 levels were found to be significant higher in CHD patients compared with healthy subjects (P=0.0001). From our study, we concluded that HSP60 levels elevate in coronary heart diseases. |
| المقدمة Introduction |
تعد أمراض القلب التاجية أو ما يعرف بالداء التاجي Coronary Disease السبب الأول للوفيات في الدول المتقدمة، بما فيها الولايات المتحدة الأميركية وفق إحصائيات الجمعية الأميركية لأمراض القلب (1). ينجم هذا الداء عن نقص التروية القلبية بسبب حدوث تبدلات عصيدية في جدار الشريان التاجي تعيق الجريان الدموي فيه، أو بسبب حدوث تشنج في الشريان التاجي مكان الآفة العصيدية (2).
يُعد التصلب العصيدي من الأمراض الالتهابية المزمنة، تشارك فيه المَناعَةٌ السَلِيقِيَّة (المَناعَةٌ الطَبيعِيَّة) Innate immunity والتلاؤمية Adaptive على السواء. حيث تتراكم الوحيدات Monocytes، البلاعم Macrophages، اللمفاويات التائية، خلايا العضلات الملساء، والوسائط الالتهابية ضمن اللويحة العصيدية في الجدار الوعائي. يُعد تراكم LDL-C وبشكل خاص ox LDL بشكل بؤري تحت البطانة عاملاً مهماً في اضطراب وظيفة البطانة الوعائية وفرط إجهادها وفقدان وظيفتها، حيث تقوم البلاعم بابتلاعه فتتحول إلى خلايا رغوية foam cells تتنخر وتتموت فتحرر المزيد من العوامل الالتهابية التي تفاقم الرد المناعي والالتهابي في منطقة الإصابة (3).
تتطور العصيدة عبر العديد من السنوات لتبرز إلى داخل لمعة الشريان مسببة تضيقه. وعندما يبلغ التضيق نصف اللمعة تبدأ الأعراض السريرية بالظهور على شكل ذبحة صدرية. وقد تتطور إلى اختلاطات للعصيدة بمراحلها المتقدمة مثل التمزق والتنخر والتخثر والتكلس. وقد تتسبب بحدوث احتشاء حاد للعضل القلبي ويمكن أن يكون مميتاً (4).
يعمل بروتين الصدمة الحرارية Heat Shock Protein 60 كشابيرونين متقدري Mitochondrial Chaperonin، أي متواجد ضمن المتقدرات Mitochondria، يرمز له اختصاراً HSP60. ولقد تم مؤخراً إثبات تواجده تحت ظروف غير فيزيولوجية على سطح الخلايا المجهدة. وهو مسؤول بشكل أساسي عن تطوي البروتينات بشكل صحيح أي تحويل البروتينات من البنية الخطية إلى البنية الثالثية، كما يقوم بالتخلص من البروتينات ذات التطوي الخطأ (5). ويجري التعبير عنه انطلاقاً من الجينHSPD1، والواقعة على الذراع الطويل للصبغي الثاني عند الموقع 33,1 (2q33,1) (6). يتألف من موحودات Monomers تنتظم في بنية معقدة على شكل حلقتين سباعيتين Heptameric ملتصقتين مع بعضهما البعض (7). تحصر هاتان الحلقتان فراغاً مركزياً لربط البروتين الأولي غير المطوى Unfolded عن طريق ثمالاته الكارهة للماء Hydrophobic. يبلغ حجم كل وحيدة Subunit لـلـ HSP60573 حمضاً أمينياً وتتألف كل منها من ثلاثة ميادين Domains وهي: الميدان القميّ Apical domain، والميدان المتوسط Intermediate والميدان الاستوائي Equatorial(8) (الشكل 1).
يعد HSP60 واحداً من بروتينات الصدمة الحرارية المقاومة للإجهاد والمسؤولة عن سلامة الخلية الحية، أو مايعرف بالاستتباب الخلوي Cellular Homeostasis، خاصة عند تبدل الظروف الحيوية المحيطة بالخلية مثل الإجهاد التأكسدي، الالتهاب، ارتفاع درجة الحرارة، تبدل
درجة الحموضة والسموم وغيرها. تعمل هذه التبدلات على زيادة بروتين الصدمة الحرارية للحفاظ على بنية البروتينات الخلوية (9). يعد HSP60 بروتيناً داخل خلوي بشكل أساسي. ويدل انتقاله إلى الدوران على تأذي الخلايا البطانية في الشريان التاجي وفرط إجهادها، مما جعله مشعراً للداء القلبي التاجي في كامل مراحله وعامل اختطار مولّد للتصلب العصيدي. وهذا مايؤكد وجوده بغزارة ضمن العصيدةAtheroma كدليل على تورطه في التصلب العصيدي. ولقد جرى إثبات عدة آليات تفسر الدور الذي يلعبه HSP60 في ترقي الداء القلبي التاجي عبر توليده للتصلب العصيدي (10-12).
1- آلية الإجهاد الوعائي
يعد LDL، خاصة الشكل المؤكسد OxLDL، وارتفاع التوتر الشرياني والتدخين من العوامل المجهدة للخلايا البطانية الشريانية، خاصة عند التفرعات، حيث تعاني من اضطراب في تدفق الدم، كما تعد العدوى بالمكورات الرئوية C. pneumoniae من أقوى المجهدات نظراً لتحريرها كميات كبيرة من HSP60 (13). يتسبب الإجهاد الوعائي في تطور التصلب العصيدي بمشاركة HSP60 عبر الآليات التالية:
- زيادة اصطناع بروتين الصدمة (HSP60) من الخلايا البطانية كرد فعل للإجهاد الممارس عليها، وظهوره بشكل كثيف على سطحها وانتقاله إلى الدوران ((10.
- يعد HSP60 السطحي والدوراني محرضاً قوياً للاستماتة Apoptosis ومحفزاً قوياً للجهاز المناعي، حيث يفعل الخلايا البطانية ويزيد تعبيرها عن جزيئات الالتصاق، والإندوتيللين-1 (Endothelin -1)، الذي يحرض تكاثر الخلايا الوعائية الملساء. كما ويلعب دوراً جاذباً للبلاعم والعدلات ويحرضها على إفراز العوامل الالتهابية والسيتوكينات الأمر الذي يزيد التخرب الالتهابي لبطانة الوعاء الدموي (14، 15(.
- إن أكسدة LDL إلى OxLDL السام وتراكمه تحت البطانة الوعائية يزيد من تخرب واستماتة هذه الخلايا، وبالتالي إنتاج كميات كبيرة من HSP60 (16(.
2- الآلية المناعية الذاتية
عدّ بعض الباحثين التصلب العصيدي واحداً من الأمراض المناعية الذاتية المزمنة، حيث تتشكل فيه أضداد تجاه مستضدات تظهر في بداية التصلب العصيدي مثل OxLDL (17، 18)، وتعد بعض بروتينات الصدمة الحرارية وعلى رأسها HSP60 من المستضدات الذاتية المفعّلة للجهاز المناعي، حيث تتشكل له أضداد نوعية سامة ومخربة للخلايا البطانية المعبرة عن HSP60 على سطحها (19).
|
 |
| المواد والطرق Material and Methods |
شملت الدراسة 84 شخصاً من الذكور، حيث جرى استثناء الإناث نظراً لصعوبة التأكد من عدم اصابتهن بالمتدثرة الحثرية Chlamydia trachomatis لأنها تسبب في حال وجودها ارتفاع HSP60 (13). جُمعت العينات من مركز الباسل لأمراض وجراحة القلب خلال 4 أشهر، من 1 كانون أول 2010 إلى 5 نيسان 2011. ووزع أفراد الدراسة إلى المجموعات التالية:
1- مجموعة الأصحاء: شملت 31 فرداً من الأصحاء ظاهرياً، أي أفراد لا يعانون من أمراض قلبية أو التهابية أو عدوائية أو خباثات أو داء سكري أو فَرْطُ ضَغْطِ الدَّم. ولقد كان متوسط أعمارهم±الانحراف المعياري 51±12 عاماً.
2- مجموعة مرضى القلب التاجي: شملت مرضى ذكور، عددهم 53 مريضاً، يعانون جميعهم من إصابة قلبية تاجية، متوسط أعمارهم±الانحراف المعياري 50±11 عاماً. حيث يعد الشخص مصاباً بمرض القلب التاجي إذا وجد لديه، بتصوير الأوعية التاجية، انسداد بنسبة 50% أو أكثر في واحد على الأقل من الشرايين التاجية. واُستبعد المرضى المصابون بأحد الأمراض العدوائية أو الالتهابية الحادة والمزمنة أو الداء السكري أو فرط ضغط الدم أو الربو.
أخذت عينات الدم، بعد صيام 12 ساعة، على أنبوب جاف وتركت في درجة حرارة الغرفة للتخثر التام، ثم نبذت بدرجة حرارة +4°م بسرعة 3500 دورة/ د لمدة عشر دقائق. استبعدت العينات المنحلة ووزع المصل على أربعة أنابيب إيبندروف وحفظت بالدرجة -80°م إلى حين موعد مقايستها (خلال ستة أشهر). قيس HSP60 بطريقة الممتز المناعي المرتبط بالإنزيم باستخدام عتيدة من شركة Stressgen الاميركية، كما قيس عامل النخر الورمي TNFα بالطريقة ذاتها باستخدام عتيدة من شركة Hycult biotech الهولندية. وجرت مقايسة كل من TCHol، LDL-C، HDL-C، TG بطريقة إنزيمية باستخدام عتائد من شركة هيومان الألمانية.
|
| النتائجResults |
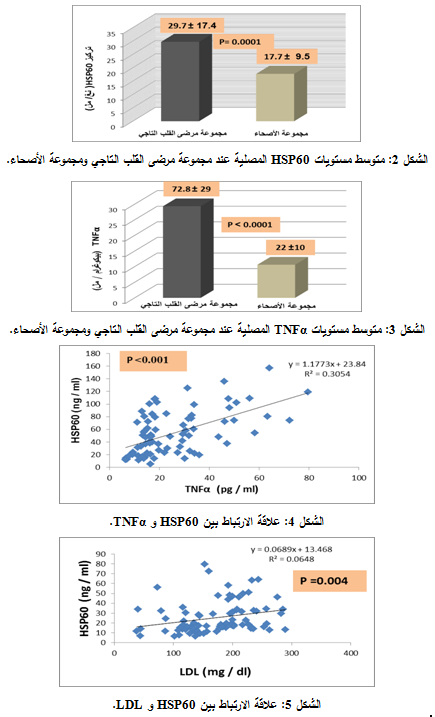
| لدى دراسة مستويات بروتين الصدمة الحرارية HSP60 عند مرضى القلب التاجي والأشخاص الأصحاء، ظهر ارتفاع هذا الواصم بشكل يُعتد به عند المجموعة المرضية، مقارنة بمجموعة الأصحاء (P=0.0001) (الشكل 2). كما أظهرت دراستنا وجود ارتفاع معتد به إحصائياً في مستوى عامل النخر الورمي TNFα عند مجموعة مرضى القلب التاجي مقارنة بمجموعة الأصحاء (0.0001>P) (الشكل 3). ولدى دراسة العلاقة بين HSP60 وبقية عوامل الاختطار القلبية، أظهرت دراستنا وجود ارتباط إيجابي معتد به مع عامل النخر الورمي TNFα (0.001>P) (الشكل 4)، كما أظهرت دراستنا علاقة ارتباط إيجابية معتد بها بين HSP60 وLDL-C (P=0.004) (الشكل 5). |
| المناقشةDiscussion |
أظهرت دراستنا وجود ارتفاع يعتد به احصائياً في قيم HSP60 المصلية لدى مرضى القلب التاجي مقارنة مع الأصحاء. يفسر ذلك بالدور الذي يلعبه هذا البروتين في التصلب العصيدي، حيث يؤدي إجهاد الخلية البطانية إلى زيادة اصطناع HSP60 لحماية الخلية. ولكن استمرار الإجهاد سيؤدي إلى نفاذه إلى خارج الخلية وانتشاره على سطحها وانتقاله إلى لدوران (10). يعد HSP60 السطحي والدوراني محفزاً قوياً للجهاز المناعي، حيث يفعل الخلايا البطانية ويزيد تعبيرها عن جزيئات الالتصاق والإندوتيللين-1 (1- Endothelin). كما ويلعب دوراً جاذباً للبلاعم والعدلات ويحرضها على إفراز العوامل الالتهابية والسيتوكينات، الأمر الذي يزيد التخرب الالتهابي لبطانة الوعاء الدموي. ومما يزيد هذا التخرب هو تدمير الخلايا البطانية بالأضداد الموجهة ضد HSP60 المنتشر على سطح هذه الخلايا (14(. ولقد توافقت نتائجنا مع نتائج دراسة Zhang X. et al. عام 2008 (20) ونتائج دراسة Shamaei-Tousi A. et al. عام 2007 (21)، ونتائج دراسة Xiao Q et al. عام
2005 (13). كما أظهرت نتائجنا وجود ارتفاع في مستويات TNFα المصلية عند مرضى القلب التاجي مقارنة مع مجموعة الأصحاء، وكان هذا الفارق معتداً به إحصائياً (0001>P). ويُفسر ذلك بكون التصلب العصيدي يترافق بهجرة الخلايا المناعية، وعلى رأسها البلاعم إلى منطقة الآفة، حيث تحرر هذه الخلايا عند تفعيلها TNFα. ونظراً لكون عامل النخر الورمي مرافقاً للالتهاب فلقد ثبت دوره في إطلاق العديد من السيتوكينات والعوامل الالتهابية مثل CRP، IL-1، IL-6، والفبرينوجين وإنترفيرون غما (IFN-γ)، خاصة مع التقدم بالعمر. وجميعها تفاقم العصيدة واختلاطاتها نتيجة الرد المناعي والالتهابي (22). وتوافقت نتائج دراستنا مع دراسة Rodondi N. وزملائه عام 2010 (23)، ودراسة BránénL et al. عام 2004 (24). ولدى دراسة العلاقة بين مستويات HSP60 ومستويات TNFα المصلية أظهرت النتائج علاقة ارتباط إيجابية يعتد بها احصائياً (0.001>(P، مما يثبت الفعل التآزري لهما في التصلب العصيدي. وتعود هذه العلاقة إلى أن تحرر بروتين الصدمة الحرارية من الخلايا البطانية المجهدة يعد محفزّاً قوياً للجهاز المناعي، حيث يعمل على جذب وتجنيد البلاعم وتفعيلها. يؤدي تفعيل البلاعم إلى إطلاق العديد من السيتوكينات الالتهابية وعلى رأسها عامل النخر الورمي TNFα (25). ولقد توافقت نتائجنا مع نتائج دراسة Alberse JA et al. عام 2011(26) ودراسة Lewthwaite J. et al. عام 2002 (27). كما أظهرت نتائجنا وجود ارتباط إيجابي يعتد به احصائياً بين مستويات LDL-C ومستويات HSP60 ويعود هذا إلى العلاقة المباشرة بينهما، حيث أن زيادة تركيز LDL-C هي التي تؤدي إلى زيادة إجهاد الخلايا البطانية وتخربها وبالتالي تحريرها لـلـ HSP60. ولقد توافقت نتائجنا مع نتائج دراسة Shamaei-Tousi A. et al. عام 2007 (21).
خلصت دراستنا إلى وجود علاقة بين HSP60 والتصلب العصيدي، مما يؤكد أهميته كعامل اختطار في أمراض القلب التاجية CHD عند مجموعة إحصائية من المرضى السوريين.
|
 |
| المراجع References |
1-Heart Disease and Stroke Statistics update, a report from the American Heart Association.
Circulation, 12-14, 2012.
2-Harisson.
Principle of internal medicine.
16th edition; vascular disease: 1425-1488, 2005.
3-Hansson G. and Libby P.
The immune response in atherosclerosis: a double-edged sword.
Nature Reviews Immunology, 6 (7): 508-519, 2006.
4-Larry J. and Gershon A.
The Pathogenesis, Prevention, and Treatment of Atherosclerosis in “Harrison`s Principles of Internal Medicine 17th ed”: Ed. Anthony S; Dennis L; Dan L. and Stephen L.
Section 5, Chapter 235: 456-461, 2008.
5-Trivedi V; Gadhvi P; Chorawala M. and Shah G.
Role of Heat Shock Proteins in Immune Response and Immunotherapy for Human Cancer.
International Journal of Pharmaceutical Sciences Review and Research, 2 (2): 58-60, 2010.
6-Faried LS. and Faried A.
HSPD1 (Heat Shock 60kDa Protein 1).
Atlas Genet Cytogenet Oncol Haematol, 2007.
7-Mongkolsuk S. and Schumann W.
Stress goes Far East: meeting report of the Sixth International Workshop on the Molecular Biology of Stress Responses.
Cell Stress Chaperones, 14 (3): 227-231, 2009.
8-Alexzander A. Asea A. and De Maio A.H. et al.
Shock Proteins: Potent Mediators of Inflammation and Immunity.
Springer: 123-126, 2007.
9-Heat Shock Proteins & the Cellular Stress Response.
Enzo Life Scie nces Inc; 4-35, 2010.
10-Fuji N. and Yokota Sh.
Immunomodulatory activity of extracellular heat shock proteins and their autoantibodies.
Journal of Microbiology and Immunology, 54: 300-304, 2010.
11-Cheng L; Zhang X; Hem A; Zhou L; Zeng H; Wang J; Wang F; Chen Y; Hu FB. and Wu T.
Joint effects of antibody to heat shock protein 60, hypertension, and diabetes on risk of coronary heart disease in Chinese.
Clin Chem, 54: 1046-1052, 2008.
12-Xiao Q; Mandal K; Schett G; Mayr M; Wick G; Oberhollenzer F; Willeit J; Kiechl S. and Xu Q.
Association of serum-soluble heat shock protein 60 with carotid atherosclerosis: clinical significance determined in a follow-up study.
Stroke, 36: 2571-2576, 2005.
13-Grundtman C; Kreutmayer S; Almanzar G; Marius C. and Georg W.
Heat Shock Protein 60 and Immune Inflammatory Responses in Atherosclerosis.
Arterioscler Thromb Vasc Biol, 31: 960-968, 2011.
14-Kim C; Gupta S; Davis B; Torre-Amione G. and Knowlton A.
In cardiac myocyte apoptosis HSP60 in heart failure: abnormal distribution and role.
Journal of Heart Circ. Physiol; 293: H2238-H2244. 2007.
15-De Graaf R; Kloppenburg G; Kitslaar PJ; Bruggeman C.A. and Stassen F.
Human heat shock protein 60 stimulates vascular smooth muscle cell proliferation through Toll-like receptors 2 and 4.
Microbes and Infection, 8 (7): 1859-1865, 2006.
16-Puijvelde G; van EsT; Wanrooij E; Habets L; de Vos P. and van der Zee R.
Induction of Oral Tolerance to HSP60 or an HSP60-Peptide Activates T Cell Regulation and Reduces Atherosclerosis. Thrombosis, and Vascular Biology.
Journal of the American Heart Association, 2676-2682, 2007.
17-Nilsson J. and Hansson G.K.
Autoimmunity in atherosclerosis: a protective response losing control?
Journal of Internal Medicine, 263 (5): 464-478, 2008.
18-Buono C; Binder C.J; Stavrakis G; Witztum J.L; Glimcher L.H; and Lichtman A.H.
T-bet deficiency reduces atherosclerosis and alters plaque antigen-specific immune responses.
Proceedings of the National Academy of Sciences of the United States of America, 102 (5): 1596-1601, 2005.
19-Fuji N. and Yokota Sh.
Immunomodulatory activity of extracellular heat shock proteins and their autoantibodies.
Journal of Microbiology and Immunology, 54: 303-305, 2010.
20-Zhang X; Mei'an He; Cheng L; Ying Chen; Li Zhou; Hesong Zeng; A. Pockley G; Frank B. and Tangchun Wu.
Elevated Heat Shock Protein 60 Levels Are Associated With Higher Risk of Coronary Heart Disease in Chinese.
Circulation, 118: 2687-2693, 2008.
21-Shamaei-Tousi A; Steptoe A; O'Donnell K; Palmen J; Stephens JW; Hurel SJ; Marmot M; Homer K; D'Aiuto F; Coates AR; Humphries SE. and Henderson B.
Plasma heat shock protein 60 and cardiovascular disease risk: the role of psychosocial, genetic, and biological factors.
Cell Stress Chaperones, 12 (4): 384-392, 2007.
22-Manzi S; Meilahn EN; Rairie JE; Conte CG; Medsger TA Jr. and Jansen-McWilliams L.
Age-specific incidence rates of myocardial infarction and angina in women with systemic lupus erythematosus: comparison with the Framingham Study.
Am J Epidemiol, 145(5): 408-415, 2008.
23-Rodondi N; Marques-Vidal P; Butler J; Sutton-Tyrrell S; Cornuz J; Satterfield S; Harris T; Bauer D; Ferrucci L; Vittinghoff E. and Anne B.
Markers of Atherosclerosis and Inflammation for Prediction of Coronary Heart Disease in Older Adults.
American Journal of Epidemiology, 171(5): 540-549, 2010.
24-Br?nén L; Hovgaard L; Nitulescu M; Bengtsson E; Nilsson J. and Jovinge S.
Inhibition of Tumor Necrosis Factor-a Reduces Atherosclerosis in Apolipoprotein E Knockout Mice.
Arterioscler Thromb Vasc Biol, 24: 2137-2142, 2004.
25-Gayle E; David W; Carey M; Sattar N. and McInnes I.
Role for TNF in atherosclerosis? Lessons from autoimmune disease.
Nature Reviews Cardiology, 6: 410-417, 2009.
26-Alberse JA; Kapitein B; Roock S; Klein M; de JagerW; van der Zee R; Hoekstra M; Wijk F. and Prakken B.
Cord Blood CD4+ T Cells Respond to Self-Heat Shock Protein, 60 (HSP60).
PLoS ONE, 6(241): 1-8, 2011.
27-Lewthwaite J; Owen N; Coates A; Henderson B. and Steptoe A.
Circulating human heat shock protein 60 in the plasma of British civil servants: relationship to physiological and psychosocial stress.
Circulation, 106 (2): 196-201, 2002.
|
| |
| |
| المجلد 6 ,
العدد 9
, جمادى الأولى 1434 - نيسان(أبريل) 2013 |
|
|
|
