| المجلد 6 ,
العدد 9
, جمادى الأولى 1434 - نيسان(أبريل) 2013 |
| |
| مقايسة مستويات الأضداد الذاتية للبروتين الكابح للورم p53
لدى مرضى سرطان رئة في سورية
|
| Measurement of p53 Auto-antibodies Levels
in Lung Cancer Patients in Syria
|
| د. شفيق مراد، أ.د. عبدو عطايا و أ.د. جمانة الصالح |
| Murad Sh; Ataya A. and Salh J. |
كلية الصيدلة، جامعة دمشق
Faculty of Pharmacy, Damascus University.
|
| الملخص Abstract |
الخلفية: تُعد طفرات p53 أكثر الطفرات الجينية شيوعاً في الأورام البشرية، فلقد وُجد أن البروتين p53 الطافر يحرض على تشكيل الأضداد الذاتية في مصول مرضى مصابين بأنماط مختلفة من الأورام، لذلك فإن تحليل أضداد p53 المصلية يمكن أن يكون مفيداً في اكتشاف جين p53 الطافر.
الهدف: قياس مستويات أضداد p53-Abs في مصول مأخوذة من مرضى سرطان رئة. وتقييم علاقتها مع المتثابتات السريرية التالية: الجنس، التدخين، تصنيف الورم وفقاً لنتيجة التشريح المرضي، التصنيف المرحلي للورم.
الطرق: جُمعت عينات مصل من 92 مريض سرطان رئوي و34 شخصاً سوياً في الفترة ما بين عامي 2008-2010 من مرضى راجعوا ثلاث مشافي رئيسة في دمشق (المواساة والأسد والمجتهد). قيست مستويات أضداد p53-Abs باستخدام تقنية مُقَايَسَةُ المُمْتَزِّ المَناعِيِّ المُرْتَبِطِ بالإِنْزِيْم ELISA المعتمدة مبدأ الشطيرة (باستخدام عتيدة من شركة BIODIAGNOSTIC، ألمانيا).
النتائج: كُشفت أضداد p53-Abs لدى 16 من أصل 92 (17.4%) مريضاً مصاباً بسرطان رئة، بينما لم تُكشف هذه الأضداد لدى أي فرد من مجموعة الأصحاء وكان الفارق معتداً به إحصائياً بين المجموعتين (P=0.009). ولم يكن هنالك أي ارتباط معتد به بين أضداد p53-Abs وكلاً من الجنس (P=0.96)، التدخين (p=0.65)، تصنيف الورم وفقاً لنتيجة التشريح المرضي (سرطان صغير خلايا SCLC أو سرطان غير صغير الخلايا NSCLC) (p=0.22)، التصنيف المرحلي للسرطان صغير الخلايا (محدود Limited Disease أو ممتد Extensive Disease) (p=0.21).
كان وجود الأضداد p53-Abs أكبر لدى مرضى السرطانة الغدية، بالمقارنة مع مرضى السرطانة شائكة الخلايا (p=0.04)، كما أن وجود الأضداد كان أعلى لدى مرضى NSCLC في المراحل المتقدمة (Stage III, IV)، بالمقارنة مع مرضى المراحل المبكرة (Stag I, II) (P=0.45).
الاستنتاج: يمكن أن تُستخدم الأضداد p53-Abs كواصم ورمي مصلي لمرضى سرطان الرئة في التحري والكشف المبكر عن الورم.
|
Background: p53 mutations are the most common genetic mutations in human cancer, and mutated p53 protein was found to induce p53 Auto-antibodies in sera of patients with various types of cancers, serum p53-Abs measurement may be useful for detection mutant p53 gene.
AIM: Measure p53-Abs in sera from lung cancer patients, and evaluate its correlation to following clinical parameters: gender, smoking, histopathology classification of tumor and staging classification of tumor.
Methods: serum samples from 92 patients with lung cancer and 34 healthy individuals were collected between 2008-2010, patients admitted to the 3 main hospitals in Damascus (ALMouasat, ALAsad and ALMujtahd). p53-Abs levels were measured by sandwich ELISA (Biodiagnostic, Germany).
Results: p53-Abs were detected in 16/92 (17.4%) lung cancer patients, whereas none of the healthy group sera were positive for p53-Abs, the difference was statistically significant (P=0.009). There was no significant correlation between the presence of p53-Abs and each of: gender (P=0.96), smoking (p=0.65), histopathology classification of tumor (Small Cell Lung Cancer SCLC or Non Small Cell Lung Cancer NSCLC) (p=0.22), staging classification of SCLC (Limited Disease LD or Extensive Disease ED) (p=0.21).
The presence of p53-Abs was significantly higher in Adenocarcinoma NSCLC patients, in comparison to Squamous Carcinoma NSCLC patients (p=0.04), the presence of p53-Abs was significantly higher in Advanced NSCLC (Stage III, IV), in comparison to Early NSCLC (Stage I, II) (P=0.45).
Conclusion: p53-Abs can be used as Serological tumor marker for lung cancer screening and for early diagnosis.
|
| المقدمة Introduction |
يُعد سرطان الرئة أكثر أنواع السرطانات حدوثاً عند الإنسان، وهو عالمياً من أكثر أسباب الوفيات السرطانية (1). وتشير الإحصائيات إلى تزايد في معدلات الإصابة بالسرطان في سورية ومن أهمها سرطان الرئة، حيث تحتل الأورام المرتبة السابعة ضمن الأمراض الأكثر شيوعاً عند السوريين، وتُعد الأورام السبب الثالث للوفيات في سورية (7% من أسباب الوفاة) (2)، كما أن سرطان الرئة هو الأكثر شيوعاً عند الذكور السوريين، ويشكل السبب الرئيسي للوفيات السرطانية (3)، يحتفظ سرطان الرئة بإنذاره السيء جداً، فعلى الرغم من التطور في التقنيات العلاجية فإن البُقيا Survival لمدة خمس سنوات بالنسبة لإجمالي مرضى سرطان الرئة لا تتجاوز 16% فقط (4).
يُعد تدخين السجائر مسؤولاً عن حوالي 87% من حالات السرطان الرئوي (5). ولقد جرى إثبات العلاقة بين التدخين والسرطان الرئوي بعد اكتشاف أن مستقلب مركب البنزوبيرين Benzopyrine وهو أحد مكونات دخان التبغ يؤدي إلى أذية الجين الكابحة للورم (p53). ويتأثر السرطان الرئوي بالعامل الوراثي بشكل كبير جداً وأهم تلك الجينات هي جين p53، فهذه الجين تكون شاذة عند حوالي 60% من حالات سرطان الرئة البدئي (6).
تلعب جبن p53 دوراً محصناً للحفاظ على ثباتية الجينوم، من خلال المراقبة الدائمة لأية أذية تصيب المادة الوراثية (7)، حيث يجري التعبير عن P53 في الخلايا المنقسمة بشكل سوي بكميات ضئيلة جداً. ولكن عند أذية المادة الوراثية في الخلية وكاستجابة لهذه الأذية ترتفع مستويات البروتين p53 ضمن الخلية، الأمر الذي يؤدي إلى إبقاء وحصر الخلية في الطور G1، مما يتيح المجال لإصلاح الدنا المتضرر قبل الدخول في الطور S (8)، ولكن في حال كانت أذية المادة الوراثية كبيرة وغير قابلة للعكس يقوم البروتين p53 بتحريض الاستماتة الخلوية (9)، وفي الخلايا السرطانية التي يتولد فيها بروتين p53 طافر، يكون هذا البروتين الطافر غير قادر على ضبط التكاثر الخلوي، مما ينجم عنه إصلاح غير تام للدنا DNA وظهور خلايا غير مستقرة وراثياً وبالتالي تشكل الورم (10).
يمكن أن يفقد p53 وظيفته الطبيعية بعدة آليات كحدوث تبدلات في جين p53 (11)، أو من خلال تشكيل معقدات بروتينية مع بروتينات فيروسات الأورام (12)، أو بالارتباط مع بروتينات خلوية مثل بروتين mdm2 (13)، أو نتيجة خلل في توضع بروتين p53 ضمن أجزاء الخلية (14). وتُعد الطفرات الحاصلة في جين p53 أكثر الطفرات شيوعاً في الأورام البشرية، وبالتالي يمكن أن يفيد الكشف عن هذه الطفرات في تحديد إنذار الورم، أو تقييم مدى الاستجابة على العلاج (15).
إن معظم الطفرات في جين p53 هي طفرات نقطية وتقود غالباً إلى التعبير عن البروتين p53 الطافر والذي له نصف عمر أطول بالمقارنة مع بروتين النمط الطبيعي (16). وهناك علاقة ارتباط قوية بين تواتر ظهور الأضداد p53-Abs وطفرات جين p53 فحوالي 20-40% من مرضى السرطان الذين لديهم طفرات p53 تتولد لديهم أضداد p53 في المصل. وتكون هذه العلاقة قوية جداً في حالة السرطان الرئوي، مما يؤكد الدور الهام لطفرات جين p53 في تشكل p53-Abs(17). فأضداد p53-Abs تتشكل عند نسبة من مرضى السرطان تختلف من ورم لآخر، والفرضيات حول آلية تشكل الأضداد p53-Abs عديدة، فقد يعتمد تشكلها على نمط الطفرة في جين p53 (18)، أو على تشكل معقد مع بروتين الصدمة الحرارية 70 (19)، أو يكون بسبب تراكم p53 ضمن النسيج الورمي والذي يحرض الاستجابة المناعية لدى مرضى الأورام (20).
إنّ تواجد الأضداد p53-Abs لدى الأفراد ذوي الاختطار العالي للإصابة بالسرطان مثل العاملين المعرضين للمواد المسرطنة أو المدخنين بشدة يمكن أن يكون احتمالاً واعداً للتشخيص المبكر للسرطان (17). ويمكن استخدام الكشف عن هذه الأضداد لتحري الأفراد أو للتشخيص المبكر (21). ويمكن استخدام مقايسة الأضداد في مراقبة علاج المرضى وتقييم الاستجابة له (22).
|
| المواد والطرق Materials and Methods |
أفراد الدراسة Study population
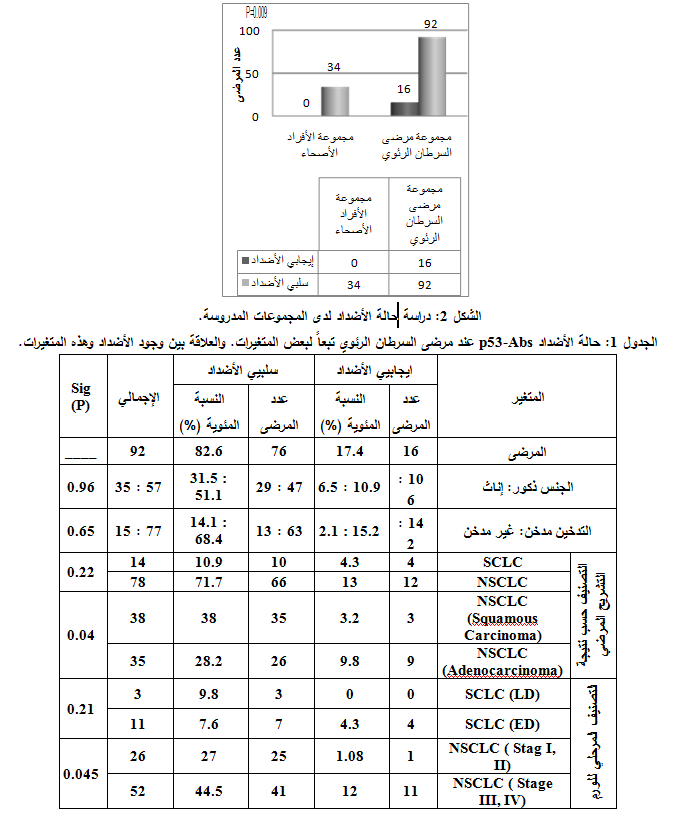
شملت الدراسة 126 شخصاً توزعوا كما يلي (الشكل 1).
• مجموعة الأفراد الأسوياء: ضمت 34 شخصاً سوياً ظاهرياً (21 ذكور، 13 إناث)، متوسط أعمارهم 51±14.3 عاماً.
• مجموعة مرضى سرطان الرئة: ضمت 92 مريضاً (57 ذكور، 35 إناث) جرى تأكيد تشخيص إصابتهم بالسرطان الرئوي، متوسط أعمارهم 54±16.9 عاماً.
|
| الإعتيان Sampling |
مرضى الدراسة هم مرضى الشعب الصدرية والجراحة الصدرية في المستشفيات التالية: المواساة الجامعي، المجتهد، الأسد الجامعي، حيث جُمع 5 مل من الدم الوريدي من المريض على أنبوب جاف، ونبّذت كل عينة بسرعة 3000 دورة/ دقيقة لمدة 10 دقائق، ووزع المصل Serum الناتج على ثلاثة أنابيب إيبندورف صغيرة، حُفظت إلى حين إجراء المقايسة بدرجة حرارة – 60 مْ.
التحري عن الأضداد p53 Abs المصلية
جرى التحري وقياس مستويات أضداد p53-Abs في المصل باستخدام عتيدة لشركة Biodiagnostic الألمانية، حيث يعتمد مبدأ الاختبار على طريقة المقايسة المناعية المرتبطة بالإنزيم نمط الشطيرة (Sandwich-ELISA)، تثبت فيها خلاصات من خلايا ورمية بشرية تحوي بروتين p53 في بطانة آبار طبق المعايرة بوساطة أضداد وحيدة النسيلة ضد p53. ولكشف الارتباط غير النوعي بين أضداد p53 المصلية ومعقد ضد-المستضد، جرى إدخال طبق معايرة آخر مغلف بمستضد عبارة عن خلاصات خلوية ورمية خالية من p53.
يضاف في المرحلة الأولى المصل إلى آبار طبق المعايرة، ومن ثم تُكشف أضداد p53 الموجودة في المصل بعد إجراء الغسيل للطبق بوساطة الأضداد ضد IgG البشري المقترنة بالبيروكسيداز، وبعد خطوة غسيل أخرى تُقاس أضداد p53 من خلال ظهور اللون بإضافة الركازة ومن ثم يوقف التفاعل بإضافة محلول التوقف. يقاس اللون الناتج باستخدام ELISA-reader (قارئ إليزا) بموجة طولها 450 نانومتر. كانت العينة تُعد إيجابية الأضداد p53-Abs عندما كان تركيز الأضداد أكبر من القيمة الحدية (Cut-off value) لأضداد p53 الإيجابية، أي أكبر من µg/ml 0.4 وتُعد سلبية الأضداد دون هذا التركيز.
التحليل الإحصائي Statistical Analysis
جرى حساب المتوسط الحسابي والانحراف المعياري بالنسبة لكل مجموعة، واعتمد اختبار كاي مربع لدراسة كون الفارق في تكرار ورود أضداد p53 ناجماً عن الصدفة أم أنه فارق معتد به إحصائياً، كما اعتمدت قيمة P<0.05 كونها تدل على قيمة إحصائية يُعتد بها. |
 |
| النتائج Results |
مجموعة الأفراد الأسوياء: لم يتم الكشف عن الأضداد p53-Abs عند أي شخص سوي.
مجموعة مرضى سرطان الرئة: من أصل 92 مريضاً كان عدد المرضى إيجابيي الأضداد p53-Abs 16 مريضاً (17.4% من إجمالي عدد مرضى السرطان الرئوي) (الشكل 2).
وبتطبيق اختبار كاي مربع كانت قيمة P=0.009 وهي أصغر بكثير من القيمة 0.05. وهي تؤكد وجود فارق يُعتد به إحصائياً في تكرار ورود الأضداد بين المجموعتين المدروستين.
جرت دراسة حالة الأضداد (إيجابي الأضداد أو سلبي الأضداد) لدى مرضى السرطان الرئوي وعلاقتها بـالمتغيرات التالية: الجنس، التدخين، تصنيف الورم وفقاً لنتيجة التشريح المرضي، التصنيف المرحلي للورم (الجدول 1).
|
 |
| المناقشة Discussion |
يتراكم بروتين p53 اللاوظيفي داخل الخلايا الورمية محرضاً على تشكل الأضداد p53-Abs. بينت دراستنا أن نسبة المرضى ايجابيي الأضداد p53-Abs ضمن مرضى السرطان الرئوي هي 17.4% (16 من أصل 92 مريض)، بينما كانت هذه النسبة 0% لدى الأفراد الأسوياء، لذلك يمكن اعتبار أضداد p53-Abs واصماً مصلياً نوعياً لمرضى السرطان الرئوي.
اختلفت نسبة المرضى إيجابيي الأضداد حسب الدراسات، وذلك بسبب استخدام طرائق مختلفة كطريقة ELISA أو طريقة التلطيخ المناعي western blotting، أو بسبب اختلاف المستضد المستخدم في طريقة ELISA؛ وأدق طرق ELISA هي التي تستخدم المستضد المأخوذ من خلايا ورمية بشرية وهو المستضد المطبق في العتيدة المستخدمة من قبلنا.
بينت دراستنا أن ظهور الأضداد p53-Abs مستقل عن كلٍ من الجنس (P=0.96)، التدخين (P= 0.65)، نوع السرطان الرئوي صغير الخلايا SCLC أو غير صغير الخلايا NSCLC (P=0.22)، التصنيف المرحلي لمرضى السرطان الرئوي صغير الخلايا كونه مرضاً محدوداً LD أو ممتداً ED (P=0.21).
بينت دراستنا أن تواتر ظهور أضداد p53-Abs يكون أكبر لدى المرضى المصابين بالسرطانة شائكة الخلايا Squamous cells Carcinoma وذلك بالمقارنة مع المرضى المصابين بالسرطانة الغدية Adenocarcinoma (P=0.04)، من المحتمل أن يكون ذلك بسبب تواتر الحالات الأكثر لفرط التعبير عن بروتين p53 في السرطانة شائكة الخلايا ولقد توافقت دراستنا مع دراسة Mitsudomi et al. 1998 (23).
بينت دراستنا أن تواتر ظهور الأضداد p53-Abs يكون أكبر لدى مرضى السرطان الرئوي غير صغير الخلايا NSCLC في المراحل المتقدمة (Stage III, IV) بالمقارنة مع مرضى المراحل المبكرة (Stage I, II) (P= 0.045)، وقد يكون هذا بسبب التحفيز المستمر للجهاز المناعي، من خلال وجود كمية أكبر من المستضدات، نتيجة تراكم البروتين الطافر بشكل كبير في المراحل المتقدمة. توافقت نتائج دراستنا مع نتائج دراسة كلٍ من: Mitsudomi et al., عام 1998 (23) وMack U. et al. عام 2000 (24) وSangrajrang S. عام 2003 (25). وتعارضت مع دراسة Berqvist et al. عام 2003 (26).
|
| المراجع References |
1-Lynnt Tanoue, Richard A. Matthy.
Lung Cancer: Epidemiology and Carcinogenesis, General Thoracic Surgery, Vol 2, 6th ed, Lippincot Williams & Wilkins; 1425-1426, 2005.
2- وزارة الصحة، النشرة الإحصائية الصحية، الإصدار الخامس 2009.
3- السجل الوطني للسرطان، التقرير التجميعي الأول لمعدل الإصابة بمرض السرطان في سورية للفترة بين 2002 و2007.
4-Jemal A; SiegelR; Ward E. et al.
Cancer statistics, 2009.
CA Cancer J Clin; 59: 225, 2009.
5-Wingo PA; Ries LAG; Giovino GA. et al.
Annual report to the nation on the status of cancer, 1973-1996, with special Section on Lung Cancer 7 tobacco smoking.
J Natl Cancer Inst; 91-675, 1999.
6-Denissenko MF; Pao A; Tang M. and Pfeifer GP.
Preferential formation of benzo (a) pyrene adducts at lung cancer mutational hotspots in p53.
Science, 274: 430, 1996.
7-Pietenpol JA. and Vogelstein B.
Tumor suppressor gene. No room at the p53 inn.
Nature, 365: 176-180, 1993.
8-Waga S; Hannon GJ. and Beach D.
The p21 inhibitor cyclin-dependent kinases controls DNA replication by interaction with PCNA.
Nature, 369: 574-578, 1994.
9-Yonish M. and Rouach E.
The Tumor suppressor gene. A mediator of a G1 growth arrest and
of apoptosis.
Experientia, 52: 1001, 1996.
10-Oren M. and Rotter V.
p53-the first twenty years.
Cell. Mol. Life Sci. 55: 9-11, 1999.
11-Soussi T; Legros Y. and Lubin R.
Multifactorial analysis of p53 alteration in human cancer.
Int J Cancer, 57: 1-9, 1994.
12-Levine AJ.
The p53 protein and its interactions with the oncogene products of the small DNA tumor viruses. Virology, 177: 419-426, 1990.
13-Cordon-Cardo C; Latres E. and Drobnjak M.
Moleculare abnormalities of mdm2 and p53 genes in adult soft tissue sarcomas.
Cancer Res; 54: 794-799, 1994.
14-Moll UM; Riou G. and Levine AJ.
Tow distinct mechanisms alter p53 in breast cancer. Mutation and nuclear exclusion.
Proc Nalt Acad Sci; USA, 89: 7262-7266, 1992.
15-Angelopoulou K; Yu H; Bharaj B; Giai M. and Diamandis PE.
P53 gene mutation tumor P53 Protein Overexpression, and serum P53 autoantibody generation in patients with breast cancer.
Clinical Biochemistry, 33(1): 53-62, 2000.
16-Chang F; Syrjanen S. and Synjanen K.
Implications of the p53 tumor-suppressor gene in clinical oncology.
J. Clin. Oncol; 13: 1009-1022, 1995.
17-Soussi T.
p53 Antibodies in the Sera of Patients with Various Types of Cancer.
Cancer research, 60: 1777-1788, 2000.
18-Montenarh M. and Gotz C.
P53 autoantibodies and human malignancies.
4: 991-1010, 1997.
19-Davidoff AM; Iglehart JD. and Marks JR.
Immune response to P53 is dependent upon p53 HSP 70 complexes in breast cancer.
Proc Natl Acad Sci; 89: 3439-3442, 1992.
20-Hainaut P; Soussi T; Shomer B; Hollstein M; Greenblant M; Hoving E; Harris CC. and Montesano R.
Database of p53 gene somatic mutations in human tumors and cell lines; Updated complication and future prospect.
Nucleic acids Res; 25: 151, 1997.
21-Sakai H.
Detection of serum anti-p53 antibodies in patients with various types of cancer.
Rinsho Byori; 50 (1): 90-92, 2002.
22-Hassapoglidou S; Diamandis EP. and Sutherland DJA.
Quantification of p53 protein in tumor cell lines, breast tissue extracts and serum with time.
Resolved immunofluorometry Oncogene, 8: 1501, 1993.
23-Mitsudomi T; Suzuki S; Yatabe Y; Nishio M; Kuwabara M; Gotoh K; Hatooka S; Shinoda M; Suyama M; Ogawa M; Takahashi T; Ariyoshi Y. and Takahashi T.
Clinical implications of p53 autoantibodies in the sera of patients with non-small-cell lung cancer.
J Natl Cancer Inst; 21; 90(20):1563-1568; 1998.
24-Mack U; Ukena D; Montenarh M. and Sybrecht GW.
Serum anti-p53 antibodies in patients with lung cancer.
Oncol Rep; 7(3): 669-674, 2000.
25-Sangrajrang S; Sornprom A; Chernrungroj G. and Soussi T.
Serum p53 antibodies in patients with lung cancer: correlation with clinic-pathologic features and smoking.
Lung Cancer; 39(3): 297-301, 2003.
26-Michael Bergqvist, Daniel Brattstr?m1, Anders Larsson, Patrik Hesselius, Ola Brodin and Gunnar Wagenius.
The presence of anti p53 antibodies in sera perior to thoracic surgery in NSCLC patients: its implications on Tumor volume, Nodal involvement, and Survival.
Neoplasia, 5, 4, 283-287, 2003.
|
| |
| المجلد 6 ,
العدد 9
, جمادى الأولى 1434 - نيسان(أبريل) 2013 |
|
|
|
