| المجلد 6 ,
العدد 9
, جمادى الأولى 1434 - نيسان(أبريل) 2013 |
| |
| الواصمات المعتمدة والبازغة لوظيفة الكلية |
| Established and Emerging Markers of Kidney Function |
ميخائيل أ. فرغوزن وسوشروت س. وايكر
Michael A. Ferguson and Sushrut S. Waikar
Clinical Chemistry, 58(4): 680-689, 2012.
|
| ترجمة وإعداد: د. مجد الجمالي |
كلية الصيدلة، جامعة دمشق
Faculty of Pharmacy, Damascus University
|
خلفية: تؤدي الكلية العديد من الوظائف الأساسية للمحافظة على الاستتباب. وفي الطب
السريري، تزودنا سرعة الترشيح الكبيبي Glomerular (GFR) Filtration Rate بالمشعر الأفضل لوظيفة الكلية بشكل عام، وتضيف البيلة البروتينية
معلومات إضافية عن الإنذار الكلوي وغير الكلوي. ويجري التحري حالياً عن العديد من
الواصمات الحيوية الحديثة.
المحتوى: يعدّ تركيز الكرياتينين في
البلازما المقياس الأكثر استخداماً لتقدير الـ GFR. وأمكن للسيستاتين C في البلازما وبروتين الأثر بيتا β-trace protein إثبات تفوقهما على
الكرياتينين. يمكن أن تقاس الـ GFR مباشرةً باستخدام واصمات الترشيح الخارجية، على
الرغم من محدودية وظيفتهم بشكل رئيسي في مجال البحث، ويمكن أن يتوفر في المستقبل
قياس غير باضع وفي الزمن الحقيقي Real-time للـ GFR عبر استخدام واصمات موسومة بالفلورة. ولقد تمكّنت
واصمات حيوية حديثة للأذية النبيبية مثل الليبوكالين المترافق مع جيلاتيناز
العدلات “neutrophil gelatinase-associated
lipocalin”،
جزيء أذية الكلية-1 “kidney injury molecule -1”، البروتين الرابط للحمض الدهني من
النمط الكبدي “liver-type fatty acid binding
protein”،
ن-أسيتيل-بيتا-D-غلوكوزأمينيداز ” “N-acetyl-“β-(D)-glucosaminidase، الإنترلوكين 18، من تحري الأذية
الحادّة للكلية قبل أو مع وجود تبدل ما في سرعة الترشيح الكبيبي.
الاستنتاج: تتوفر
طرق عدة تساعد الطبيب في تقدير وظيفة الكلية وأذيتها، وستساعد التحريات المجراة
حالياً في تحديد استخدام عدد من الواصمات الجديدة وتوضيح أدوارها في العناية بمرضى
الداء الكلوي.
تُعدّ سرعة الترشيح الكبيبي المقدّرة Estimated GFR (eGFR) المتغيّر الأكثر أهميةً لدى تعيين
المرضى ممن لديهم داء كلوي معروف أو مشكوك به. يجري تبيان الـ eGFR بالميلي لتر في الدقيقة بشكل نمطي
ويُصحَّح نسبةً إلى مساحة سطح الجسم المعياري {مل X دقيقة -1 X (1.73 م2)-1}.
عادةً ما تترافق الـ GFR المتناقصة بشكل ثابت أو مزمن مع انخفاض في المعالم الوظيفية الأخرى
للكلية، وينتج عن ذلك تبدل في توازن الحجم والشوارد، وانخفاض في إنتاج خلايا
الكريات الحمراء، وارتفاع في الضغط، و/أو تبدل في استقلاب المعادن المكوّنة
للعظام. نتيجة لذلك، عادةً ما يتم قبول الـ eGFR بوصفها أفضل مقياس للوظيفة العامة
للكلية. يسمح التقدير الدقيق لـ GFR بالتحديد الملائم للإنذار ومراقبة مرضى الداء الكلوي
المزمن Chronic
Kidney (CKD) Diseaseعبر الزمن. لقد
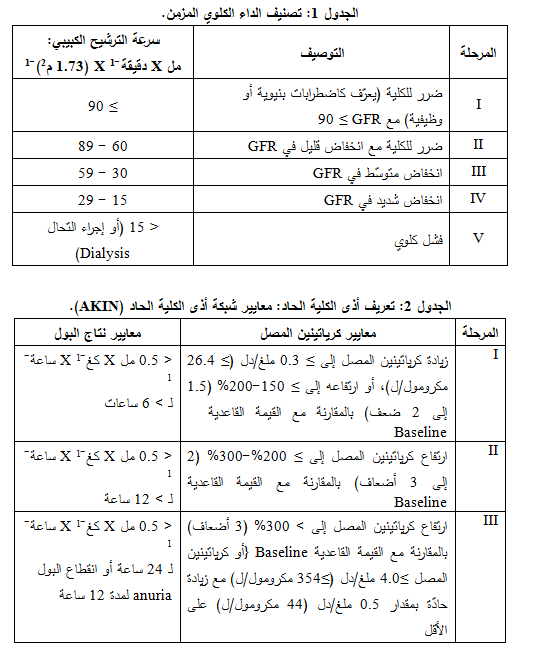
عرّفت "المؤسسة الوطنية للكلية والداء الكلوي ومبادرة الجودة" مراحل CKD بشكل كبير اعتماداً على مستوى الـ eGFR (الجدول 1) (1). بالإضافةً
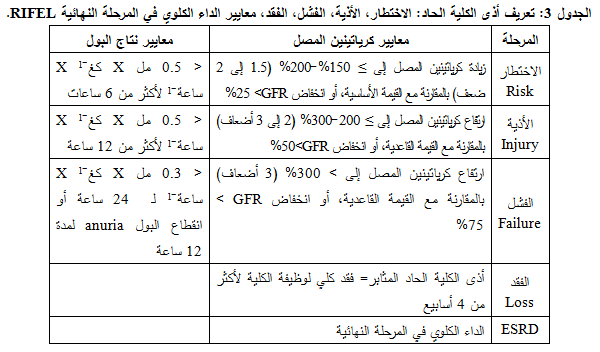
إلى ذلك جرى تطوير مقترحين لتصنيف أذى الكلية الحاد Acute Kidney Injury (AKI)، وشبكة أذى الكلية الحاد AKI Network،
ومعايير الاختطار، والأذى، والفشل، والفقد، والداء الكلوي في المرحلة النهائية RIFEL Criteria (1، 2)، والتي تعتمد على الانخفاض في الـ GFR الذي
ينعكس بتبدل
نتاج الكرياتينين أو البول (الجدولان 2 و3). يمكن تقدير العديد من واصمات الـ GFR عبر اختبار الدم الروتيني. بالإضافة إلى ذلك، يمكن قياس الواصمات
الداخلية والخارجية باستخدام الطرق المعتمدة
على التصفية. وأخيراً، يمكن للواصمات
البولية الحديثة لأذى الكلية أن تكمّل تقدير الـ GFR ويبدو أنها تتنبأ بتطور AKI و CKD. يعرّف الداء الكلوي المزمن إما بوجود أذى كلوي أو GFR أقل من 60 لمدة ? ثلاثة أشهر. يعرّف الأذى الكلوي باضطرابات مرضية أو بوجود
واصمات للأذية، وتشمل اضطراباتٍ في اختبارات الدم أو البول أو في نتائج الدراسات
المعتمدة على تصوير الكلية.
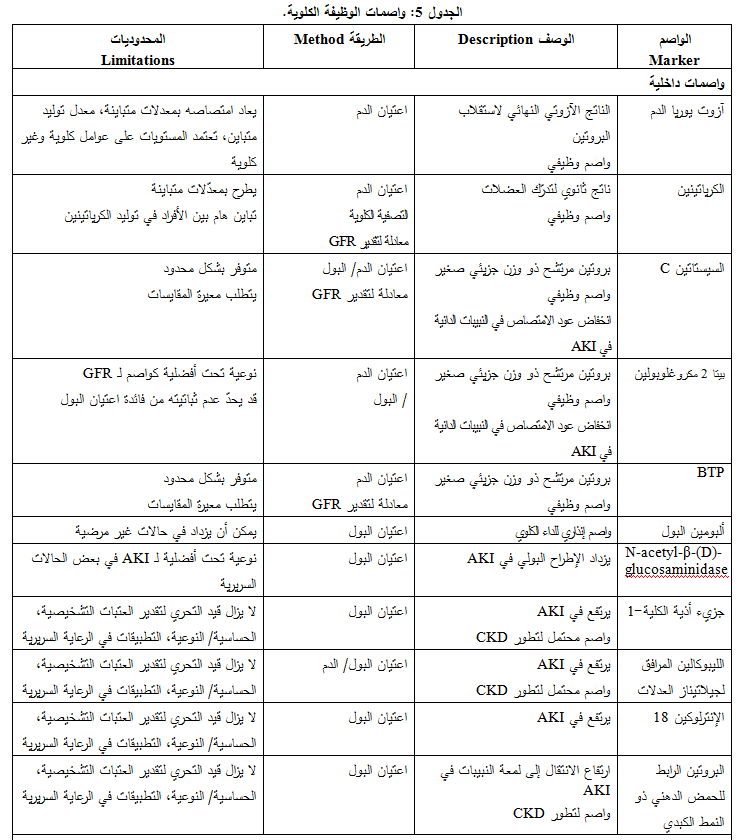
واصمات وظيفة
الكلية في المصل والبلازما
تاريخياً، كانت
اليوريا أول واصم استخدم لتقدير وظيفة الكلية. واليوريا هي الشكل الرئيسي للفضلات الآزوتية في الجسم. وهي ناتج
استقلاب البروتين والأحماض الأمينية، ويتم طرحها بشكل كامل تقريباً في البول. |
|
وفي عام 1827
بين ريتشارد برايت ترافق تكدس اليوريا في الدم وانخفاضها في البول لدى الأفراد
المصابين بالكلى المريضة (3). وأُدخل مصطلح آزوت اليوريا في الدم (BUN) Blood Urea
Nitrogen إلى الطب السريري
كاختبار تشخيصي بداية القرن العشرين (3). وعلى الرغم من أن تقدير BUN يبقى مقياساً مستعملاً بكثرة لتقدير وظيفة الكلية، فإنه يعدّ
الآن عموماً كواصم دون الأمثل suboptimal لهذه الغاية، حيث يمكن أن تلاحظ تراكيز مرتفعة لـ BUN في عدد من الحالات التي لا ترتبط بشكل مباشر مع تبدلات GFR. على سبيل المثال، يعاد امتصاص اليوريا تلقائياً من قبل النيببات،
وخاصّةً خلال نفاد الحجم، ويسبب ذلك زيادةً في التراكيز البلازمية، بينما يكون
مستوى GFR ثابتاً. بالإضافةً إلى ذلك،
يمكن مشاهدة تراكيز مرتفعة من BUN مع زيادة تناول البروتينات في الغذاء، وزيادة
الاستقلاب، واستعمال الستيرويدات القشرية، أو مع النزف المعوي المعدي. لذلك ينبغي تفسير
تراكيز الـ BUN بحذر وضمن السياق السريري.
لقد
استعيض عن BUN بكرياتينين المصل لتقدير
وظيفة
الكلية في منتصف القرن العشرين وهو الاختبار الأكثر استخداماً لتقدير GFR، فترشيح الكرياتينين يجري بشكل
حر عبر الكبيبات ولا يُعاد امتصاصه من قبل النبيبات الكلوية. وتثبط بعض الأدوية
مثل السيميتيدين والتري ميتوبريم الإفراز النبيبي للكرياتينين. وتقع
الإشكالية الأكبر مع انخفاض وظيفة الكلية لكون الإفراز النبيبي للكرياتينين يزداد
بشكل متناسب مع ترشيحه الكبيبي ، ويسبب ذلك مبالغةً في تقدير الـ GFR الحقيقية. نتيجةً لذلك، يمكن أن لا تلاحظ زيادة الكرياتينين
المصلي إلى أن يحدث انخفاض هام في GFR. وتنبع المحدودية الإضافية لاستعمال الكرياتينين المصلي لتقدير GFR من التباين الهام في توليد الكرياتينين بين الأفراد ولدى الفرد
نفسه. وكمحاولة لأخذ هذا التباين بعين
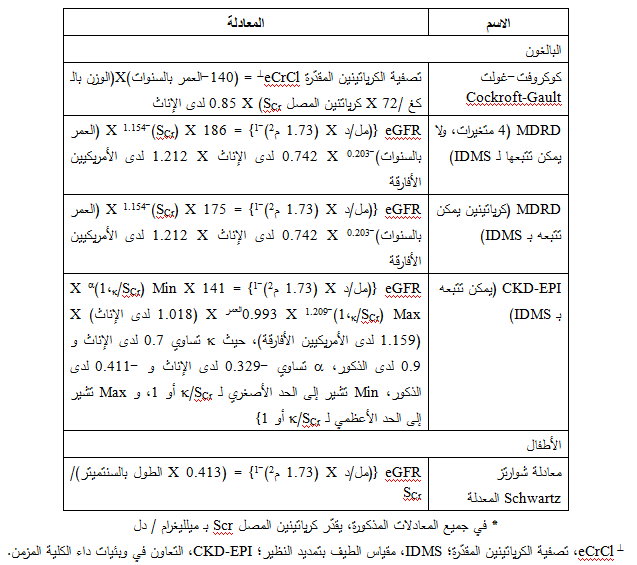
الاعتبار، طورت عدة معادلات تعتمد كرياتينين المصل لتقدير GFR، وأهمها تعديل كوككروفت-غولت Cockcroft-Gault للغذاء في الداء الكلوي (MDRD) ومعادلة شوارتز Schwarts للأطفال. وهذه المعادلات
لا تأخذ بالحسبان الاختلافات التي يمكن أن تحدث نتيجة زيادة أو نقص الكتلة العضلية،
أوالحميات الشديدة (عدم تناول أو تناول مفرط للحوم)، أو التباين الإثني.
تاريخياً،
تبين وجود تباين جدير بالأهمية في قياس كرياتينين المصل، وهو يؤدي عموماً إلى
تقدير أقل دقةً لـ GFR عند كون تراكيز كرياتينين المصل ضمن المجال المرجعي أو أعلى منه بقليل
(4). في عام 2008، أُشهر "البرنامج القومي للتعليم الخاص بالداء الكلوي NKDEP"، بالتعاون مع IFCC والاتحاد الأوروبي لجمعيات الكيمياء السريرية، برنامج معيرة standardization الكرياتينين للتقليل من التباين بين المخابر ولتعيير Calibration مقايسة الكرياتينين (5). وحالياً تستخدم معظم المخابر طريقة مِقْياسُ الطَّيفِ
الكُتْلَوِيّ لمقايسةً الكرياتينين، مما يمكّن من المقارنة بين هذه المخابر
(4). يظهر الجدول 4 المعادلات اللازمة لتقدير GFR باستخدام الكرياتينين (6-10)، كما يمكن للقارئ العودة إلى الموقع الالكتروني لـ NKDEP لإرشاده حول كيفية الاستخدام المناسب لمعادلات تقدير GFR (5).
البروتينات
منخفضة الوزن الجزيئي كواصمات لسرعة الترشيح الكبيبي GFR
جرى
تقييم التراكيز المقاسة للعديد من البروتينات منخفضة الوزن الجزيئي والمتضمنةً:
بيتا 2 مكروغلوبولين، سيستاتين C، بروتين الأثر بيتا BTP، كواصمات محتملة لـ GFR. عموماً، ترتشح هذه البروتينات بشكل حر عبر الكبيبات، ليُعاد
امتصاصها وتدرّكها، لكنها لا تُفرز من قبل النبيبات الكلوية. ونتيجةً لذلك، يترافق
الانخفاض في GFR مع زيادة تراكيزها البلازمية.
إن
بيتا 2 مكروغلوبولين هو بروتين وزنه الجزيئي 11.8 كيلو دالتون ويشكّل السلسلة
الخفيفة لجزيء معقد التوافق النسيجي الأول MHCI، المعبر عنه على
سطح الخلايا المنوّاة جميعها. ينفك هذا البروتين عن السلسلة الثقيلة في حالة تدرّك
الخلية ويعبر إلى الدوران كجزيء موحود monomer. يرتشح
البيتا 2 غلوبولين عبر الكبيبات ويتم امتصاصه ومن ثم تدرّكه بشكل كلي تقريباً من
قبل خلايا النبيبات الدانية proximal (11). وبشكل مغاير للكرياتينين، يبدو أن تراكيز بيتا 2
مكروغلوبولين المصلية مستقلة عن العمر والكتلة العضلية (12)؛ ومع ذلك ليست هنالك
أفضلية واضحة لبيتا 2 مكروغلوبولين على كرياتينين المصل في تحري التبدلات الطفيفة
في GFR (13). والعامل الرئيسي الذي يحد من إمكان الاستفادة من بيتا 2
مكروغلوبولين كواصم للوظيفة الكلوية هو عدم نوعيته، فمن المعروف أن تراكيز بيتا 2
مكروغلوبولين تزداد في العديد من الخباثات والحالات الالتهابية (12، 14).
لقد ولّد السيستاتين سي Cystatin C، في السنوات الأخيرة، حماساً معقولاً
كواصم للـ GFR. وهو بروتين منخفض الوزن الجزيئي فيه
122 حمضاُ أمينياً
وهو عضو في عائلة مثبطات السيستئين بروتيناز (15). يُنتج بمعدل ثابت من قبل
الخلايا المنوّاة جميعها ويرتشح بصورة حرة عبر الكبيبات، ويُعاد امتصاصه ويتدرّك،
لكنه لا يُفرز من النبيبات الكلوية (15). وبشكل مغاير للكرياتينين، فإن سيستاتين C المصل مستقل عن العمر والجنس والكتلة العضلية (16). لذلك يمكن أن يُعتمد
السيستاتين C أكثر من كرياتينين المصل لتقدير GFR،
خاصّةً عند أفراد لديهم نقص طفيف في GFR، والذين لا تلاحظ لديهم عادةً تبدلات كرياتينين المصل (وهو ما
يطلق عليه مجال الكرياتينين الأعمى لـ GFR) (17). يمكن أن
يفضّل السيستاتين C أيضاً على الكرياتينين في توقّع الوفيات والنتائج القلبية
الوعائية (18). ولقد تبين أن السيستاتين C يرتفع بشكل أسرع
من الكرياتينين بعد انخفاض GFR، حيث يُمكّن من تحديد أبكر لـ AKI (19، 20). والمعادلات المعتمدة على السيستاتين C أبسط وأكثر دقةً من المعادلات
المعتمدة على الكرياتينين (21). وحديثاً، جرى اشتقاق معادلات تتضمّن كلاً من
السيستاتين C والكرياتينين في المصل وتبدو أفضل
أداءً من المعادلات التي تعتمد على أيّ منهما على حده (22-24). قد
تتأثّر تراكيز السيستاتين C الجوال بإعطاء الكورتيكوستيرويدات
وبالخلل في وظيفة الدرق (25). لقد وجد وايت وزملاؤه (26) حديثاً
اختلافات هامة في قياس السيستاتين C بين المختبرات، حتى لدى استخدام المقايسة نفسها من المُصنّع نفسه.
تسعى مجموعة العمل لـ IFCC الخاصة بمَعْيَرة السيستاتين C إلى معالجة هذه الأمور. وتقوم بالتعاون مع معهد المواد والقياسات
المرجعية بإنتاج وتحديد مادة مرجعية للسيستاتين C (ERM-DA471/IFCC) (27).
وحديثاً
أكثر، جرى التحري عن BTP في المصل كواصم لـ GFR. إن الـ BTP (والذي يعرف أيضاً ببروستاغلاندين د2 سينثاز) هو بروتين ذو وزن
جزيئي صغير يتولد بمعدل ثابت من قبل الخلايا الدبقية Glial في الجملة العصبية المركزية (28). وهو يرتشح بشكل حر عبر الكبيبات ويعاد امتصاصه
من قبل النبيبات الدانية مع إطراح قليل غير كلوي (29). تقترح دراسة حديثة بأن
تراكيز BTP المصلية تقوم بدور مشابه للكرياتينين والسيستاتين C ليس فقط في تقدير الـ GFR، بل أيضاً في توقع الخلل المترقّي progressive في وظيفة الكلية (30). وجرى اشتقاق المعادلات التي تمكّن من تقدير
الـ GFR اعتماداً على BTP (31، 32)، على الرغم من الحاجة إلى المزيد من توثيق مصدوقيتها validation في الجمهرات المتنوعة. بشكل شبيه بالسيستاتين C،
يبدو أن إعطاء الستيرويدات القشرية يؤثّر في المستويات المصلية لـ BTP (33). وهنالك حاجة لمزيد من العمل لإثبات فائدة BTP في التقدير الروتيني لـ GFR ولتأسيس المعياريات
المخبرية المرجعية لضمان اتّساق consistency القياسات في ما بين المختبرات وضمن المختبر ذاته.
بالنسبة
لحالات البحث أو الحالات السريرية والتي ربما يكون فيها تقدير الـ GFR بالواصمات المصلية غير دقيق أو عند الحاجة إلى قياسات دقيقة لـ GFR، لاتخاذ القرار السريري (مثل الموافقة على التبرع بالكلية لدى أفراد
يمتلكون eGFR حدّية borderline)، يمكن استخدام التقنيات المعتمدة على التصفية لتزودنا بتقدير
أكثر دقة لـ GFR الحقيقية.
|
 |
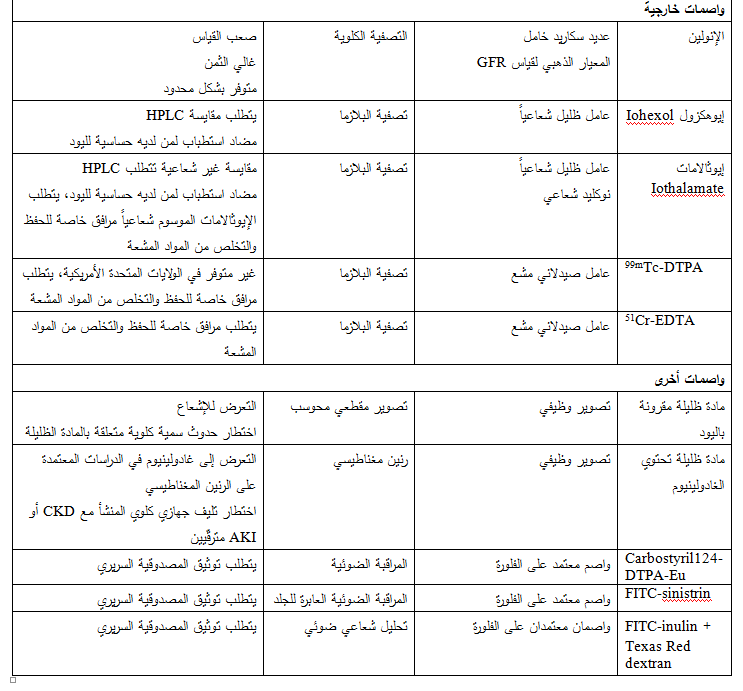
واصمات
وظيفة الكلية المعتمدة على التصفية
باستخدام
مبادئ التصفية الكلوية، يمكن تقدير سرعة الترشيح الكبيبي بشكل دقيق، باستعمال مواد
داخلية أو خارجية. والتصفية الكلوية لمادة معيّنة هي حجم البلازما الذي يمكن
تصفيته من تلك المادة في وحدة الزمن (34). وهو ما يعبّر عنه بـ:
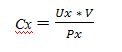
حيث C هي تصفية المادة x، U هو تركيز المادة x في البول، V هو سرعة جريان البول، وP هو تركيز المادة x في البلازما. يعود الفضل الكبير لـ هومر سميث Homer Smith لإدخال طرق التصفية الكلوية وجعلها شائعة كقياس غير باضع لـ GFR. وفي كتابه المهم "الكلية: البنية والوظيفة في الصحة والمرض Kidney: Structure and Function in Health and
Disease"، وصف هومر
سويث خصائص المواد المناسبة لتقدير GFR المعتمد على التصفية، وهي بذلك يجب أن:
1. تكون مرتشحة بشكل كلي
عبر الكبيبات
2. لا يتم تصنيعها أو
تدرّكها في النبيبات
3. لا تتم إعادة
امتصاصها أو إفرازها من قبل النبيبات
4. تكون خاملة
فيزيولوجياً، بحيث لا يؤدي إعطاؤها إلى أي تأثير مُخلّ بوظيفة الجسم.
بالإضافةً
إلى هذا التوصيف من قبل سميث، فإن المادة المثالية يجب أن لا ترتبط أيضاً
ببروتينات البلازما، ويجب أن تكون مقايستها رخيصة وغير مكلفة.
إن
الإنولين Inulin، وهو متماثر للفركتوز يتواجد في درنات الجذور Tubers، هو مادة خارجية تنطبق عليها جميع المعايير المذكورة أعلاه. تتطلب
الطريقة التقليدية لاستخدام الإنولين لقياس GFR التي وصفها هومر سميث اختباراً في الصباح المبكر في حالة الصيام، وكمية من السوائل
لتحريض إدرار البول، وقثطرة داخل المثانة لضمان جمع كامل البول، وتسريب مستمر
للإنولين بسرعة ثابتة، وجمع متعدد للبول والدم حالما يتم الوصول إلى الحالة
الثابتة Steady State (3). يتم حساب تصفية الإنولين بعد ذلك من التراكيز في البلازما
وفي البول وسرعة جريان البول. لا زالت تصفية الإنولين تعد بوصفها المعيار الذهبي
لقياس GFR، على الرغم من ندرة استعمالها سريرياً بسبب التوفر المحدود لمادة
الإنولين وبسبب الطبيعة الباضعة للقياس. حالياً، لا يتم إجراء قياس الإنولين في
معظم المخابر السريرية. ولذلك، تستعمل بروتوكولات تتضمّن واصمات أخرى لقياس GFR.
يمكن
إجراء جمع البول بأوقات محددة لتقدير تصفية الكرياتينين، وهو يعدّ قياساً تقريبياً
لـ GFR. يجري بشكل نموذجي جمع بول 24 ساعة مع سحب الدم لمرة واحدة قبل أو
بعد الجمع لقياس كرياتينين البلازما. يمكن لجمع البول ضمن مدة أقصر من 24 ساعة أن
يفيد في حالة مرضى المستشفيات، ممن يكون لديهم تبدلات متسارعة في الوظيفة الكلوية
(35). على الرغم من أن جمع البول بأوقات محددة يعدّ سهل الإنجاز، فإن هنالك العديد
من الاعتبارات العملية التي تحدّ من استعماله لقياس تصفية الكرياتينين وتفسير
قيمها. وكما وُصف أعلاه، فإن تصفية الكرياتينين تبالغ في تقدير GFR بسبب الإفراز النبيبي للكرياتينين، وخاصّةً عند انخفاض GFR. وبما أنه يعاد امتصاص اليوريا ولا يتم إفرازها، بينما يُفرز
الكرياتينين ولا يعاد امتصاصه، فإن GFR الحقيقية تقع بين تصفية اليوريا وتصفية الكرياتينين المقاستين،
وبحيث يقترح ذلك أهمية كامنة للتقدير المتزامن لتصفية الكرياتينين واليوريا (10).
إن الاعتبار الرئيسي لدى جمع بول 24 ساعة من المرضى خارج المستشفى هو إمكانية
الجمع الزائد أو الناقص لعينة البول، الأمر الذي يحدّ بشكل أساسي من معوّلية
النتائج.
يمكن
استخدام طرق تصفية البلازما في تقدير GFR. يتضمن الاختبار النموذجي حقن واصم خارجي ضمن جرعة داعمة (بلعة) Bolus وحيدة ومن ثم قياس اختفاء ذلك الواصم من البلازما عبر سحب الدم
المتعدد خلال فترة تمتد لعدة ساعات. تتجنب هذه الطرق الحاجة إلى جمع البول وهي
تنجز عادةً خلال فترة زمنية أقصر من قياس تصفية كرياتينين البول التقليدية
المحدودة بالزمن. تتضمن الواصمات المستخدمة عدداً من المواد المشعّة (99mTc، دي إتيلين تري أمين بنتا أسيتيك أسيد DTPA، 51Cr-EDTA، 125I-iothalamate) وغير المشعّة (iohexol، وiothalamate). لقد اختبرت موثوقية الطرق المتضمنة للحقن الأحادي لقياس تصفية
البلازما لكل من هذه الواصمات مقابل التصفية البولية للإنولين (36، 37) لقياس GFR. للنوكليداتٌ المُشِعَّة Radionuclides ميزة السهولة في القياس، والتي يجب موازنتها مقابل سيئة التعرض للإشعاع والحاجة
إلى التهيئة المناسبة لحفظ المواد المشعة والتخلص منها. إن استخدام إيوثالامات iothalamate وإيوهكزول Iohexol يحيّد الاعتبارات المتعلّقة بالإشعاع (36). وجرى تقييم إجراءات
اعتيان الدم الوحيد وفترات الدراسة المختصرة لواصمات التصفية البلازمية، على الرغم
من احتمال الانحياز وعدم الدقة لدى مرضى الداء الكلوي المزمن CKD (38، 39).
|
طرق
حديثة لتقدير سرعة الترشيح الكبيبي
إن
الواصم الوظيفي المثالي في حالة AKI هو ذاك الذي يسمح بالقياس في الزمن الحقيقي real-time لـ GFR وفي مكان تقديم الرعاية. على الرغم من عدم وجود هكذا واصم حالياً
في الرعاية السريرية، فقد أشارت عدة مجموعات إلى نتائج مشجعة باستخدام واصمات
مفلورة في النماذج قبل السريرية (لدى الحيوانات)، حيث وصف رابيتو Rabito وزملاؤه (40) طريقة ضوئية حديثة لقياس GFR باستخدام واصم GFR مفلور، كاربوستيريل 124-DTPA يوروبيوم (carbostyril 124- DTPA-europium)، لديه خصائص تصفية 125I-iothalamate ذاتها. لاحقاً لحقن داخل الوريد لمرة واحدة في الجرذان، كانت
المراقبة المستمرة للتصفية في الزمن الحقيقي ممكنة باستخدام قياسات متخلّلة للجلد Transcutaneous للمادة المفلورة. وحديثاً أكثر، قام شوك-كوش Schock-Kusch وزملاؤهما (41) بتحري السنسترين sinistrin الموسوم بـ FITC، وهو المادة الصيدلانية الفعالة المتضَمَّنة في واصم GFR المتوفر تجارياً إينوتست Inutest، كواصم لـ GFR. أنجزت المراقبة في الزمن الحقيقي لحركيات إطراح الـ FITC-sinistrin باستخدام جهاز محمول يقيس عبر الجلد. كانت قياسات التصفية
المعتمدة على هذه الطريقة مماثلة لتلك التي اعتمدت على تقنية نمطية لقياس التصفية
البلازمية لدى الجرذان السليمة والجرذان التي لديها داء كلوي. استخدم فانغيت Wanget وزملاؤه (42) مواد مفلورة رابطة للإنولين (واصم مرتشح) والدكستران
(واصم غير مرتشح) وجهاز محمول لتحليل الفلورة الشعاعية الضوئية لتقدير GFR في الكلاب والخنازير. لقد كان قياس GFR بعد 60 دقيقة من تسريب الواصمات مماثلاً لذاك المنجز باستخدام الطرق المعيارية
لتصفية البلازما لـ iohexol خلال 6 ساعات. ولّدت هذه التطورات حماساً معقولاً لأنها تعكس
مراقبة GFR في الزمن الحقيقي. ويتوقع إلى حدّ كبير أن توثق مصدوقيتها في
الحالات السريرية.
ما
وراء سرعة الترشيح الكبيبي- أهمية بيلة الألبومين Albuminuria
على
الرغم من التركيز المرتفع للألبومين في البلازما، توجد بشكل طبيعي مقادير صغيرة منه
في البول. عرف الأطباء بيلة الألبومين منذ بدايات القرن التاسع عشر، والتي كان
يشار إليها على أنها وذمة معمّمة تعرف الآن أنها تعود إلى الفشل القلبي، الداء الكبدي،
المتلازمة الكلائية (النفروز). إن القياس الكمي لبيلة البروتين (ومعظمها بيلة
الألبومين) هو الآن أساسي في تحري ومراقبة الداء الكلوي، فتقسيم تركيز ألبومين أو
بروتين البول على تركيز كرياتينين البول يزوّدنا بتقدير إطراح الألبومين،
بالغرامات، في بول 24 ساعة؛ تفترض هذه الطريقة سرعة إطراح ثابتة للكرياتينين 1
غرام/ 24 ساعة، ويمكن أن لا تناسب الأشخاص ممن لديهم GFR سريعة التبدل أو لديهم تباينات كبيرة في معدل توليد الكرياتينين (43). تعدّ بيلة
الألبومين من أهم الواصمات المتنبئة بإنذار وعواقب الداء الكلوي وحتى الداء القلبي
الوعائي والموت (44). حيث تشير مقادير مرتفعة من بيلة البروتين أو بيلة الالبومين
إلى زيادة اختطار الموت، والداء القلبي الوعائي، وتطور الداء الكلوي. ولقد اقترح أن
بيلة الألبومين واصم إضافي لتصنيف مراحل CKD لأن لها قدرةً تنبؤيةً سريرية تفوق وتتعدّى eGFR (45). إن الارتباطات correlates الفيزيولوجية الإمراضية لبيلة الألبومين متباينة: ففي مرضى
المتلازمة الكلائية مثلاً، إن الإمحاء المنتشر Diffuse effacement للخلية الرجلاء podocyte
foot اللاحق لفقد
نفوذية الكبيب الانتقائية هو سبب بيلة الألبومين. كما يمكن لمقادير صغيرة من بيلة
الالبومين أن ترافق العوز المعمم في وظيفة البطانة وتعكس بذلك الداء الجهازي في
الأوعية الدقيقة. ولدى مرضى آخرين، يمكن لبيلة الالبومين أن تسبب العوز في وظيفة
النبيبات الدانية وفقد سعة عود الامتصاص النبيبية. اعتمدت منظمة الغذاء والدواء FDA بيلة الألبومين كواصم قبل سريري (أي في الدراسات المجراة على
الحيوانات) لأذية النبيبات الناجمة عن السمية الكلوية، اعتماداً على دراسات أجريت
بعناية على الجرذان متضمنة طيفاً من المواد السامة للكلية (46). تكون بيلة
الألبومين أعلى في المرضى الذين يتطور لديهم AKI ويمكنها أن تقدّم وسيلة إضافية لتحديد شرائح الاختطار الكلوي (47). لدى مرضى الداء
الكلوي المترافق مع بيلة بروتينية واضحة، يستخدم انخفاض بيلة الألبومين بكثرة كهدف
بديل surrogate في الممارسة السريرية، وذلك على الرغم من غياب البيانات اللازمة
لاقتراح التوصيات السريرية الجازمة أو لتبنّي بيلة الألبومين كنقطة نهاية endpoint في التجارب السريرية (48).
حالياً، الألبومين هو البروتين المهيمن في معظم حالات الأذى
الكبيبي الوخيم وهو المعيار المنصوح به بالنسبة لاعتلال الكلى السكري. إلا أن قياس
بيلة الألبومين عوضاً عن البروتين الكلي يمكن أن تخطئ في حالات الداء الكلوي
المترافقة مع الورم النقوي المتعدد، حيث تكون السلاسل الخفيفة المرتشحة هي
البروتينات المهيمنة. تعد عموماً تجميعات بول 24 ساعة هي المعيار الذهبي للقياس
الكمي للألبومين أو البروتين، ولكن لهذه الطريقة محدوديات هامة بسبب الأخطاء
الشائعة في إكمال تجميع البول. نتيجة لذلك، يعتمد العديد من الممارسين بشكل كبير
على نسب ألبومين البول (أو البروتين) إلى الكرياتينين في عينات بول عشوائية؛ عند
التعبير عن كل من البسط والمقام بوحدات متطابقة (مثل ملغ/دل لكل ملغ/دل)، عندئذٍ
تقارب النسبة مقدار الألبومين (أو البروتين)، بالغرامات، المفرغ خلال 24 ساعة.
تُفضّل العينات الصباحية الأولى، إلاّ أنه ربما يكون من غير السهل الحصول عليها في
الممارسة السريرية (49). إنّ إسواء normalization تركيز كرياتينين البول هي تقنية
تستخدم لمحاولة أخذ المجال الواسع لمعدلات جريان البول بين وضمن الأفراد بعين
الاعتبار، وهي تفترض إطراحاً ثابتاً للكرياتينين بحوالي 1 غرام في اليوم خلال
القياسات (43). حالياً، ليست هنالك عمليات قياس مرجعية لألبومين البول ولا يوجد
مواد مرجعية لأي من الألبومين أو الكرياتينين في البول (50).
لقد
قارنت التحاليل اللاحقة وغير المخطط لها Post-hoc analyses لمجموعة من المشاركين في تجربة RENAAL السريرية (المعنية بتخفيض الناتج النهائي endpoint لدى مرضى الداء السكري غير المعتمد على الإنسولين الذين يتناولون مضاهئ
الأنجيوتنسين II (لوزرتان) بروتين بول 24 ساعة، وألبومين بول 24
ساعة، ونسب الألبومين إلى الكرياتينين من حيث ترافقها مع الانخفاض في وظيفة الكلية
(51)، فوجد الباحثون أن نسبة الألبومين إلى الكرياتينين كانت أفضل مقياس لتوقع
الحوادث الكلوية لدى مرضى السكري من النمط الثاني المترافق مع اعتلال كلوي. وتشمل
الأسباب الكامنة لهذه النتائج التباين في إكمال تجميعات بول 24 ساعة والأهمية
الإنذارية لإطراح كرياتينين البول بحد ذاته (52)، بسبب ترافقه مع المتغيرات الهامة
بيولوجياً مثل الكتلة العضلية والكفاية التغذوية. إن نسبة الالبومين إلى الكرياتينين، المقاسة بشكل أفضلي في العينات الأولى
الصباحية، هي الاختبار المفضّل لدى مرضى السكري، ويمكن تفضيل البروتين إلى
الكرياتينين لدى الأفراد غير السكريين. لا تكون عينات 24 ساعة ضرورية عموماً
باستثناء حالات خاصّة (مثل الحاجة إلى قياس دقيق لمعدل إطراح الألبومين أو
البروتين في الرعاية طويلة الأمد لمرضى الداء الكبيبي والبيلة البروتينية الثقيلة،
ممن قد يتأثر لديهم صنع القرار السريري).
التصوير
البنيوي والوظيفي للكلية
يقدم التصوير بالأمواج فوق الصوتية للكلى تقيماً هاماً للمرضى
المصابين بداء كلوي مزمن أو حاد مؤكد أو مشكوك به. ويمكن معرفة حجم الكلية
والمواقع المولّدة للصدى echogenecity ونحالة القشرة، ووجود أو غياب مَوَه الكلية hydronephrosis بشكل تلقائي بواسطة الأمواج فوق
الصوتية. يمكن للتصوير البنيوي الأكثر تعقيداً باستخدام MRI أن يفيد لدى مرضى الداء الكلوي متعدد
الكيسات الجسمي السائد لتقدير معدل نمو الكيسة والانخفاض في الوظيفة الكلوية (53). يمكن أن تقاس GFR أيضاً باستخدام عدة بروتوكولات تعتمد على التصوير
المقطعي المحوسب computed tomography وMRI (54). هذه الطرق
مشجعة حيث أنها تمتلك قدرة مميزة لتزودنا، وبشكل متزامن، بتفاصيل حول البنية،
والإرواء perfusion، والوظيفة. كما أنه من الممكن قياس سرعة
الترشيح الكبيبي للكلية الواحدة والقياسات المميزة لوظيفة كل من الكليتين. تعدّ
الحاجة إلى العوامل الظليلة المعتمدة على اليود والغاديلينيوم من المحدوديات
الحالية لقياس GFR بـ CT و MRI، على الترتيب. إن استعمال أيٍّ من
الطريقتين غير مقبول لدى مرضى CKD الأولي والثانوي لاختطار الاعتلال الكلوي المسبب
بالمادة الظليلة والتليف الجهازي كلوي المنشأ.
ما وراء سرعة الترشيح الكبيبي- مقاييس أذية الكلية
تركّز الاهتمام حديثاً على التحديد المبكّر لأذية الكلية
والذي يمكن أن يسبق، أو ربما لا يترافق مع الانخفاض في GFR. وكما أن الانخفاض في النتاج القلبي
لا يعرّف احتشاء العضلة القلبية، وانخفاض الألبومين في الدم واعتلال جملة التخثّر
ليسا المحددّين الوحيدين لأذية الكبد، فإنّ GFR يمكن أن لا تمثّل المعيار الملائم أو
الوحيد لتقدير أذية الكلية. يمكن أن يحد الاعتماد على الواصمات الوظيفية للكلية
مثل GFR من القدرة على البدء باستراتيجيات
يمكنها منع الفقد الوظيفي قصير الأمد وطويل الأمد. ولهذه الغاية، تكون واصمات
التخرب أو الأذى الكلوي هي الأكثر ملاءمةً. خلال العقد الأخير، قادت جهود التقصّي
الحثيثة إلى تعريف وتشخيص واصمات بولية وبلازمية عديدة يبدو أنها حساسة ونوعية
لأذية الكلية. ومن أهم تلك الواصمات N-acetyl-?-(D)-glucosaminidase، والليبوكالين المرافق لجيلاتيناز
العدلات، وجزيء أذية الكلية-1، والإنترلوكين 18، والبروتين الرابط للحمض الدهني ذو
النمط الكبدي. هنالك حاجة لمزيد من العمل لتحديد فائدة تلك الواصمات بشكل كلي، على
الرغم من وجود حماسة عالية بأنها سوف تحسّن من فهم الفيزيولوجية المَرَضية للكلية
وتساهم في تطوير تداخلات مستهدفة لتخفيف الأذية ومنع الانخفاض الوظيفي. إن
المناقشة الكاملة لهذه الواصمات غير ممكنة في هذه المراجعة؛ مع ذلك، يمكن للقارئ
التوجه إلى مراجعات ممتازة لـ سيو Siew وزملائه (55)، وفاسيت Fassett وزملائه (56)، والتي تفصّل الوضع
الحالي لهذه الواصمات في AKI وCKD، على الترتيب. بالإضافةً لذلك، فإن الزيادة في
التراكيز البولية للبروتينات المرتشحة منخفضة الوزن الجزيئي، والتي تشمل بيتا 2
مكروغلوبولين، وألفا 1 مكروغلوبولين، وسيستاتين C، والبروتين الرابط للرتينول، تعكس
خللاً في ممرات عود الامتصاص النبيبية، والتي تحدث في حالة الأذى النبيبي الحاد.
عموماً، إن نوعية هذه الواصمات ربما تكون تحت أفضلية بسبب أن زيادة التراكيز في
البول يمكن أن تشاهد في حالات أخرى عدة، وبشكل أساسي في حالة البيلة البروتينية
الكبيبية (حيث يحصل إشباع لممرات عود
الامتصاص) والإمراضيات النبيبية المزمنة (حيث تكون ممرات عود الامتصاص معوزة).
يقدم الجدول 5 لوائح العديد من قياسات الوظيفة الكلوية المتوفّرة حالياً أو التي
هي قيد التطوير.
ما
وراء سرعة الترشيح الكبيبي- تقييم اعتبارات أخرى لوظيفة الكلية
إن
ترشيح فضلات الاستقلاب من الدوران هو وظيفة الكلية في الإبقاء على الحياة، لكنها
ليست الوحيدة. إن اختلاطات الـ AKI وCKD متقلّبة وتؤثر في عدد من جمل الأعضاء؛ على سبيل المثال، فقر الدم،
وداء العظام، والحماض الاستقلابي، والخلل في تراكيز الصوديوم في الدم، وزيادة
التحميل المفرط للحجم. إن تقييم وظيفة الكلية الغدية (1 a هدركسلة 25-هيدروكسي فيتامين د، والوظيفة الدموية (إنتاج الإريثروبويَتين)،
وتنظيم حمض-أساس (الحماض البولي، عود امتصاص البيكربونات)، وتنظيم التوتّرية tonicity (إطراح الماء)، وتنظيم الحجم (إطراح الصوديوم والماء)، تتأثر
جميعاً وبشكل كبير حالما تبدأ الاختلاطات. زيادةً على ذلك، يمكن للـ GFR أن لا تخدم كواصم بديل surrogate دقيق لبعض اختلاطات الداء الكلوي. قيّم سو Hsu وزملاؤه (57)
الترافقات المتقاطعة بين GFR (المقاسة أو المقدّرة) والاختلاطات المعروفة جيداً لـ CKD، وتضم فقر الدم، وارتفاع بوتاسيوم الدم، والحماض الاستقلابي، وارتفاع
فسفات الدم، فوجدوا أن أياً من قياسات GFR، متضمنةً تصفية
الإيوثالامات، لم تترافق بقوة مع اختلاطات CKD، وأن القوة
النسبية للترافق تباينت مع نتائج مختلفة، مما أبرز السؤال الفلسفي حول ما إذا كانت GFR هي حقيقةً المعيار الذهبي الملائم. ويبقى السؤال مطروحاً حول جدوى
وكيفية تقييم الاعتبارات متعددة الأبعاد لوظيفة الكلية في الممارسة السريرية.
الاستنتاج
تُقيّم
وظيفة الكلية بالطريقة الأكثر شيوعاً عبر تقدير GFR باستخدام كرياتينين المصل. اقتُرحت واصمات ترشيح داخلية أخرى، من ضمنها سيستاتين C وBTP، يمكن أن تتفوق على الكرياتينين، بالنسبة لتقديرها GFR، في التحري المبكّر للـ AKI وتقدير الإنذار.
يمكن أن تقاس GFR مباشرةً باستخدام التصفية البولية أو البلازمية لواصمات ترشيح
خارجية. نمطياً، تطبق القياسات المباشرة لـ GFR في الأبحاث أو في حالات سريرية نادرة، عند توقّع أنه لا يمكن الاعتماد على واصمات
الترشيح الداخلية أو عند وجود ضرورة للقياس الدقيق لـ GFR (مثال، عند التبرع بالكلية من متبرع لديه eGFR هامشية marginal). يعدّ ألبومين أو بروتين البول اختباران متممان لوظيفة الكلية
ويزوداننا بمعلومات إضافية مستقلّة حول الإنذار الكلوي والقلبي الوعائي. تَعِد واصمات حديثة لأذية الكلية ووظيفتها بعصرنة
طرق تشخيص الداء الكلوي الحاد والمزمن، لكن يجب إجراء مزيد من البحث قبل إدراج تلك
الواصمات في الممارسة السريرية.
مساهمة
المؤلفين: أكد المؤلفون جميعهم مساهمتهم في المحتوى العلمي لهذه الورقة البحثية، حيث التزموا
بالمتطلبات الثلاثة التالية:
أ)
مساهمات هامة بالنسبة للمبدأ والتصميم، تلقّي المعلومات، أو تحليل وتفسير
المعلومات؛
ب)
تحضير مسودة أو مراجعة المقال من حيث المحتوى العلمي؛
ج)
الموافقة النهائية على المقال المنشور.
بيان
تضارب المصالح المحتمل بالنسبة للمؤلفين: لم يعلن أي من المؤلفين أن لديه تضارب
مصالح محتمل. |
|
| المراجع References |
1-Bellomo R; Ronco C; Kellum JA; Mehta RL. and Palevsky P.
Acute renal failure-definition, outcome measures, animal models, fluid therapy and information technology needs: the Second International Consensus Conference of the Acute Dialysis Quality Initiative (ADQI) Group.
Crit Care; 8: R204-212, 2004.
2-Mehta RL; Kellum JA; Shah SV; Molitoris BA; Ronco C; Warnock DG. and Levin A.
Acute Kidney Injury Network: report of an initiative to improve outcomes in acute kidney injury.
Crit Care; 2007; 11: R31.
3-Smith HW.
The kidney: structure and function in health and disease.
New York: Oxford University Press, Inc; 1951.
4-Myers GL; Miller WG; Coresh J; Fleming J; Greenberg N; Greene T. et al.
Recommendations for improving serum creatinine measurement: a report from the Laboratory Working Group of the National Kidney Disease Education Program.
Clin Chem; 2006; 52: 5-18.
5-National Kidney Disease Education Program.
http://www.nkdep.nih.gov/labprofessionals/estimate_ report-gfr.htm. (Accessed October 2011).
6-Schwartz GJ; Munoz A; Schneider MF; Mak RH; Kaskel F; Warady BA. and Furth SL.
New equations to estimate GFR in children with CKD.
J Am Soc Nephrol; 20: 629-637, 2009.
7-Levey AS; Coresh J; Greene T; Marsh J; Stevens LA; Kusek JW. and Van Lente F.
Expressing the Modification of Diet in Renal Disease Study equation for estimating glomerular filtration rate with standardized serum creatinine values.
Clin Chem; 53: 766-72, 2007.
8-Levey AS; Stevens LA; Schmid CH; Zhang YL; Castro AF; Feldman HI. et al.
A new equation to estimate glomerular
filtration rate.
Ann Intern Med; 150: 604-612, 2009.
9-Cockcroft DW. and Gault MH.
Prediction of creatinine clearance from serum creatinine.
Nephron, 16: 31-41, 1976.
10-Levey AS; Bosch JP; Lewis JB; Greene T; Rogers N; Roth D.
A more accurate method to estimateglomerular filtration rate from serum creatinine: a new prediction equation. Modification of Diet in Renal Disease Study Group.
Ann Intern Med; 130: 461-470, 1999.
11-Miyata T; Jadoul M; Kurokawa K. and Van Ypersele de Strihou C.
Beta-2 microglobulin in renal disease.
J Am Soc Nephrol; 9: 1723-1735, 1998.
12-Filler G; Priem F; Lepage N; Sinha P; Vollmer I; Clark H. et al.
Beta-trace protein, cystatin C, beta(2)-microglobulin, and creatinine compared for detecting impaired glomerular filtration rates in children.
Clin Chem; 48: 729-736, 2002.
13-Donadio C.
Serum and urinary markers of early impairment of GFR in chronic kidney disease patients: diagnostic accuracy of urinary beta-trace protein.
Am J Physiol Renal Physiol; 299: F1407-1423.
14-Delanghe JR.
How to estimate GFR in children.
Nephrol Dial Transplant, 24: 714-716, 2009.
15-Laterza OF; Price CP. and Scott MG.
Cystatin C: an improved estimator of glomerular filtration rate?
Clin Chem; 48: 699-707, 2002.
16-Filler G; Bokenkamp A; Hofmann W; Le Bricon T; Martinez-Bru C. and Grubb A.
Cystatin C as a marker of GFR–history, indications, and future research.
Clin Biochem; 38: 1-8, 2005.
17-Herget-Rosenthal S; Bokenkamp A.
and Hofmann W.
How to estimate GFR-serum creatinine, serum cystatin C or equations?
Clin Biochem; 40: 153-161, 2007.
18-Shlipak MG; Sarnak MJ; Katz R; Fried LF; Seliger SL; Newman AB. et al.
Cystatin C and the risk of death and cardiovascular events among elderly persons.
N Engl J Med; 352: 2049-2060, 2005.
19-Herget-Rosenthal S; Marggraf G; Husing J; Goring F; Pietruck F; Janssen O. et al.
Early detection of acute renal failure by serum cystatin C.
Kidney Int; 66: 1115-1122, 2004.
20-Nejat M; Pickering JW; Walker RJ. and Endre ZH.
Rapid detection of acute kidney injury by plasma cystatin C in the intensive care unit.
Nephrol Dial Transplant; 25: 3283-3289, 2010.
21-Hojs R; Bevc S; Ekart R; Gorenjak M. and Puklavec L.
Serum cystatin C-based equation compared to serum creatinine-based equations for estimation of glomerular filtration rate in patients with chronic kidney disease.
Clin Nephrol; 70: 10-17, 2008.
22-Ma YC; Zuo L; Chen JH; Luo Q; Yu XQ; Li Y. et al.
Improved GFR estimation by combined creatinine and cystatin C measurements.
Kidney Int; 72: 1535-1542, 2007.
23-Stevens LA; Coresh J; Schmid CH; Feldman HI; Froissart M; Kusek J. et al.
Estimating GFR using serum cystatin C alone and in combination with serum creatinine: a pooled analysis of 3,418 individuals with CKD.
Am J Kidney Dis; 51: 395-406, 2008.
24-Tidman M, Sjostrom P. and Jones I.
A Comparison of GFR estimating
formulae based upon s-cystatin C and s-creatinine and a combination of the two.
Nephrol Dial Transplant; 23: 154-160, 2008.
25-Westhuyzen J. and Cystatin C.
a promising marker and predictor of impaired renal function.
Ann Clin Lab Sci; 36: 387-394, 2006.
26-White CA, Rule AD, Collier CP, Akbari A, Lieske JC, Lepage N. et al.
The impact of interlaboratory differences in cystatin C assay measurement on glomerular filtration rate estimation.
Clin J Am Soc Nephrol; 6: 2150-2156, 2011.
27-Grubb A, Blirup-Jensen S, Lindstrom V, Schmidt C, Althaus H, Zegers I. First certified reference material for cystatin C in human serum ERMDA471/ IFCC.
Clin Chem Lab Med; 48: 1619-1621.
28-Bokenkamp A; Franke I; Schlieber M; Duker G; Schmitt J; Buderus S. et al.
Beta-trace protein-a marker of kidney function in children: “Original research communication-clinical investigation”. Clin Biochem; 40: 969-975, 2007.
29-Vynckier LL; Flore KM; Delanghe SE. and Delanghe JR.
Urinary beta-trace protein as a new renal tubular marker.
Clin Chem; 55: 1241-1243, 2009;
30-Spanaus KS; Kollerits B; Ritz E; Hersberger M; Kronenberg F. and von Eckardstein A.
Serum creatinine, cystatin C. and beta-trace protein in diagnostic staging and predicting progression of primary nondiabetic chronic kidney disease.
Clin Chem; 56: 740-749, 2010.
31-Poge U; Gerhardt T; Stoffel-Wagner B; Palmedo H; Klehr HU; Sauerbruch T. and Woitas RP.
Beta-trace protein-based equations for calculation of GFR in renal transplant recipients.
Am J Transplant; 8: 608-615, 2008.
32-White CA; Akbari A; Doucette S; Fergusson D; Hussain N; Dinh L, et al. A novel equation to estimate glomerular filtration rate using betatrace protein.
Clin Chem; 53: 1965-1968, 2007.
33-Abbink FC; Laarman CA; Braam KI; van Wijk JA; Kors WA; Bouman AA. et al.
Beta-trace protein is not superior to cystatin C for the estimation of GFR in patients receiving corticosteroids.
Clin Biochem, 41: 299-305, 2008.
34-Israni AK. and Kasiske BL.
Laboratory assessment of kidney disease: clearance, urinalysis, and kidney biopsy.
In: Brenner BM, ed. Brenner and Rector’s the kindey. Vol. 1. 8th ed. Philadelphia (PA): Saunders Elsevier; 724-756, 2008.
35-Baumann TJ; Staddon JE; Horst HM. and Bivins BA.
Minimum urine collection periods for accurate determination of creatinine clearance in critically ill patients.
Clin Pharm; 6: 393-398, 1987.
36-Stevens LA. and Levey AS.
Measured GFR as a confirmatory test for estimated GFR.
J Am Soc Nephrol; 20: 2305-2313, 2009.
37-Endre ZH; Pickering JW. and Walker RJ.
Clearance and beyond: the complementary roles of GFR measurement and injury biomarkers in acute kidney injury (AKI).
Am J Physiol Renal Physiol; 301: F697-707, 2011.
38-Schwartz GJ; Abraham AG; Furth SL; Warady BA. and Munoz A.
Optimizing iohexol plasma disappearance curves to measure the glomerular filtration rate in children with chronic kidney disease.
Kidney Int; 77: 65-71, 2010.
39-Agarwal R; Bills JE; Yigazu PM; Abraham T; Gizaw AB; Light RP. et al.
Assessment of iothalamate plasma clearance: duration of study affects quality of GFR.
Clin J Am Soc Nephrol 2009; 4: 77-85.
40-Rabito CA; Chen Y; Schomacker KT. and Modell MD.
Optical, real-time monitoring of the glomerular filtration rate.
Appl Opt; 44: 5956-65, 2005.
41-Schock-Kusch D. et al.
Transcutaneous assessment of renal function in conscious rats with a device for measuring FITC-sinistrin disappearance curves.
Kidney Int; 79: 1254-1258, 2011.
42-Wang E. et al.
A portable fiberoptic ratiometric fluorescence analyzer provides rapid point-of-care determination of glomerular filtration rate in large animals.
Kidney Int; 81: 112-117, 2012.
43-Waikar SS; Sabbisetti VS. and Bonventre JV.
Normalization of urinary biomarkers to creatinine during changes in glomerular filtration rate.
Kidney Int; 78: 486-94.
44-van der Velde M; Matsushita K; Coresh J; Astor BC; Woodward M; Levey A. et al.
Lower estimated glomerular filtration rate and higher albuminuria are associated with all-cause and cardiovascular mortality. A collaborative meta-analysis of high-risk population cohorts.
Kidney Int; 79: 1341-1352, 2011.
45-Levey AS; de Jong PE; Coresh J; El Nahas M; Astor BC; Matsushita K. et al.
The definition, classification, and prognosis of chronic kidney disease: a KDIGO Controversies Conference report.
Kidney Int; 80: 17-28, 2011.
46-Yu Y; Jin H; Holder D; Ozer JS; Villarreal S; Shughrue P. et al.
Urinary biomarkers trefoil factor 3 and albumin enable early detection of kidney tubular injury.
Nat Biotechnol; 28: 470-477, 2010.
47-Grams ME; Astor BC; Bash LD; Matsushita K; Wang Y. and Coresh J.
Albuminuria and estimated glomerular filtration rate independently associate with acute kidney injury.
J Am Soc Nephrol; 21: 1757-1764.
48-Johnson KR.
Strengths and weaknesses of renal markers as risk factors and surrogate markers.
Kidney Int; 79: 1272-1274, 2011.
49-Witte EC; Lambers Heerspink HJ; de Zeeuw D; Bakker SJ; de Jong PE, Gansevoort R.
First morning voids are more reliable than spot urine samples to assess microalbuminuria.
J Am Soc Nephrol; 20: 436-443, 2009.
50-Miller WG. et al.
Current issues in measurement and reporting of urinary albumin excretion.
Clin Chem; 55: 24-38, 2009.
51-Lambers Heerspink HJ; Gansevoort RT; Brenner BM; Cooper ME; Parving HH; Shahinfar S. and de Zeeuw D.
Comparison of different measures of urinary protein excretion for prediction of renal events.
J Am Soc Nephrol; 21: 1355-1360.
52-Ix JH; de Boer IH; Wassel CL; Criqui MH; Shlipak MG. and Whooley MA.
Urinary creatinine excretion rate and mortality in persons with coronary artery disease: the Heart and Soul Study.
Circulation; 121: 1295-1303.
53-Grantham JJ. et al.
Volume progression in polycystic kidney disease.
N Engl J Med; 354: 2122-2130, 2006.
54-Durand E; Chaumet-Riffaud P. and Grenier N.
Functional renal imaging: new trends in radiology and nuclear medicine.
Semin Nucl Med; 41: 61-72, 2011.
55-Siew ED; Ware LB. and Ikizler TA.
Biological markers of acute kidney injury.
J Am Soc Nephrol; 22: 810-820, 2011.
56-Fassett RG. et al.
Biomarkers in chronic kidney disease: a review.
Kidney Int; 80: 806-821, 2011.
57-Hsu CY. et al.
Measured GFR Does Not Outperform Estimated GFR in Predicting CKD-related Complications.
J Am Soc Nephrol; 22: 1931-1937, 2011.
|
| |
| المجلد 6 ,
العدد 9
, جمادى الأولى 1434 - نيسان(أبريل) 2013 |
|
|
|
