| المجلد 7 ,
العدد 1
, ذو القعدة 1434 - تشرين أول (أكتوبر) 2013 |
| |
| دور مستويات AMH المصلية في التنبؤ بنتائج الإخصاب في
المختبر عند مريضات متلازمة المبيض متعدد الكيسات
|
| Role of Serum AMH Levels in Predicting in Vitro Fertilization
Outcomes in Polycystic Ovary Syndrome Patients
|
| د. بشرى أبو فخر*، أ.د. مروان الحلبي**، و أ.د. فايزة القبيلي* |
| Abu Fakher B; Al Halabi M. and Al Quobaili F. |
*كلية الصيدلة، **كلية الطب البشري، جامعة دمشق
Faculty of Pharmacy, Faculty of Medicine, Damascus University.
|
| الملخص Abstract |
يعد Anti Mullerian Hormone (AMH) واحداً من عوامل النمو المحولة (TGF-β)، ينتج من قبل الخلايا المحببة للمبيض مع أعلى تعبير عنه في الجريبات الغارية الصغيرة. ولقد جرى ربطه تماماً مع المدخر المبيضي، كما تأخذ مقايسة الهرمون المولري المضاد (AMH) في التنبؤ بنجاح الإخصاب في المختبر in vitro fertilization (IVF) حيزاً من اهتمام الأطباء السريريين.
يهدف البحث إلى تقييم المستويات المصلية للـ AMH لدى كلٍ من مريضات متلازمة المبيض متعدد الكيسات PCOS، والنساء سويات الإباضة، وإلى تعيين ارتباطها بنتائج الإخصاب في المختبر لدى كلا المجموعتين.
قيست مستويات AMH المصلية عند 43 مريضة مصابة بمتلازمة المبيض متعدد الكيساتPCOS، و20 من الشواهد (نساء سويات الإباضة) باستخدام مقايسة الممتز المناعي المرتبط بالإنزيم ELISA، ولقد خضعت الجمهرة المدروسة جميعها للإخصاب في المختبر.
كانت مستويات AMH المصلية أعلى بشكل يعتد به (P= 0.004) لدى مريضات متلازمة المبيض متعدد الكيسات منها لدى الشواهد، حيث كانت القيم 5.07±3.39 نغ/ مل و3.07±2.09 نغ/ مل، على الترتيب. أظهرت مستويات AMH المصلية ارتباطاً إيجابياً معتداً به مع عدد الخلايا البيضية المسترجعة (r= 0.39، P=0.01) وعدد الخلايا البيضية الناضجة (r=0.33، P=0.03)، ولكن لم يكن هناك ارتباط يعتد به مع عدد الأجنة ومعدل الإخصاب أو معدل الحمل لدى مريضات متلازمة المبيض متعدد الكيسات PCOS. أما بالنسبة للشواهد فلقد ارتبطت المستويات المصلية للـ AMH ارتباطاً إيجابياً معتداً به مع عدد الخلايا البيضية المسترجعة وعدد الخلايا البيضية الناضجة وعدد الأجنة.
ترتفع مستويات AMH المصلية عند مريضات متلازمة المبيض متعدد الكيسات مقارنة بالنساء سويات الإباضة. ويمكن لهذه المستويات أن تتنبأ بعدد الخلايا البيضية المسترجعة وعدد الخلايا البيضية الناضجة لدى مريضات الـ PCOS، بالإضافة إلى ذلك فهي تتنبأ بعدد الخلايا البيضية المسترجعة والناضجة والأجنة لدى النساء سويات الإباضة، لكنها لاتتنبأ بالنتائج الأخرى للإخصاب في المختبر.
|
AMH, Anti Mullerian hormone, is a member of transforming growth factors (TGF-β) produced by granulose cells, with the highest expression being in small antral follicles. It was well related with ovarian reserve, the prediction of in vitro fertilization (IVF) by anti-mullerian hormone (AMH) measurement is getting increased attention from clinicians.
The study aims to evaluate the serum levels of AMH in both polycystic ovary syndrome (PCOS) patients and normo-ovulatory women, and to determine its correlation to IVF outcomes, in both groups.
Serum AMH levels were measured in 43 PCOS patients and 20 controls (normo-ovulatory women), by using enzyme linked immuno-sorbent assay (ELISA). All of the studied populations were recruited for IVF trail.
Serum AMH levels were significantly higher (P=0.004) in PCOS patients than in controls, the values were 5.07±3.39 ng/ml, 3.07±2.09 ng/ml, respectively.
Serum AMH levels showed a positive significant correlation with the number of oocyte retrieved (r=0.39, P=0.01) and mature oocyte (r=0.33, P=0.03), but there was no significant correlation with embryos number, fertilization rate or pregnancy rate in PCOS patients. In the normo-ovulatory women serum AMH levels showed a positive correlation with the number of oocyte retrieved, mature oocyte and embryos number.
Serum AMH levels elevate in PCOS patients more than those of normal control. And these levels can predict the number of the retrieved oocyte and mature oocyte in PCOS patients, and furthermore serum AMH can predict the number of retrieved oocyte, mature oocyte and embryos in normo-ovulatory women, but it can't predict other IVF outcomes.
|
| المقدمة Introduction |
تُعدّ متلازمة المبيض متعدد الكيسات (PCOS) Polycystic ovary syndrome الاضطراب الصماوي الأكثر شيوعاً عند النساء في سن الإنجاب (1)، حيث تصيب حوالي 10 % من النساء في سن الإنجاب (2). وتتدخل آليات متعددة في إمراضية هذه المتلازمة ويعتقد أن أهمها عوز الهرمون المنبه للجريب (FSH) Follicle Stimulating Hormone وفرط إفراز الهرمون الملوتن (LH) Luteinizing Hormone وفرط إفراز الأندروجين وفرط إفراز الأنسولين (3).
تعاني مريضات الـ PCOS بشكل أساسي من الاضطرابات الطمثية، التي تتراوح من الضهي (انقطاع الحيض) إلى ندرة الحيض إلى غزارة النزف الرحمي النوائبي أحياناً. كما تعاني المريضات من كلٍ من فرط الأندروجينية، المقصود بها سريرياً الشعرانية، والعد و/ أو الصلع الأندروجيني والبدانة ومقاومة الأنسولين. ويعد العقم وضعف الخصوبة من الشكاوى المتكررة عند مريضات متلازمة المبيض متعدد الكيسات وذلك بسبب الدورات غير الإباضية (4). فالـ PCOS المسبب الأشيع للعقم الناتج عن غياب الإباضة (5). ويختلف علاج الـ PCOS تبعاً للهدف منه، فقد تحتاج بعض المريضات إلى مانعات الحمل الفموية، إذا كان الهدف هو معالجة فرط الأندروجين، في حين يحتاج بعضهن الآخر إلى تحريض الإباضة وتقنيات الإخصاب في المختبر (6).
يُعرف الإخصاب في المختبر بأنه تطبيق لعدد من التقنيات المخبرية والسريرية على الأعراس بهدف حدوث الإخصاب، حيث يتم تلقيح الخلايا البيضية بالنطاف خارج الجسم (في المختبر) ومن ثم تجرى إعادة زرع الجنين داخل الرحم (7).
الهرمون المولري المضاد (AMH) Anti Mullerian Hormone هو بروتين سكري مثنوي من عوامل النمو المحولة β (8). وكان يعتقد سابقاً أن الـ AMH يفرز فقط لدى الجنين الذكر خلال مرحلة التمايز الجنسي ليحفز تقهقر القنوات المولرية، لكن ظهر خلال العقود الأخيرة دوره المميز في المبيضين (9). ويتوضع جين الـ AMH على الصبغي 19، ويرمز لبروتين سكري مثنوي وزنه الجريئي 140 كيلودالتون (10).
يفرز الـ AMH عند الأنثى من الخلايا المحببة من المبيض، ويبدأ إفرازه اعتباراً من المرحلة الجنينية (الأسبوع 36 للحمل) ويستمر حتى سن الإياس، كما تبقى مستويات الـ AMH ثابتة خلال سن البلوغ، ثم تنخفض كمؤشر على استنزاف المدخر المبيضي، فتصبح غير قابلة للكشف في سن الإياس، كما أنه لا تطرأ تبدلات يعتد بها على مستويات الـ AMH خلال الدورة الطمثية ((9.
يملك الـ AMH دوراً مثبطاً في المبيض خلال مرحلتين من مراحل تطور الجريب، إذ أنه يثبط أولاً تحول الجريب الأولي primordial follicle إلى جريب قبل غاري صغير small preantral follicle. ويعمل ثانياً على مستوى الجريبات الغارية فيخفض من حساسية الجريب للـ FSH عن طريق تثبيط الأروماتاز. ويعتقد أن لفعله التثبيطي هذا، على مستوى نمو الجريبات الغارية دوراً أساسياً في إمراضية الـ PCOS ((11.
تفيد مقايسة مستويات الـ AMH سريرياً، لدى المرأة في سن الإنجاب لتحديد المدخر المبيضي بحساسية ونوعية تفوق مقايسة الـ FSH ((12. وأشارت بعض الدراسات إلى أن المستويات المصلية للـ AMH تفيد بشكل عام في تقديم معلومات عن نوعية الأجنة والأعراس وعن نتائج دورة الإخصاب في المختبر، كما تفيد في التنبؤ عن استجابة المبيض لتطبيق بروتوكول فرط التنبه المضبط للمبيض ((9، وهي المرحلة الأولى من مراحل تقنية الإخصاب في المختبر.
|
| المرضى والمواد والطرق |
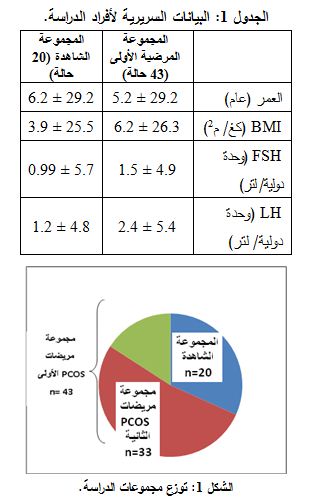
المرضى: شملت الدراسة 63 أنثى تراوحت أعمارهن بين 19–39 عاماً، جرى جمع عينات المصل لهن في الفترة مابين حزيران 2011 وكانون الثاني 2012 من مستشفى الشرق للإخصاب ومعالجة العقم وأطفال الأنابيب. وتوزعت المجموعات كما يلي:
* المجموعة المرضية الأولى: شملت 43 مريضة مشخص لديهن متلازمة المبيض متعدد الكيسات، حسب معايير روتردام Rotterdam 2003 والتي تتطلب توافر إثنين على الأقل من المعايير الثلاثة التالية (13):
- اضطرابات في الإباضة، بشكل رئيسي ندرة طمث أو انقطاع الطمث.
- فرط الأندروجينية والذي يحدد إما سريرياً، حيث يلاحظ وجود الشعرانية أو مخبرياً بارتفاع قيم التستوستيرون إلى أكثر من 0.7 ng/ml في اليوم الثالث للدورة.
- وجود أكثر من 12 جريباً يتراوح طولها بين 2-9 مم على كل مبيض.
كان متوسط أعمار المريضات ± الانحراف المعياري 29.2±5.2 عاماً، وجميعهن خاضعات للإخصاب في المختبر.
* المجموعة المرضية الثانية: شملت 33 مريضة من مريضات مجموعة الـ PCOS درس لديهن أثر فرط التنبيه المضبط للمبيض (COH) Controlled Ovarian Hyperstimulation على مستويات الـ AMH، وذلك بمعايرة المستويات المصلية الـ AMH قبل COH (أي في اليوم الثالث للدورة) وبعد الانتهاء من بروتوكول COH (أي في يوم حقن الـ HCG) (الشكل 1).
* 20 امرأة سوية الإباضة، جميعهن خاضعات للإخصاب في المختبر بسبب العقم الذكري. وكانت معايير الاستبعاد وجود قصة سريرية سابقة لاضطرابات طمثية، غياب أحد المبيضين، مستويات مصلية غير طبيعية من البرولاكتين أو الأندروجينات، وجود معالجة هرمونية خلال الأشهر الثلاث السابقة للدراسة. وكان متوسط عمر النساء في مجموعة الشواهد ± الانحراف المعياري 29.2±6.2 عاماً. ويوضح الجدول 1 البيانات السريرية لأفراد الدراسة.
|
 |
تطبيق بروتوكول فرط التنبيه المضبط للمبيض على أفراد الدراسة
اتبعت المريضات البروتوكول الطويل لفرط التنبيه المضبط للمبيض والذي بدأ باستخدام مانعات الحمل الفموية في اليوم الثالث أو الخامس من دورة الحيض، واستكمل بتثبيط النخامة بوساطة مضاهئات الهرمون المحرر لموجهة الغدد التناسلية (Buserelin 0.05 mg) GnRH في منتصف الطور اللوتيني (اليوم 21 للدورة) والذي استمر إعطاؤه يومياً حتى يوم إعطاء HCG. وفي اليوم الثالث من دورة الحيض الجديدة، جرى حقن المريضات بالهرمون المنبه للجريب المأشوب (Gonal-F 75 IU, Sereno, Switzerland) rFSH. جرى تحديد جرعة الغونادوتروبين بالاعتماد على نمو الجريبات (المقاس بالتصوير فائق الصوت). وعندما أصبح قطر ثلاثة جريبات على الأقل أكبر من 17 مم جرى إعطاء المريضات 10000 IU من الـ HCG (Pregnyl, Organon, Iran). ثم جرى استرجاع الخلايا البيضية بعد 35 ساعة من إعطاء الـ HCG ونقلت الأجنة بعد 3 أيام من استرجاع الخلايا البيضية.
الاعتيان وتخزين العينات
جُمع 4-5 مل دم على أنابيب جافة، من كافة أفراد الدراسة، في اليوم الثالث لدورة الحيض، نُبذت العينات خلال نصف ساعة كحد أقصى، بسرعة 3500 دورة/ دقيقة وبدرجة حرارة الغرفة، وحُفظت المصول في أنابيب إيبندورف في الدرجة – 80°C إلى حين إجراء مقايسة الواصم المدروس.
مقايسة مستويات الهرمون المولري المضاد
جرت المقايسة باستخدام عتيدة AMH Gen II ELISA المصنعة من قبل شركة Beckman Coulter,Inc., USA ويعتمد مبدؤها على مقايسة مناعية مضخمة إنزيمياً، حيث يُحضن كل من المعياريات والشواهد والعينات في الحجرات المعدة للمقايسة والتي جرى تبطينها مسبقاً بضد مضاد للـ AMH. وبعد الحضن والشطف يُضاف ضد الضد الموسوم بالبيوتين لكل حجرة، بعد الحضن والشطف الثاني، يُضاف إنزيم بيروكسيداز فجل الخيل المرتبطة بالستربتافيدين Streptavidin-horseradish peroxidase إلى الحجرات، يلي ذلك مرحلة الحضن والشطف الثالثة، ثم تُضاف ركازة التتراميثيل بنزيدين (TMB) Tetramethyl Benzidine إلى الحجرات. وفي النهاية يُضاف محلول التوقف الحمضي. وتُعين درجة التقلب الإنزيمي للركازة بواسطة قياس الامتصاص في موجة طولها 450 نانومتر. إلا أن هذه العتيدة إلى الآن مصممة لأغراض البحث العلمي فقط.
التحليل الإحصائي
لدى دراسة توزع متثابتات العينة، تبين أن المتثابتات لا تتوزع توزعاً طبيعياً، لذلك استخدمت المعاملات اللابارامتريةNon parametric coefficients، فاعتمد اختبار Mann-Whitney test لتحديد ما إذا كان الفارق بين المتوسطات ناجماً عن الحظ والمصادفة أم أنه فارق جوهري. واعتمدت قيمة P< 0.05 للاعتداد الإحصائيً.
اعتمد معامل الارتباط Spearman لدراسة علاقة الارتباط لدى متثابتات المجموعة الواحدة واعتبرت قيمة P< 0.05 معتداً بها إحصائياً.
أجريت كل العمليات الإحصائية باستخدام SPSS version 18 وMedCalc V 21.2.1.
|
| النتائج |
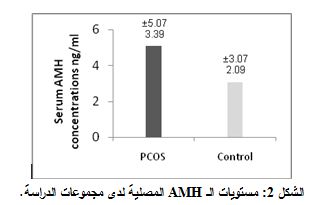
أظهرت مستويات AMH المصلية ارتفاعاً ملحوظاً معتداً به لدى مريضات الـ PCOS مقارنة بالشواهد، حيث كان متوسط مستويات AMH المصلية لدى المريضات ± الانحراف المعياري 5.07±3.39 نغ/ مل ولدى الشواهد 3.07±2.09 نغ/ مل، وكان الفارق معتداً به احصائياً P=0.004 (الشكل 2).
درست علاقة مستويات AMH المصلية مع النتائج التالية للإخصاب في المختبر: عدد الخلايا البيضية المسترجعة، عدد الخلايا البيضية الناضجة، عدد الأجنة، معدل الإخصاب، حدوث الحمل.
جرى حساب كل من عدد الخلايا البيضية المسترجعة والخلايا البيضية الناضجة وعدد الأجنة بالعد المجهري، في حين حُسب معدل الإخصاب من العلاقة التالية: عدد الأجنة المتشكلة X 100/ عدد الخلايا البيضية الناضجة.
أظهرت مستويات الـ AMH، لدى مريضات الـ PCOS، ارتباطاً إيجابياً معتداً به إحصائياً مع كل من عدد الخلايا البيضية المسترجعة (r= 0.39، P=0.01) وعدد الخلايا البيضية الناضجة (r=0.33، P=0.03). في حين لم تبدِ ارتباطاً يُعتد به إحصائياً مع كل من عدد الأجنة ومعدل الإخصاب.
بالنسبة للنساء سويات الإباضة أيضاً أظهرت مستويات الـ AMH ارتباطاً إيجابياً ومعتداً به مع عدد الخلايا البيضية المسترجعة (r=0.51، P=0.02) وعدد الخلايا البيضية الناضجة (r=0.64، P=0.002) وعدد الأجنة الكلي(r= 0.62، P=0.002)، في حين لم تبدِ ارتباطاً معتداً به مع معدل الإخصاب.
|
 |
| دراسة أثر التنبيه المضبط للمبيض COH على المستويات المصلية للـ AMH |
كان قد جرى إثبات أن مستويات AMH المصلية لا تتبدل عادة خلال الطور الجريبي في دورات الحيض العفوية ((9، لذلك قامت دراستنا بتقييم التبدلات المحتملة لمستويات AMH المصلية خلال تطبيق بروتوكول فرط التنبيه المضبط للمبيض المعتمد بشكل أساسي على إعطاء الهرمون المنبه للجريب خارجي المنشأ.
حيث أجرينا مقايسة المستويات المصلية للـ AMH قبل بدء بروتوكول فرط التنبيه المضبط للمبيض COH controlled Ovarian Hyper-stimulation وفي يوم إعطاء الـ HCG، أي بعد نهاية بروتوكول الـ COH.
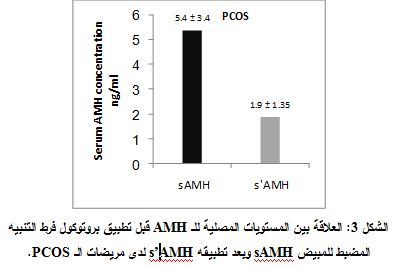
فوجدنا أن المستويات المصلية للـ AMH تنخفض بشكل ملحوظ (حوالي 64.7%) خلال المعالجة بموجهات الغدد التناسلية لدى مرضى الـ PCOS، حيث كان متوسط مستويات الـ AMH المصلية ± الانحراف المعياري قبل البدء ببروتوكول COH لدى المريضات (33 مريضة) 5.4±3.4 نغ/ مل، ومتوسط مستويات الـ AMH المصلية بعد الانتهاء من البروتوكول لدى المريضات ذاتهن1.9±1.35 نغ/ مل والفارق معتداً به إحصائياً (P< 0.0001) (الشكل 3).
وكذلك الأمر بالنسبة لمجموعة الشواهد، حيث انخفضت مستويات الـ AMH المصلية نتيجة لتطبيق بروتوكول فرط التنبيه المضبط للمبيض بنسبة 66.1%، فكان متوسط مستويات AMH المصلية ± الانحراف المعياري قبل تطبيق البروتوكول 3.07±2.09 نغ/ مل، ومتوسط المستويات المصلية بعد الانتهاء من البروتوكول 1.04±1.06 نغ/ مل والفارق معتداً به إحصائياً (P= 0.005). ولاحظنا أن هنالك ميلاً لانخفاض مستويات الـ AMH المصلية أكثر لدى النساء سويات الإباضة.
|
| المناقشة Discussion |
ترتفع مستويات AMH المصلية عند مريضات الـ PCOS مقارنة بالشواهد. ويمكن تفسير ذلك بارتفاع عدد الجريبات الغارية الصغيرة لدى مريضات الـ PCOS، وكونه أصبح من المثبت أن الـ AMH يُفرز من الجريبات الغارية وقبل الغارية الصغيرة، فمن الطبيعي أن يؤدي زيادة عدد الجريبات إلى زيادة مستويات الـ AMH. وهذا ما أثبتته دراسة Pigny et al. 2006 (14). وبقيت هذه النظرية سائدة لفترة لابأس بها على أنها السبب الوحيد لارتفاع الـ AMH عند مريضات الـ PCOS، لكن في عام 2007 أشارت إحدى الدراسات السريرية إلى زيادة إنتاج الخلايا المحببة المبيضية للـ AMH بشكل كبير عند مريضات الـ PCOS (أعلى بـ 75 ضعف من مستوياته عند النساء سويات الإباضة) وهذا ما أثبتته دراسة Pellatt وزملائه عام 2007 (15).
وبالتالي نستنتج أن ارتفاع تركيز الـ AMH لدى مريضات الـ PCOS مرتبط بشكل كبير بزيادة إنتاج الـ AMH من كل جريب على حدة. وهو ليس فقط كنتيجة لزيادة عدد الجريبات.
ترتبط المستويات المصلية للـ AMH ارتباطاً إيجابياً بعدد الخلايا البيضية المسترجعة والخلايا البيضية الناضجة عند مريضات الـ PCOS ولكنها لا ترتبط بعدد الأجنة أو معدل الإخصاب أومعدل الحمل.
ولقد توافقت نتائج دراستنا مع نتائج دراسة Arabzadah وزملائه عام 2010 والتي اقترحت أن المستويات المصلية للـ AMH لدى مريضات الـ PCOS الخاضعات للإخصاب في المختبر تتنبّأ بعدد الخلايا البيضية، لكنها لا ترتبط مع نتائج الإخصاب الأخرى داخل المختبر (معدل نضج الخلايا البيضية ومعدل الاخصاب ودرجة الأجنة عالية الجودة وحدوث الحمل) (16).
وكذلك توافقت نتائج دراستنا مع دراسة Aleyasin وزملائه عام 2011 والتي اقترحت وجود ارتباط مباشر ومعتد به بين مستويات الـ AMH المصلية وكلاً من عدد الخلايا البيضية المسترجعة وعدد الخلايا البيضية الناضجة ولكن لم تتوافق مع دراستنا بعدد الأجنة المنقولة (17).
ترتبط المستويات المصلية للـ AMH بعدد الخلايا البيضية المرتجعة والخلايا البيضية الناضجة وعدد الأجنة الكلي عند النساء سويات الإباضة ولكنها لا ترتبط بمعدل الإخصاب أومعدل الحمل. ولقد توافقت نتائجنا مع نتائج دراسة Vanrooij وزملائه عام 2002 والتي أظهرت أن مستويات الـ AMH المصلية متنبىء جيد لعدد الخلايا البيضية المسترجعة (18). كما توافقت أيضاً مع نتائج دراسة Seifer وزملائه عام 2002 والتي اقترحت وجود ارتباط ايجابي بين عدد الخلايا البيضية ومستويات الـ AMH المصلية (19). كما توافقت نتائجنا أيضاً مع نتائج دراسة Arabzadah وزملائه عام 2010 والتي أشارت إلى ارتباط إيجابي ومعتد به بين مستويات الـ AMH المصلية وكلاً من عدد الخلايا البيضية المسترجعة ونسبة نضجها ومعدل الانغراس لدى النساء سويات الإباضة، في حين لم ترتبط مع معدل الإخصاب أو حدوث الحمل (16).
يؤدي تطبيق بروتوكول التنبيه المضبط للمبيض إلى خفض المستويات المصلية للـ AMH لدى كل من مريضات الـ PCOS والنساء سويات الإباضة، ولكن تبقى مستويات AMH المصلية لدى مريضات الـ PCOS أعلى من مثيلاتها لدى النساء سويات الإباضة. ويمكن تفسير ذلك بما يلي:
1- تطور الجريبات الغارية الصغيرة إلى جريبات ناضجة كبيرة كاستجابة لتنبيه المبيض بواسطة الـ FSH (هي ظاهرة لا تحدث خلال الدورات الطمثية السوية). ولقد توافقت نتائج دراستنا مع دراسة Franchin وزملائه عام 2003 والذي وجد أن المستويات المصلية للـ AMH انخفضت باستمرار خلال المعالجة بالـ FSH لدى المريضات الخاضعات للـ COH من أجل الإخصاب داخل المختبر (تعاني المريضات من عقم غير مفسر أو شذوذات أنبوبية او انتباذ بطاني رحمي أو شذوذات في النطاف) بينما ارتفعت مستويات الهرمونات الأخرى خلال العلاج بالـ FSH (مثل الاستراديول) (20).
2- إن فرط الأندروجينية الموجود لدى مريضات الـ PCOS (وغير الموجود لدى المجموعة الشاهدة) يؤثر بشكل مباشر على إفراز الـ AMH من الخلايا المحببة المبيضية، كما يؤثر على تكون الجريبات، مما يؤدي إلى ارتفاع مستويات الـ AMH لدى مريضات الـ PCOS أكثر من المجموعة الشاهدة وبقائه مرتفعاً بعد الـ COH، وهذا ما أثبتته دراسة Eldar- Geva وزملائه عام 2005، التي وجدت أن مستويات الـ AMH المصلية تبقى مرتفعة بعد الـ COH لدى مريضات الـ PCO اللاتي يعانين من فرط الأندروجينية مقارنة بمريضات الـ PCO اللاتي لا يعانين من فرط الأندروجينية، على الرغم من تساوي عدد الجريبات الصغيرة لدى بدء المعالجة (21).
|
| المراجع References |
1-Norman R; Dewailly D; Legro R. and
Hickey T.
Polycystic ovary syndrome.
Lancet, 370: 685-697, 2007.
2-Garruti G; Depalo R; Vita MG; Lorusso F; Giampetruzzi F; Damato AB. and Giorgino F.
Adipose tissue, metabolic syndrome and polycystic ovary syndrome: from pathophysiology to treatment.
Reprod Biomed Online, 19: 552-563, 2009.
3-Qiao J. and Feng HL.
Extra- and intra-ovarian factors in polycystic ovary syndrome: impact on oocyte maturation and embryo developmental competence.
Hum Reprod Update, 17(1):17-33, 2011.
4-Schorge J; Schaffer J; Halvorson L; Hoffman B. and Bradshaw K.
Polycystic ovarian syndrome and hyperandrogenism.
In: "Williams Gynecology". Ed: Schorge J, Schaffer J, Halvorson L, Hoffman B, Bradshaw K. Pub: McGrow-Hill, Inc., 779-815, 2008.
5-Sukchareon N.
Management of anovulatory infertility associated with polycystic ovary syndrome.
J Med Assoc Thai., 87: 182-188, 2007.
6-Hershlag A. and Peterson C.
Endocrine disorders. In: Novak's Gynecology.
Ed: Berek J. Pub: Lippincott Williams & Wilkins, 359-378, 2000.
7-Fraser I; Illingworth P; McGee T; Pesce A; Arndt B. and Horvath J.
Report of the independent review of assisted reproductive technologies.
review commite, 29-31, 2006.
8-Knight PG. and Glister C.
TGF-? superfamily members and ovarian follicle development.
Reproduction, 132:191-206, 2006.
9-La Marca A; Sighinolfi G; Radi D; Argento C; Baraldi E; Artenisio AC; Stabile G. and Volpe A.
Anti-Mullerian hormone (AMH) as a predictive marker in assisted reproductive technology (ART).
Hum Reprod Update., 16(2): 113-30, 2010.
10-Cate RL; Donahoe RK. and MacLauglin DT.
Müllerian-inhibiting substance. In: Peptide growth factors and their receptors II.
Ed: Sporn MB, Roberts AB. Pub: Springer, 95: 179-210, 1990.
11-Pellatt L; Rice S. and Mason H.
Anti-Mullerian Hormone and polycystic ovary syndrome: A mountain too high.
Reproduction, 139: 825-33, 2010.
12-Hampl R; ?najderov? M. and Marde?i? T.
Anti müllerian hormone (AMH) not only a marker for prediction of ovarian reserve.
Physiol Res., 60(2): 217-23, 2011.
13-Chang RJ.
A practical approach tothe diagnosis of polycystic ovary syndrome.
Am J Obstet Gynecol., 191(3): 713-717, 2004.
14-Pigny P; Jonard S; Robert Y. and Dewailly D.
Serum anti-Mullerian hormone as a surrogate for antral follicle count for definition of the polycystic ovary syndrome.
J Clin Endocrinol Metab., Mar; 91(3):941-945, 2006.
15-Pellatt L; Hanna L; Brincat M; Galea R; Brain H; Whitehead S. and Mason HD.
Granulosa cell production of anti-Müllerian hormone (AMH) is increased in the polycystic ovaries.
Journal of Clinical Endocrinology and Metabolism, 92: 240-245, 2007.
16-Arabzadeh S; Hossein G; Rashidi B; Hosseini M. and Zeraati H.
Comparing serum basal and follicular fluid levels of anti-Müllerian hormone as a predictor of in vitro fertilization outcomes in patients with and without polycystic ovary syndrome.
Ann Saudi Med., 30: 442-447, 2010.
17-Aleyasin A; Aghahoseini M; Mokhtar S. and Fallahi P.
Anti-mullerian hormone as a predictive factor in assisted reproductive technique of polycystic ovary syndrome patients.
Acta Med Iran., 49(11): 715-720, 2011.
18-Van Rooij IA; Broekmans FJ; Te Velde ER; Fauser BC; Bancsi LF; Jong FH. and Themmen AP.
Serum AMH levels: a novel measure of ovarian reserve.
Hum Reprod., 17: 3065-3071, 2002.
19-Seifer DB; MacLaughlin DT; Christian BP; Feng B, Shelden RM.
Early follicular serum müllerian-inhibiting substance levels are associated with ovarian response during assisted reproductive technology cycles.
Fertil Steril., 77(3): 468-471, 2002.
20-Fanchin R; Schon?uer LM; Righini C; Frydman N; Frydman R. and Taieb J.
Serum anti-Müllerian hormone dynamics during controlled ovarian hyperstimulation.
Hum Reprod., 18(2): 328-332, 2003.
21-Eldar-Geva T; Margalioth EJ; Gai M; Ben-Chetrit A; Algur N; Zylber-Haran E; Brooks B; Huerta M. and Spitz IM.
Serum anti-Müllerian hormone levels during controlled ovarian hyperstimulation in women in polycystic ovaries with and without hyperandrogenism.
Human Reproduction, 20: 1814-1819, 2005.
|
| |
| المجلد 7 ,
العدد 1
, ذو القعدة 1434 - تشرين أول (أكتوبر) 2013 |
|
|
|
