| المجلد 7 ,
العدد 1
, ذو القعدة 1434 - تشرين أول (أكتوبر) 2013 |
| |
| التأثير المضاد لزعاف نحل العسل السوري على أنواع مختلفة من الجراثيم |
| Antibacterial Effect of Syrian Honeybee (Apis mellifera)
Venom on Different Species of Bacteria
|
| د.عالية نبيل عمران* أ.د. انطونيوس الداود** وأ.د. ليلى مسوح* |
| Omran A.N., AL Dwod A. and Masouh L. |
*كلية الصيدلة- جامعة دمشق، **هيئة الطاقة الذرية السورية
*Faculty of Pharmacy, Damascus University, **Atomic Energy Commission of Syria
|
| الملخص Abstract |
| جرى فحص الزعاف المجموع من 12 خلية نحل عسل سوري (من النوع Apis mellifera) من أجل أثره المثبط لأنواع مختلفة من الجراثيم. أظهر زُعاف نحل العسل السوري وبتراكيز أخفض نسبياً تأثيرات مماثلة لزُعاف نحل العسل النقي المستورد من شركة سيغما. وفي هذا العمل جرى إثبات أن فاعلية زُعاف نحل العسل المحلي المضادة للجراثيم منوطة بالتركيز. وهو يملك تأثيراً كابحاًَ للجراثيم بتراكيز منخفضة نسبياً ويبدي فاعلية مبيدة للجراثيم بالتراكيز الأعلى. وكشفت نتائجنا أن الجراثيم إيجابية الغرام، مثل اللِّيستَرِيَّة المُسْتَوحِدَة والعُنْقودِيَّة الذَّهَبِيَّة، أكثر حساسية للزعاف من الجراثيم سلبية الغرام، مثل الإِشْريكِيَّة القولونِيَّة، السَّلْمونيلَة المعويّة، اليَرْسَنِيَّة الكرستنسينيّة، الكلِبْسيلَّة الرِّئَوِيَّة، الكلِبْسيلَّة مُحرضة الإجهاض. إن هذه الخاصية المضادة للجراثيم لزعاف نحل العسل يمكن أن تُستخدم لأغراض طبية ومستحضرات دوائية، أو لحفظ الغذاء مع بعض التعديلات. |
| Venom collected from 12 Syrian honey bee hives (Apis mellifera) was examined for its inhibitory effect on different species of bacteria. Local bee venom in relatively lower concentrations showed nearly the same effect as purified venom purchased from Sigma. In this work, antibacterial activity of local bee venom proved to be concentration-dependent. It has an inhibitory bacteriostatic effect at low concentrations and exhibits a bactericidal activity at high concentrations. Our results revealed that gram positive bacteria, e.g. Listeria Monocytogenes, and Staphylococcus Aureus, were more sensitive to venom than the gram negative e.g. Escherichia Coli, Salmonella Enterica, Yersinia Kristensenii, Klepsiella Pneumoniae and Klepsiella Oxytoca. This antibacterial property of bee venom may be used for medical purposes and drug preparations, or by some modifications for food preservation. |
| المقدمة Introduction |
يستأثر البحث عن أنواع جديدة من المواد البيولوجية المضادة للجراثيم، التي لا تستطيع الجراثيم تطوير مقاومة لها، باهتمام كبير ممن يعملون في مجال البحوث الطبية والصيدلانية. ولقد أظهر عدد من أنواع الزُعاف الحيوانية (كزعاف الكوبرا والعقارب والضفادع) خصائص مضادة للجراثيم (1، 2)، إضافة إلى عدة فوائد أخرى، حيث أصبحت هذه المواد الطبيعية تستخدم كمستحضرات صيدلانية. بناءً على ذلك، فإن أهمية دراسة خصائص زعاف النحل المضادة للجراثيم أصبحت غنية عن التعريف (5-3)، وهي ترجع إلى أسباب عديدة، أهمها أن النحل من الحشرات الاقتصادية المفيدة للبيئة والإنسان، ويمكن تربيته بسهولة والاستفادة من منتجاته المختلفة، كما يمكن الحصول على هذا النوع من الزعاف بكمية كبيرة نسبياً، وبسهولة ويسر؛ الأمر الذي لا ينطبق على سموم الأفاعي والعقارب. بالإضافة إلى توفر منتجات النحل كمواد أولية محلية، حيث تحتل سورية المرتبة الثانية في تربية النحل بالنسبة للمنطقة العربية. إن المعالجة الطبية بزُعاف النحل قديمة، فقد استخدمها اليونانيون والهنود والمصريون وشعوب قديمة أخرى (6). أما حالياً فيستخدم الزعاف في الطب الشعبي، كمانع لتخثر الدم ومسكن للألم ومضاد للالتهاب في بعض حالات الأمراض المزمنة، كالرثية والتهاب الوتر والتليف والتصلب اللويحي (11-7).
بدأت الدراسات على زُعاف النحل في أواخر القرن التاسع عشر (12). وهو يعد مركباً بيولوجياً بروتينياً معقداً يحتوي على نسبة عالية من الماء، تصل إلى 80%. وهو سائل شفيف، عديم اللون، نفّاذ الرائحة، طعمه مر؛ ذواب في الماء وفي بعض الأحماض ومقاوم للقلويات. تبلغ كثافته 1.13، ويبلغ كمون تركيز أيوناته الهيدروجينية pH 5.5 (13، 14).
تفرز العاملات (الشغالات) الزُعاف من غدد حمضية وقلوية، موجودة في نهاية القطعة البطنية الأخيرة، بعد أن تكون قد اختزنته ضمن كيس الزُعاف venom sac، وتستخدمه للدفاع عن القفير وعن نفسها بوساطة جهاز اللسع الموجود في النهاية السفلية للبطن، حيث تغرزه في جسم الضحية؛ فتحقن السم من خلاله (17-15).
ونظراً لعدم وجود دراسات تناولت اختبار تأثير زعاف النحل المحلي في الجراثيم؛ فقد هدفت هذه الدراسة إلى تحري هذا التأثير عن طريق جمع الزُعاف من سلالات النحل المحلية، واختبار فعاليته على عدد من الجراثيم شائعة الإمراضية، إيجابية وسلبية الغرام، ومقارنة النتائج مع تأثير الزُعاف النقي المستورد من شركة سيغما.
|
المواد والطرق والتجهيزات
استحصل على زُعاف النحل المجفد lyophilized bee venom، وألبومين مصل البقر المعياري bovin serum albumin من شركة سيغما Sigma (مينيسوتا، الولايات المتحدة الأمريكية). كما استخدم ماء ثنائي التقطير عالي النقاوة (lichrosolv) من شركةMerck ، ألمانيا.
جمع زعاف النحل المحليlocal bee venom من 12 قفير نحل من النوع Apis mellifera (يتألف جينياً من 80% من النحل السوري و20% من النحل الإيطالي) الموجود لدى مديرية زراعة ريف دمشق- دائرة الوقاية – شعبة النحل والحرير– مرج السلطان. كما استخدمت مرشحة صغريّة مساميتها0.22 مِكرومتر، من شركة Millipore (ألمانيا). واستخدم أيضاً وسط زرع Luria-Bertani Medium (LB broth) من شركة BDH )انكلترا(، و0.5 McFarland Standard من شركة Fisher Scientific (انكلترا)، وغراء مغذِّ وأطباق بتري.
استخدم واسم للبروتينات تقع كتله الجزيئية النسبية بين 10 و170 كيلودالتون، من شركة Fermentas، (ليتوانيا). واستخدم محلول الأكريلاميد40 % (29:1) وملون Bradford من شركة BIO-RAD (الولايات المتحدة الأمريكية)، وصفائح المقايسة المناعية الإنزيمية (إليزا) التي تحوي صفيحتها 96 بئراً، وصفائح تنمية الجراثيم التي تحوي صفيحتها 12 بئراً TPP (سويسرا). والجراثيم المستخدمة في التجربة جميعها منمطة (مرجعية)، واستحصل عليها من شركة Microbiologics (فرنسا)، وهذه الأنماط هي: اللِّيستَرِيَّةُ المُسْتَوحِدَة ATCC 19111، والعُنْقودِيَّةُ الذَّهَبِيَّةATCC 11632 ، والإِشْريكِيَّةُ القولونِيَّةATCC 35421 ، واليَرْسَنِيَّة الكرستنسينية 33639 ATCC، والسَّلْمونيلَة المعويةATCC 7001 ، والكلِبْسيلَّةُ الرِّئَوِيَّة ATCC 10031، والكلِبْسيلَّةُ مُحرضة الإجهاض ATCC 13182. كما استخدم في هذا البحث جهاز جمع زُعاف النحل من شركة ChungJin Biotech (كوريا)، وجهاز الرحلان الكهربائي للبروتينات من شركة BIO-RAD، وقارئ إليزا من شركة Fisher. كما استخدمت مجفدة ومنبذة من شركة Eppendorf (ألمانيا). جرى العمل في شعبة النحل والحرير- مرج السلطان عند جمع الزعاف، وفي مخابر هيئة الطاقة الذرية – قسم البيولوجيا الجزيئية والتقانة الحيوية.
الاعتيان
جرى الاعتيان في شهري حزيران وتموز بين 6.30-8.30 صباحاً؛ وجرى جمع الزُعاف وفقاً لمبدأ الصدمة الكهربائية للنحل باستخدام جهاز جمع الزُعاف، الذي يتألف من إطار، يضم عدداً من الأسلاك، تتوضع على نحو متوازٍ. وتوجد تحت الأسلاك مباشرة صفيحة زجاجية. توصل الأسلاك إلى بطارية طاقتها 12 فولط؛ فيتعرض النحل، في حال إغلاق الدارة، إلى صدمات كهربائية خفيفة متناوبة.
تستثير الصدمة الكهربائية العاملة (الشغّالة) بمجرد وجود جسم غريب على مدخل القفير، فتحاول الدفاع عنه وتهاجم جهاز جمع الزُعاف وتقوم باللسع، فيصطدم جهاز اللسع بالصفيحة الزجاجية الموجودة مباشرة تحت الأسلاك؛ فيُطرح الزعاف على الصفيحة الزجاجية، ويكون لزجاً ذا رائحة واخزة. تُترك الصفيحة بضع دقائق؛ فيجف الزُعاف ويصبح على شكل بلورات بيضاء شفيفة. يقشط الزعاف الخام بشفرة حادة ويحفظ في عبوات خاصة بدرجة حرارة 4 °C إلى حين التنقية (18).
التنقية
تُذاب عينة زعاف خام، وزنها 100ملغ بكمية 4 مل من ماء رباعي التقطير عالي النقاوة وعقيم. ثم تُنبذ الحلالة مدة 20 دقيقة بدرجة حرارة 4 °C بسرعة 12000 دورة/ الدقيقة. يؤخذ الطافي ويُنبذ مرة ثانية بالشروط ذاتها، وتُهمل الرسابة.
يُمرر السائل الطافي على مرشح غشائي مساميته 0.22 مكم. يُجفد السائل، ويُحفظ الزعاف المجفد بدرجة حرارة -20°C إلى حين استخدامه (19).
|
| تحضير المحاليل الأمStock Solutions |
يُذاب 25 ملغ من كلٍ من الزُعاف المستورد من شركة سيغماSigma bee venom (SBV) ومن الزُعاف المحلي Local bee venom (LBV) المنقى في 1مل من دارئة فسفاتية ملحية (PBS). يُجرى العمل بالعينتين على نحو متماثل وبالشروط ذاتها، وهاتان العينتان يعدان كمحلولي أم.
معايرة البروتينات
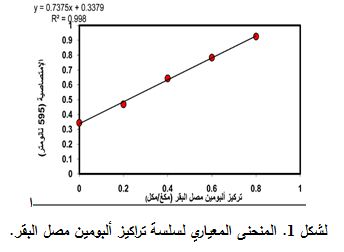
جرت معايرة البروتينات وفقاً لطريقة "برادفورد" Bradford ((20، حيث حُضرت سلسلة معيارية لألبومين مصل البقر bovine serum albumin (BSA) بتراكيز قدرها 0.8, 0.6, 0.4, 0.2 مكغ/ مكل في الدارئة الملحية نفسها (PBS) المستخدمة لحل الزعاف. مُددت المحاليل الأم للعينتين SBV وLBV 50 ضعفاً، وقيست التماصيّة بموجة طولها 595 نانومتر (OD 595) بجهاز قارئ إليزا وذلك للعينات كافة.
ضُبط بعدئذٍ تركيز البروتين في LBV وSBV بالإسقاط على المنحنى المعياري لسلسلة تراكيز متزايدة من ألبومين مصل البقر (الشكل 1).
الرحلان الكهربائي على هلامة عديد الأكريلاميد بوجود سلفات دوديسيل الصوديوم
Sodium Dodecyl Sulphate Polyacrylamide Gel Electrophoresis (SDS-PAGE)
حُضرت هلامة الفصل من عديد الأكريلاميد بتركيز 12.5% ، بينما حُضرت هلامة التكديس بتركيز قدره 4 % وصُبت فوق هلامة الفصل المتكوثرة. أُضيف مقدار 5 مكرولتر من دارئة العينة 5X sample buffer والمؤلفة من 5% بيتامركبتو إيتانول، 0.2% أزرق البروموفينول، 16 ميلي مول تريس-HCL، ذي pH 6.8، 25% غليسيرول، 10% سلفات دوديسيل الصوديوم، وذلك لكل من عينتي LBV وSBV، وبحجم قدره 15 مكل، وذلك بعد تمديدهما بمقدار عشر أمثال. جرى التسخين مدة ثلاث دقائق بدرجة حرارة 95 °C. أُضيف بعدها 20 مكل من العينتين إلى كل بئر، كما خُصص أحد الآبار لترحيل 5 مكل من واصم البروتين المعياري الذي تقع كتله الجزيئية النسبية بين 10 و170 كيلو دالتون من شركة Fermentas. رُحلت الهلامة باستعمال تيار استطاعته 85 فولط حتى دخول العينات في هلامة الفصل، ثم رُفعت إلى 110 فولط.
لونت الهلامة بأزرق الكومازي اللامع250 Coomassi brilliant blue R-. أزيل اللون بوساطة محلول من حمض الأسيتيك 10% والميثانول 30% (21).
التأثير المضاد للزعاف على أنواع مختلفة من الجراثيم
اختبر تأثير الزعاف في دراستنا على جراثيم إيجابية الغرام وهي اللِّيستَرِيَّة المُسْتَوحِدَة والعُنْقودِيَّة الذَّهَبِيَّة وجراثيم سلبية الغرام وهي الإِشْريكِيَّة القولونِيَّة، واليَرْسَنِيَّة الكرستنسينية، والسَّلْمونيلَة المعويّة، والكلِبْسيلَّة الرِّئَوِيَّة، والكلِبْسيلَّة مُحرضة الإجهاض. جرى العمل على الجراثيم المستخدمة في التجربة جميعها وجرى اختبار تأثير الزعاف وفقاً لطريقة تمديد المرقbroth dilution method (22) على الشكل التالي:
تحضير المعلقات الجرثومية وعلاقتها بالتماصيّة
زُرع كل نوع من الجراثيم في شروط التنمية الخاصة به، ثم نقلت أخيذة من كل طبق إلى طبق آغار مغذٍ nutrient agar (NA) بوساطة عروة التلقيح؛ حُضنت الأطباق بدرجة حرارة 37°C مدة 24 ساعة؛ فتشكلت مستعمرات أحادية مستقلة. حُضر المعلق الجرثومي subculture بتلقيح 3 مل من المرق المغذٍ LB broth بمستعمرة جرثومية واحدة مأخوذة من طبق الأغار؛ وحُضن بدرجة حرارة 37° Cمدة 24 ساعة ؛ ثُم حُضر معلق جرثومي أم يحوي1-2 x 108 cfu/ml (كثافته تعادل 0.5 Mac Farland Turbidity standard). جرت التمديدات اللازمة للمعلق الجرثومي subculture، وقيست التماصيّة لكل تمديد بموجة طولها 600 نانومتر. وجرى تعداد للمستعمرات الجرثومية المشاهدة على طبق أغار مغذٍ لكل تمديد بطريقة عد العيوشviable count المرجعية، وتم إنشاء منحنى يحدد العلاقة بين عكر turbidity المعلق الجرثومي (قيمة التماصيّةoptical density بموجة طولها 600 نانومتر وعدد الوحدات المشكلة للخلايا الجرثومية(23) cfu/ml كما هو موضح في الشكل 2.
اختبار تأثير الزعاف المضاد للجراثيم
استخدمت صفائح ذات آبار لحضن الجراثيم، سعة كل بئر منها 2 مل. جرت التمديدات اللازمة للحصول على محلول أم وسطيintermediates stock solutions لكل منSBV, LBV ، المعلق الجرثومي الأم، جرى اختبار تأثير الزُعاف في المعلق الجرثومي الحاوي على 5x105cfu/ml؛ وبلغت التراكيز النهائية لكل من الزعاف المعياري والمحلي (بتكرارية قدرها 3 آبار لكل تركيز) القيم التالية: 0، 25، 50، 100، 150، 200، 250، 300 مكغ/ مل.
حُضرت أيضاً (بتكرارية قدرها 3 آبار لكل شاهد) عينات إيجابية شاهدة على النمو الجرثومي (تحوي فقط المعلق الجرثومي ودارئة التمديد) وعينات سلبية شاهدةBlank على العقامة تحوي المرق المغذي والدارئة (دون مستعمرات جرثومية)، وعينات تحوي المعلق الجرثومي والكاناميسين بتركيز 50 مكغ/ مل. وحُضنت الصفائح مدة 24 ساعة بدرجة حرارة 37°C مع رج خفيف قدره 160 دورة/ دقيقة.
فُحصت العينات الشاهدة (للتأكد من سلامة العمل) في صفائح حضن الجراثيم، حيث لم يلاحظ أي عكر في الآبار الشاهدة السلبية Blank، بينما ظهر العكر بشكل واضح في الآبار الشاهدة الإيجابية، وكذلك لم يلاحظ أي عكر في الآبار التي تحتوي على الكاناميسين كشاهد مضاد للجراثيم (يتباين تأثير المضاد الحيوي من جرثوم لآخر) (25، 26). وضع في كل بئر من آبار صفائح إليزا المستخدمة 100 مكل من كل عينة من صفائح حضن الجراثيم، وكان كل بئر من صفائح حضن الجراثيم ثلاثي التكرارية؛ فحصلنا على 9 آبار (مكررات) لكل تركيز، و9 آبار (مكررات) لكل شاهد. قيست التماصيّة بموجة طولها 600 نانومتر. وجرى اسقاط قيم التماصيّة لتراكيز الزعاف المحلي والمستورد والشواهد على المنحنى المحدد لعلاقة عكر المعلق مع cfu/ml لكل نوع جرثومي، وحُدد التركيز المثبط الأدنى (MIC) minimum inhibition concentration بأقل تركيز يثبط نمو الجراثيم. ولقد جرى دعم النتائج والتحقق من التركيز المثبط الأدنى والعينات الشاهدة لكل نوع من أنواع الجراثيم، بتعداد المستعمرات الجرثومية المشاهدة على طبق أغار مغذٍ بطريقة عد العيوش viable count المرجعية لكل عينة من المكررات التسع (في طبق الإليزا) لكل تركيز مثبط وللعينات الشاهدة. واعتبر أدنى تركيز يقتل 99.9% من عدد الجراثيم البدئي للتجربة (23، 24) هو التركيز القاتل الأدنى (MBC) minimum bactericidal concentration.
|
|
| النتائج Results |
الرحلان الكهربائي
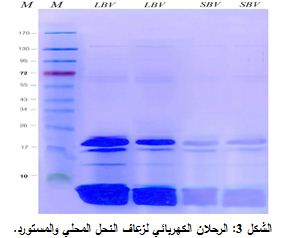
لوحظ في الرحلان الكهربائي توافقٌ في العينتين LBV و SBVوحدد تركيز البروتين فيهما بطريقة "برادفورد" Bradford فكان 6.84 مكغ/ مكل في LBV، و4.68 مكغ/ مكل فيSBV. وهذا يفسر وضوح حزم LBV أكثر من SBV (الشكل3).
التأثير في الجراثيم
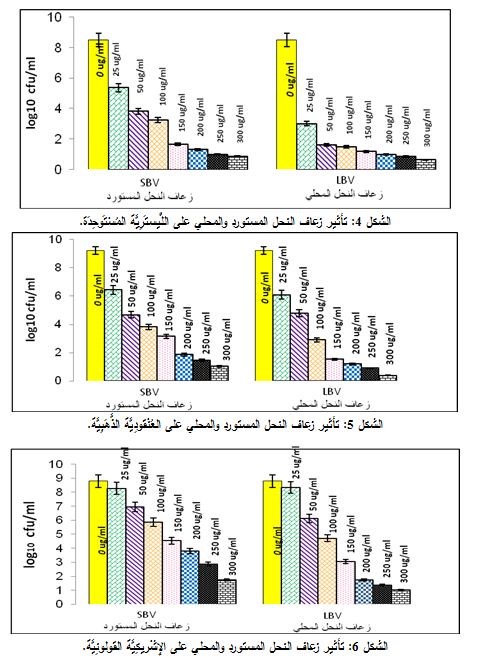
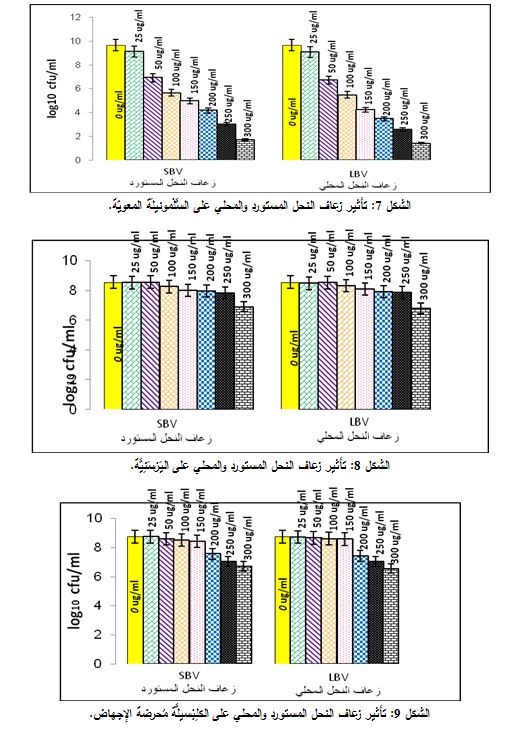
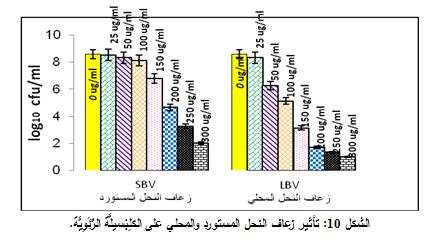
أبدت الجراثيم إيجابية الغرام مقاومة أقل لزعاف النحل من السلبية، فلقد بلغ التركيز المثبط لـ LBV وSBV 25 مكغ/ مل في نوعين من الجراثيم إيجابية الغرام، اللِّيستَرِيَّةُ المُسْتَوحِدَة والعُنْقودِيَّةُ الذَّهَبِيَّة. وهو أدنى تركيز توصلنا إليه في هذه الدراسة؛ أما تركيز الزعاف المحليLBV القاتل الأدنى لهاتين الجرثومتين فكان 50 و150 مكغ/ مل، على الترتيب، بينما ارتفع تركيز الزعاف المستورد SBV القاتل للجراثيم آنفة الذكر إلى 150 و200 مكغ/ مل، على الترتيب (الشكلان 4و5). أما بالنسبة للجراثيم سلبية الغرام؛ فقد ثُبط الزعاف نمو الإِشْريكِيَّةُ القولونِيَّة والسَّلْمونيلَة بتركيز قدره 50 مكغ/ مل لكل من LBV وSBV. وقد تباينتا بمقدار التركيز القاتل، حيث بلغ في الإِشْريكِيَّةُ القولونِيَّة لكل منLBV وSBV 200 و300 مكغ/ مل، على الترتيب؛ أما في السَّلْمونيلَة بلغ التركيز القاتل 300 لكل من LBV وSBV (الشكلان 6 و7). أظهرت الجرثومتان اليَرْسَنِيَّة والكلِبْسيلَّة مُحرضة الإجهاض مقاومةً واضحةً للزعاف وتساويتا بقيم التركيز المثبط؛ فبلغ التركيز المثبط الأدنى لهذين النوعين من الجراثيم لـ LBV وSBV 300 و200 مكغ/ مل، على الترتيب (الشكلان 8 و9)؛ ومن الجدير بالذكر أن الكلِبْسيلَّةُ الرِّئَوِيَّة كانت أقل مقاومة من الكلِبْسيلَّةُ مُحرضة الإجهاض؛ على الرغم من كونهما تتبعان الجنس نفسه، فبلغ التركيز المثبط الأدنى لها لكل منLBV وSBV مقدار 50 و150 مكغ/ مل، على الترتيب، والتركيز القاتل مقدار 200 و300 مكغ / مل، على الترتيب (الشكل 10).
قيمت نتائج الدراسة بحساب تعداد المستعمرات الجرثومية العام لتراكيز الزعاف المثبطة والقاتلة والعينات الشاهدة في أنواع الجراثيم المستخدمة كافة، ودلت النتائج على وجود فروقات ذات دلالة احصائية في متوسط تعداد المستعمرات الجرثومية العام بين العينات الشاهدة وعينات زعاف النحل، إذ أن قيمة P كانت أصغر من 0.05.
|
| المناقشة Discussion |
أوضحت نتائج دراستنا أن للزعاف تأثيراً في أنواع مختلفة من الجراثيم (إثنان منها إيجابية الغرام وخمسة سلبيّة الغرام). وبالنظر إلى الأشكال المبيّنة لتأثير زعاف النحل المحلي والمستورد في مجموعة جراثيم هذه الدراسة، فإننا نجد أن درجة التأثير منوطة بتركيز الزعاف المستخدم. فالجراثيم كافة تأثرت بالزعاف، واختلف التركيز الفعّال باختلاف نوع الجرثوم. وتتفق هذه النتائج مع دراسة أجراها باحثون آخرون عام 2007 (27) في كوريا، حيث اعتبر أن زعاف النحل يملك خصائص واضحة كمضاد للجراثيم عامة. واتضح أن الجراثيم
إيجابية الغرام كانت أقل مقاومة من السلبية، وهذه النتيجة تتفق مع دراسة أجريت عام 1967(28) في الولايات المتحدة الأمريكية، بينت أن نسبة أنواع الجراثيم إيجابية الغرام التي تأثرت بالزعاف بلغت 86% من مجموع أنواع الجراثيم المستخدمة في تلك الدراسة، في حين كانت نسبة تأثر أنواع الجراثيم سلبية الغرام 46%. وفي دراسة أخرى أجريت عام 2005 (29) في كوريا حُدد التركيز الأدنى المثبط للجراثيم سلبية الغرام بمثليه في إيجابية الغرام.
كانت نتائج الدراسات آنفة الذكر جميعها متوافقة وداعمة لنتائج دراستنا، وتخلص إلى أن الجراثيم سلبية الغرام أكثر مقاومة من الإيجابية وأن تأثير الزعاف المثبط والقاتل منوط بتركيز ونوع الجرثوم.
تقاربت قيم التراكيز الفعالة للزعاف في دراستنا مع دراسة أجريت عام 2009 في كوريا على تأثير الزعاف في العُنْقودِيَّةُ الذَّهَبِيَّة، التي تعد عاملاً إمراضياً لا يستهان به، وخاصة في ما يتعلق بالعدِّ الشائع acne vulgaris (30). وأيضاً مع دراسة أجريت عام 2006 في كوريا على أنواع عدة من الإِشْريكِيَّةُ القولونِيَّة (31) .
في حين أن نتائجنا لم تتفق مع دراسة أجريت عام 2007 في مصر من حيث تحديد مقدار التركيز القاتل للإِشْريكِيَّةُ القولونِيَّة وللعُنْقودِيَّةُ الذَّهَبِيَّة. فلقد توصلنا إلى تركيز قاتل أقل من المذكور في الدراسة بمقدار يعتد به بالنسبة للإِشْريكِيَّةُ القولونِيَّة. أما التركيز القاتل للعُنْقودِيَّةُ الذَّهَبِيَّة في دراستنا فكان أعلى بمقدار يعتد به عن التركيز الذي توصلت إليه تلك الدراسة32) ).
تباينت التراكيز المؤثرة في بعض الجراثيم بين الزعاف المحلي والمستورد، في حين تماثلت في بعضها الآخر، وقد تعزى هذه النتيجة إلى ارتفاع تركيز البروتين في عينة الزعاف المحلي بمقدار 2.16 عن المستورد وإلى حساسية الجرثوم نفسه، وتدعم هذه النتيجة أيضاً دراسات عديدة لأنواع مختلفة من الزعاف توضح أن لنوع النحل والبيئة والتغذية ولزمن جمع الزعاف تأثيرات واضحة على فعالية الزعاف نتيجة لاختلاف تراكيز أنواع مكوناته البروتينية (33، 34).
يعزى جزء كبير من التأثيرات البيولوجية المفيدة للزعاف لاحتوائه على ببتيدات ذات وزن جزيئي منخفض، تشكل أحياناً 65% من وزنه الجاف، وهي: المِليتين والأبامين والببتيد الحال للخلايا الحلمية MCD والسيكابين والتترافين. ويعد المِليتين المكون الرئيسي للزعاف ويبلغ وزنه الجزيئي 2486 دالتون، يشكل 40-50% من وزن الزعاف الجاف ويعتقد أنه أهم ببتيدات الزعاف فعاليّةً كمضاد للجراثيم والفطور35)). وفي دراسة أجريت عام 2009 لمقارنة التركيز الفعال للزعاف الكلي والتركيز الفعال لببتيد المِليتين المعزول من هذا الزعاف؛ وكذلك لتحديد الزمن اللازم لحدوث التأثير الذي يعقب أثر المضاد الحيوي (PAE) postantibiotic effect في كل من العُنْقودِيَّةُ الذَّهَبِيَّة والإِشْريكِيَّةُ القولونِيَّة، وجد أن للمِليتين تأثيراً بيِّناً يساوي من حيث الأهمية تأثير الزعاف الكلي(30) .
جرى في دراسات عديدة اختبار فاعلية بعض الببتيدات المعزولة من الزعاف على الجراثيم. ووجد أن لببتيدات الزُعاف تأثيراً واضحاً على الجراثيم، بالإضافة إلى ذلك التأثير التآزري مع بعضها البعض. ونذكر كمثال، التأثير التآزري لفعل المِليتين والفسفوليباز معاً؛ حيث يعد إنزيم الفسفوليباز PLA2 الذي يشكل 10-12% من وزن الزعاف الجاف، وهو أحد أنوع الفسفوليباز ذي الوزن الجزيئي المنخفض نسبياً 17000Da، ذا فاعلية مضادة للجراثيم أيضاً (36، 37). فمن المعلوم أن المِليتين هو ببتيد ذو وزن جزيئي منخفض ويتمتع بخواص محبة للماء وللدهن معاً. وهذا ما يجعله قادراً على تمزيق الغشاء الخلوي (كما يفعل المنظف) بإنقاص التوتر السطحي بينه وبين الغشاء الذي يتألف من طبقة ثنائيّة الشحم، مما يسهل فعل الفسفوليباز، الذي يقوم بالارتباط بشحميات الغشاء وحلمهتها (35، 38). ويمكن للمِليتين أن يبدي التأثير القاتل للجراثيم لوحده بسبب وزنه الجزيئي المنخفض وسهولة عبوره واختراقه للغشاء الخلوي وثباتيته العالية. ويدعم ذلك عدة دراسات حول تأثير المليتين المعزول من زعاف النحل على الجراثيم (30، 39، 40).
إن إحدى الآليات التي تعمل وفقاً لها الببتيدات المضادة للجراثيم anti microbial peptides (AMPs)، بما في ذلك ببتيدات الزعاف، تتمثل بثقب جدار الخلية الجرثومية عن طريق الارتباط ببروتينات معينة تتعلق ببنية الببتيد نفسه وبالأحماض الأمينية المكونة له وبالروابط ثنائية السلفيد الموجودة في بنية بعض الببتيدات. وتتعلق أيضاً بطبيعة الغلاف الجرثومي وشحنته. بالإضافة إلى ذلك، فإن هذه الآلية لا تسمح للجراثيم بتطوير ضروب مقاومة له. ومن هنا تبرز أهمية المعالجة بتلك الببتيدات كمواد مضادة للجراثيم والفطور (41، 42). تعد هذه الدراسة على زُعاف النحل السوري الأولى من نوعها، مع العلم بأنها تتوافق مع دراسات حول الزُعاف من نوع النحل نفسه ومن أنواع أخرى أيضاً (32، 33).
الاستنتاج
بناءً على ما تقدم، توضح نتائج دراستنا في ما يتعلق بالتراكيز المثبطة والقاتلة لزعاف النحل على أنواع من الجراثيم إمكان استخدام زعاف النحل السوري في السيطرة على نمو عدد من الجراثيم سـلبية وإيجابية الغرام. كما أن اسـتخدام الزعاف علاجياً يحتاج إلى دراسات أخرى بغية تحديد الشكل الصيدلاني الأمثل، والجرعة الملائمة، والزمن اللازم والتأكد من سلامة وأمان التطبيق على الإنسان، سيما أننا نتعامل مع مواد تعد أساساً مواد سامة، ولكنها تمتلك بعض الخصائص المفيدة. أخيراً تجدر الإشارة إلى أن نسبة ضئيلة من البشر تمتلك فرط حساسية عاليةً تجاه منتجات النحل بشكل عام، والزعاف بشكل خاص.
|
|
| المراجع References |
1-Talan D.A. et al.
Antibacterial activity of crotalid venoms against oral snake flora and other clinical bacteria.
J. Infect. Dis. 164, 195-198, 1991.
2-Moerman L. et al.
Antibacterial and antifungal properties of ?-helical, cationic peptides in the venom of scorpions from southern Africa.
European Journal of Biochemistry 269, 4799-4810, 2002.
3-Stocker J.F. and Traynor J.
The action of various venoms on Escherichia coli.
J. Appl. Microbiol. 61, 383-388, 1986.
4-Kim H.W. et al.
Original Articles: General pharmacological profiles of bee venom and its water soluble fractions in rodent models.
Korean Journal of Veterinary Research 5, 309-318, 2004.
5-Moreau S.J.M.
It stings a bit but it cleans well" : Venoms of Hymenoptera and their antimicrobial potential.
J. Insect Physiol. 59, 186-204, 2013.
6-Beck B.F.
in The Bible of Bee Venom Therapy Silver Spring, MD: Health Resources Press, 1997.
7-Beck B.F.
In Bee Venom Therapy: Bee Venom, Its Nature and Its Effect on Arthritic and Rheumatoid Conditions (Appleton-Century-Crofts, 1935.
8-Varanda E.A; Monti R. and Tavares D.C.
Inhibitory effect of propolis and bee venom on the mutagenicity of some direct and indirect acting mutagens. Teratog; Carcinog. Mutagen. 19, 403-413, 1999.
9-Cherniack E.P.
Bugs as drugs, Part 1: Insects: the" new" alternative medicine for the 21st century.
Altern. Med. Rev. 15, 124-135, 2010.
10-Alqutub A.N; Masoodi I; Alsayari, K. and Alomair A.
Bee sting therapy-induced hepatotoxicity: A case report.
World journal of hepatology 3, 268, 2011.
11-Son D.J. et al.
Therapeutic application of anti-arthritis, pain-releasing, and anti-cancer effects of bee venom and its constituent compounds.
Pharmacol. Ther. 115, 246-270, 2007.
12-Langer J.
Ueber das Gift unserer Honigbiene.
Naunyn Schmiedebergs Arch. Pharmacol. 38, 381-396, 1897.
13-Sumikura H; Andersen O.K; Drewes A.M. and Arendt-Nielsen L.A.
Comparison of hyperalgesia and neurogenic inflammation induced by melittin and capsaicin in humans.
Neurosci. Lett. 337, 147-150, 2003.
14-Krell R.
in Value-added products from beekeeping (Food and Agriculture Org, 1996.
15-Snodgrass R.E.
in Anatomy of the honey bee (Cornell University Press, 1984.
16-Kerr W.E. and de Lello E.
Sting glands in stingless bees: A vestigial character (Hymenoptera: Apidae.
J.N.Y. Entomol. Soc; 190-214, 1962.
17-de Lello E.
Adnexal glands of the sting apparatus of bees: Anatomy and histology, I (Hymenoptera: Colletidae and Andrenidae).
J. Kans. Entomol. Soc; 5-13, 1971.
18-Vasily N. and Krylov O.
Physiologycail aspects of the technology of bee venom industrial production.
Mellifera 3, 62-66, 2003.
19-Zhou J. et al.
Quantification of melittin and apamin in bee venom lyophilized powder from< i> Apis mellifera by liquid chromatography–diode array detector–tandem mass spectrometry.
Anal. Biochem. 404, 171-178, 2010.
20-Kruger N.J.
The Bradford method for protein quantitation.
The protein protocols handbook, 15-21, 2002.
21-Guide P. P.
Tips and Techniques.
Promega Corporation, Madison, WI, USA, 55-66, 1993.
22-Wiegand I; Hilpert K. and Hancock, R.E.W.
Agar and broth dilution methods to determine the minimal inhibitory concentration (MIC) of antimicrobial substances.
Nature protocols 3, 163-175, 2008.
23-Pankey G. and Sabath L.
Clinical relevance of bacteriostatic versus bactericidal mechanisms of action in the treatment of Gram-positive bacterial infections.
Clinical infectious diseases, 38, 864-870, 2004.
24-Mims C.A; Playfair J.H.L; Roitt I.M;
Wakelin D. and Williams R.
in Medical microbiology; Mosby Europe Limited, 1993.
25-Andrews J. M.
Determination of minimum inhibitory concentrations.
J. Antimicrob. Chemother. 48, 5-16, 2001.
26-Handbook Q.P.P.
Qiagen Inc. 8, 66-67, 2003.
27-Han S.M. et al.
Antibacterial Activity of the Honey Bee Venom against Bacterial Mastitis Pathogens Infecting Dairy Cows.
International Journal of Industrial Entomology, 14, 2007.
28-Fennell J.F; Shipman W.H. and Cole L.J.
Antibacterial action of a bee venom fraction (melittin) against a penicillin-resistant staphylococcus and other microorganisms, 1967.
29-Han S. et al.
Studies on the Antimicorbial Effect of Collected Bee Venom Using Electric Shock Method (?).
Korean Journal of Apiculture 20, 2005.
30-Han S. et al.
Postantibiotic effect of purified melittin from honeybee (Apis mellifera) venom against Escherichia coli and Staphylococcus aureus.
J. Asian Nat. Prod. Res. 11, 796-804 2009.
31-Kim S.T. et al.
The Minimum Inhibitory Concentration (MIC) of Bee Venom Against Bacteria Isolated from Pigs and Chickens.
Korean J Vet Serv; 29, 19-26, 2006.
32-Attalla K.M; Owayss A.A. and Mohanny K.M.
Antibacterial activities of bee venom, propolis and royal jelly produce by three honey bee, Apis mellifera L; hybrids reared in the same environmental conditions.
Annals of Agric.Sci.Moshtohor 45, 895-902, 2007.
33-Surendra N; Jayaram G. and Reddy M.
Antimicrobial activity of crude venom extracts in honeybees (Apis cerana, Apis dorsata, Apis florea) tested against selected pathogens.
African Journal of Microbiology Research 5, 2765-2772, 2011.
34-Aliwarga Y; Hume E.B.H; Lan J. and Willcox M.D.P.
Antimicrobial peptides: a potential role in ocular therapy.
Clin. Experiment. Ophthalmol. 29, 157-160, 2001.
35-Barceloux D.
Medical toxicology of natural substances.
Hoboken: John Wiley & Sons, 773-783, 2008.
36-Perumal Samy R. et al.
Antibacterial activity of snake, scorpion and bee venoms: a comparison with purified venom phospholipase A2 enzymes.
J. Appl. Microbiol. 102, 650-659, 2007.
37-Argiolas A. and Pisano J.J.
Facilitation of phospholipase A2 activity by mastoparans, a new class of mast cell degranulating peptides from wasp venom.
J. Biol. Chem. 258, 13697-13702, 1983.
38-Palma M.S.
Insect venom peptides.
The handbook of biologically active peptides 56, 409-416, 2006.
39-Yang L; Harroun T.A; Weiss T.M; Ding L. and Huang H.W.
Barrel-stave model or toroidal model? A case study on melittin pores.
Biophys. J; 81, 1475-1485, 2001.
40-Fennell J.F; Shipman W.H. and Cole L.J.
Antibacterial action of melittin, a polypeptide from bee venom (Proceedings of the Society for Experimental Biology and Medicine. Society for Experimental Biology and Medicine (New York, NY, Ser. 127, Royal Society of Medicine, 1968).
41-Epand R.F; Schmitt M.A; Gellman S.H. and Epand R.M.
Role of membrane lipids in the mechanism of bacterial species selective toxicity by two ?/?-antimicrobial peptides.
Biochimica et Biophysica Acta (BBA)-Biomembranes 1758, 1343-1350, 2006.
42-Epand R.M; Epand R.F. and Wang G.
Biophysical analysis of membrane-targeting antimicrobial peptides: membrane properties and the design of peptides specifically targeting Gram-negative bacteria.
Antimicrobial peptides: discovery, design and novel therapeutic strategies, 116-127, 2010.
|
| |
| المجلد 7 ,
العدد 1
, ذو القعدة 1434 - تشرين أول (أكتوبر) 2013 |
|
|
|
