| الملخص Abstract |
| يستدعي الانتشار السريع في الآونة الأخيرة لداءُ اللِّيشْمانِيَّاتِ الجِلْديّ في العالم القديم، بما فيها سورية، وتعقيداته السريرية، ضرورة استقصاء وبائية وتطور الطفيلي. ويعاني تقييم بنية الجماعات بطريقة الرَحَلاَنٌ الكَهْرَبِيّ للإنزيمات متعددة المواضع (MLEE)، والتي لا تزال تعد المعيار الذهبي في التصنيف، من عدة عيوب، منها انخفاض قدرتها التمييزية على مستوى تحت النوع، واستهلاكها لوقت وجهد مخبري كبير، ويمكن انجازها فقط في مختبرات تخصصية. وفي هذه الدراسة، استبدل MLEE بتطبيق طريقة PCR-RFLP للمجال المنتسخ الداخلي 1 (ITS1) لتعيين هوية اللَيشمانِيَّة على مستوى الأنواع، لـ 37 عينة أُخذت من مراجعي مستشفى الأمراض الجلدية والزهرية بدمشق، 19 منهم من محافظة حلب و18 من محافظة دمشق. دُرست هذه العينات بتنميط السواتل الصغرية متعددة المواضع (MLMT) بعد أمثلته واختبار المشرعات. وجرى اختبار 17 مشرعاً لتعيين هوية رعيل مواضع السواتل الصغرية التي تكون متعددة الأشكال ضمن أنواع الليشمانية. أظهرت نتائجنا أن العينات جميعها كانت من نوع الليشمانية المدارية. واكتشف 26 نمطاً جينياً، منها 20 نمطاً فريداً للسلالات الفردية و6 مشتركة في أكثر من عينة. أظهرت نتائجنا أيضاً أنه كان هنالك دفق جيني واضح وتمايز جيني معتدل بين مجتمعي حلب ودمشق. وكاستنتاج فإن MLMT تبدي قدرة تمييزية عالية ويبدو حالياً أنها المرشح الأفضل لتصبح المعيار الذهبي للتفريق بين السلالات. |
| The current rapid spread of cutaneous leishmaniases in the Old World including Syria and the complexity of its clinical spectrum call for this parasite’s epidemiological and evolutionary investigation. Evaluation of its population structure by multilocus enzyme electrophoresis (MLEE), current gold standard for classification, has some drawbacks, such as the lack of discriminatory power below species level, its labour intensive and time-consuming, and it can only be performed in specialized laboratories. In this study, MLEE has been replaced by applying PCR-RFLP of the internal transcribed spacer (ITS1) for identification of leishmania at species level, on 37 samples were obtained from patients with suspected CL referred to Damascus Dermatology hospital, 19 of them from Aleppo and 18 from Damascus. These samples were further studied by multilocus microsatellite typing (MLMT) after it was optimization and primers testing. Seventeen primer pairs were tested to identify panel of microsatellite loci that are polymorphic within leishmania species. Our results showed that all samples were L. tropica. 26 genotypes were detected, of which 20 were unique to individual strains and 6 were shared by more than sample. Results also showed that there was a moderate genetic differentiation and a clear genetic flow between Aleppo and Damascus. In conclusion MLMT exhibits a highly discriminatory power and it currently seems to be the best candidate for becoming the gold standard for strain differentiation. |
| المقدمة Introduction |
يعد داء الليشمانيات مشكلة صحية غزت المجتمعات البشرية منذ أقدم العصور وأصبح الآن من الأمراض المستوطنة في العالم. ينجم هذا الداء عن لدغة بعوضة تعرف بذبابة الرمل، تنتمي إلى جنس الفواصد Phlebotomus في العالم القديم، وجنس Lutzomyia في العالم الجديد، تقوم بنقل طفيليات من شعبة الحيوانات الأوالي protozoa، رتبة ذوات منشأ الحركة Kinetoplastedae، وجنس الليشمانية (1،2) Leishmania. يتظاهر داء الليشمانيات بثلاثة أشكال سريرية هي: الداء الحشوي، الداء الجلدي، الداء الجلدي المخاطي (3). لا يتصف داء الليشمانيات فقط بامتلاكه أشكالاً سريرية متعددة بل يمتلك أيضاً تنوعاً في الوبائيات يعزى إلى الاختلافات في أنواع الليشمانية ونواقلها والمضيف الخازن لها. ولقد سجل مؤخراً تبدل في الوبائيات لداء الليشمانيات في عدة مناطق وبائية من العالم القديم والجديد (4).
يصنف داء الليشمانيات الجلدي من بين الأمراض المستوطنة في سورية التي شهدت ارتفاعا كبيراً في عدد الإصابات، حيث سُجّل أكبر عدد من الإصابات في عام 2011 والذي بلغ 58156 إصابة، مما يستوجب قرع جرس الإنذار، إذ أصبحت سورية في مقدمة دول إقليم شرق المتوسط بتسجيل الإصابات. وبالتالي فنحن بحاجة إلى خلفية تصنيفية واضحة للطفيلي من أجل فهم أوضح لهذه التبدلات الوبائية (5).
ما يزال تحليل الإنزيمات متعددة المواضع يعد المعيار الذهبي في التصنيف على مستوى الأنواع والسلالات، لكن هذه الطريقة تعاني من العديد من السلبيات، فهي مكلفة وتحتاج إلى وقت طويل والكثير من السلالات المرجعية، حيث لا يمكن إنجازه في المخابر البحثية العادية، بل يحتاج إلى مخابر متخصصة مرجعية تمتلك السلالات المرجعية التي تجري المقارنة بها، كما هو الحال مثلاً في مختبر MON في مونبيلية في فرنسا.
كما أن هذه الطريقة تحدد النَّمَطُ الظَّاهِرِي phenotype وليس النَّمَطُ الجينِي genotype، بالإضافة إلى انخفاض قدرتها التمييزية على مستوى السلالات (6). ومن أجل تجاوز مساوئ التنميط بـMLEE ومعظم الطرق الأخرى المستخدمة جرى تطوير الطرق المعتمدة على مواضع السواتل الصغرية microsatellite. وهي طريقة ذات كفاءة عالية في كشف الفروقات الجينية بين السلالات ودراسة وراثيات الجماعات ضمن جنس الليشمانية. حيث تمتاز بقدرة تمييزية عالية high discriminatory power لتوصيف السلالات القريبة جداً من بعضها. كما تمتاز بثباتية وتكرارية عالية للنتائج، حيث نحصل على النتيجة نفسها عند إعادة التحليل عدة مرات، بالإضافة إلى تمتعها بالسيادة المشتركة (7-9).
|
| المواد والطرق Materials and Methods |
أخذت العينات من 37 مريضاً من مراجعي مستشفى الأمراض الجلدية والزهرية بدمشق، 19 من محافظة حلب و18 من محافظة دمشق. ولقد جرى اختيارهم وفقاً لمجموعة من الشروط التي سمحت بالتأكد من إصابتهم بداء الليشمانيات في المناطق التي يعيشون فيها، حيث تم التأكد من عدم مغادرتهم للمنطقة منذ ستة أشهر على الأقل. وبعد أن تم التأكد من إصابتهم بالداء، بإجراء الفحص المباشر، حيث مدت العينة المرتشفة من الآفة الجلدية على صفيحة زجاجية نظيفة وتركت حتى تجف تماماً، ثم ثبتت بالكحول الميثيلي لمدة دقيقة ولونت بملون غيمزا لمدة 5 دقائق، ثم غُسلت بالماء المقطر وتركت حتى تجف تماماً. وفُحصت بالمجهر الضوئي بالعدسة الغاطسة (100 X) بعد وضع قطرة من زيت الأرز.
الزرع
تُزرع العينة في أنابيب حاوية على وسط Novy-Mac Neal Nicolle المؤلف من أغار ودم أرنب منزوع الفيبرين، بدرجة 26 ْC. وبعد نموها تُنقل إلى الوسط السائل RPMI-1640 من أجل تكثير الطفيليات (10). بعد ذلك ينبذ 5 مل من الوسط بسرعة 5000rpm لمدة 5 دقائق، يرمى الطافي وتحفظ الرسابة الحاوية على الطفيليات في الدرجة -80 ْC حتى زمن عزل الـ DNA.
استخلاص الدنا
تُغسل العينة بدارئة فسفاتية ملحية PBS ثلاث مرات، بمقدار 1 مل في كل مرة، من أجل التخلص من آثار وسط الزرع، ثم يُضاف 100 مكرولتر من دارئة TE (مكونة من 10 mM Tris-HCl و1 mM EDTA). ثم يُحرر الدنا من خلايا الليشمانية بوضع المزيج في حمام مائي مدة 15 دقيقة. ثم تُنبذ العينة بسرعة دوران 1200rpm ويؤخذ السائل الطافي. يُعزل الدنا من الطافي بوساطة عتيدة QIA amp Blood Mini Kit، من شركة QIAGEN الألمانية.
|
| تنميط الليشمانية على مستوى النوع بطريقة ITS1-PCR |
جرى تنميط نوع الطفيليات من خلال تضخيم المجال ITS1 باستخدام المشرعات
LITSR
(5’–CTGGATCATTTTCCGATG -3’)
L5. 8S
(5’- TGATACCACTTATCGCACTT-3’)
التي طُلبت من شركة Fermentas، فرع LIFE SCIENCES، ألمانيا، باستخدام 5 مكل دارئة الـ PCR بتركيز 10x، و5 مكل من dNTPs بتركيز 2 ميلي مول، من شركة Fermentas فرع LIFE SCIENCE، ألمانيا، و1.5 مكل من MgCl2 بتركيز 50 ميلي مول، و5 مكل من كل مشرع بتركيز 10 مكرومول، و2 مكل (تحوي 5 وحدات) من Taq polymerase من شركة Euroclone, GENOMIC، ألمانيا. ومن ثم إتمام الحجم إلى 50 مكل بإضافة 21.5 مكل ماء PCR. وجرى التضخيم باستخدام جهاز المدور الحراري من شركة eppendorf، ألمانيا، بإجراء تمسخ أولي بدرجة حرارة 95 ْC لمدة دقيقتين، يليها 42 دورة تتألف كل دورة من تمسخ بدرجة حرارة 95 ْC لمدة 20 ثانية، ثم التحام بدرجة حرارة 53 ْC لمدة 30 ثانية، ثم تَطْويل بدرجة حرارة 72 ْC لمدة دقيقة، يليها تَطْويل نهائي بدرجة حرارة 72 ْC لمدة 6 دقائق. وهُضم ناتج تضخيم المجال ITS1 بإنزيم HaeIII من شركة Fermentas فرع LIFE SCIENCES، ألمانيا، من خلال حضنه مع ناتج التضخيم بالدرجة 37 ْC ليلة كاملة.
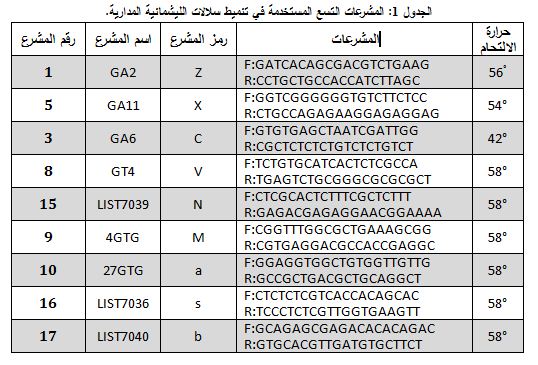
تنميط الليشمانية على مستوى السلالات
اختبر 17 مشرعاً التي جرى شراؤها من شركة Fermentas من أجل انتقاء المشرعات الصالحة لتنميط السلالات المحلية التي جرى جمعها. حيث بلغ حجم محلول تفاعل التضخيم النهائي 50 مكرولتر وهو يحوي 5 مكل دارئة PCR بتركيز 10x، و5 مكل من dNTPs بتركيز 2 ميلي مول من شركة Fermentas فرعLIFE SCIENCE، و3 مكل من MgCl2 بتركيز 50 ميلي مول، و5 مكل من كل مشرع بتركيز 10 مكرومول، و2 مكل (تحوي 5 وحدات منTaq polymerase) من شركة Euroclone, GENOMIC، و5 مكل من الدنا بتركيز 2 نغ/ مكل، ومن ثم إتمام الحجم إلى 50 مكل بإضافة 20 مكل من ماء PCR. وللتضخيم أُجري تمسخ أولي بدرجة حرارة 94°C لمدة 2 دقيقة أعقبه 35 دورة، تتألف كل دورة من تمسخ بدرجة حرارة 94°C لمدة 30 ثانية، ثم مرحلة الالتحام بدرجة حرارة تتبع كل مشرع، ثم تطويل بدرجة حرارة 72°C لمدة دقيقة، ثم مرحلة تطويل نهائي بدرجة حرارة 72°C لمدة 5 دقائق. وأُجري الرحلان الكهربي على هلامة الأكريلاميد 8%.
|
| النتائج Results |
| بينت نتائج التنميط بطريقة RFLP للمجال ITS1 المضخم أن العينات جميعها تنتمي إلى نوع الليشمانية المدارية، حيث أظهرت جميعها العصابتين 60، 190 الوصفيتين للطفيليات من نوع الليشمانية المدارية (الشكل 1).
بعد غربلة 17 مشرعاً حصلنا على 9 مشرعات صالحة لتنميط L.tropica (الجدول 1)، حيث وضعت ولأول مرة طريقة جزيئية لتنميط السلالات المأخوذة من مرضى سوريين. واستبعدت المشرعات التي لم تعط اختلافاً بين العينات أو التي لم تعط أي ناتج تضخيم أو التي أعطت عصابات غير نوعية بشكل كبير. وأظهرت نتائجنا عند تطبيق 9 مشرعات على 37 عينة من الليشمانية المداريةL. tropica وجود 26 نمطاً جينياً genotype مختلفاً (20 نمطاً جينياً خاصاً لكل سلالة و6 أنماط جينية مختلفة. ويوضح الشكلان 2 و3 بعض نماذج تنميط السلالات. |

|
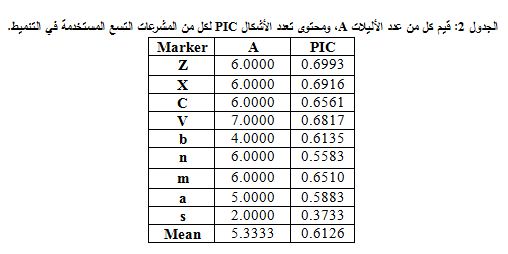
جرى تقييم القدرة التمييزية للمشرعات المستخدمة اعتماداً على كل من عدد الأليلات وقيمة PIC.
تقييم القدرة التمييزية للمشرعات المستخدمة اعتماداً على عدد الأليلات
حُسب عدد الأليلات (Number of alleles (A لكل مشرع، المتوافق مع عدد العصابات المختلفة التي حصلنا عليها نتيجة استخدام كل مشرع من المشرعات لتضخيم دنا العينات المختلفة التي قمنا بدراستها، حيث تساوي قيمة A حاصل جمع الأليلات المختلفة التي أعطاها كل مشرع. ولقد تراوحت بين أليلين للمشرع s وسبعة أليلات للمشرع v، بمتوسط قدره 5.3 لكل موضع.
تقييم القدرة التمييزية للمشرعات المستخدمة اعتماداً على قيمة PIC
يسمح حساب قيمة PIC، محتوى معلومات تعدد الأشكالPolymorphism information content، بالتعبير عن قدرة كل مشرع على كشف التعددية الشكلية ضمن الجماعة. وتتراوح قيمة PIC بين 0-1، حيث تشير القيمة 0 إلى أن المشرع أُحادِيُّ الشَّكْل monomorphic وتشير القيمة 1 إلى أن استخدام المشرع يعطي تَعَدُّدُ الأَشْكال 100%. وتراوحت قيم PIC للمشرعات التي استخدمناها بين 37- 69.9%، بمتوسط قدره 0.612 ويوضح الجدول 2 هذه القيم.
- حساب قرينة التثبيت Fst والتدفق الوراثي Nm
تقيس قرينة التثبيت Fixation index درجة التمايز الجيني genetic differentiation بين تحت المجموعات المدروسة، التي تكون ناتجة عن الانزياح الوراثي genetic drift بين تحت المجموعات والذي يؤدي بدوره إلى انخفاض تَغَايُرُ الزَّيْجُوت في تحت المجموعة subpopulation بالنسبة للمجتمع الكلي.
|
 |
تتراوح قيمة هذه القرينة بين 0-1، حيث تشير القيمة 0 إلى عدم وجود أي تمايز بين تحت المجموعات، وتشير القيمة 1 إلى وجود تمايز كامل بين تحت المجموعات، أي أن تحت المجموعة تملك أليلات ثابتة مختلفة تماماً عن أليلات بقية تحت المجموعات الأخرى. كما تسمح قيم Fst بتحديد قيمة التدفق الوراثي genetic flow أو سرعة الهجرة migration rate والتي يرمز لها بـ Nm (11). وتشير Nm إلى حركة الأفراد بين تحت المجموعات وتحسب من خلال القانون التالي:
Nm = 1-Fst / 4Fst
عندما تكون قيمة Nm=0 فهذا يعني عدم وجود هجرة متبادلة بين تحت المجموعات. أما عندما تكون قيمة Nm>1 فهذا يعني وجود هجرة متبادلة بين تحت المجموعات بمعدل فرد أو أكثر لكل جيل.
بلغ متوسط قيمة Fst من أجل المواضع جميعها المضخمة بالمشرعات التسع لدراسة التمايز الوراثي بين مجتمعي حلب ودمشق 0.1253 (الجدول3 ). وهذا دليل على وجود تمايز وراثي متوسط بين المجتمعين بناء على معايير Wright عام 1977 (11). كما بلغت قيمة Nm 1.8، مما يشير إلى وجود تدفق وراثي واضح بين مجتمعي حلب ودمشق (الجدول 3).
الجدول 3: قيم كل من التمايز الجيني والتدفق الوراثي بين جماعتي حلب ودمشق.
|
| المناقشة Discussion |
أجريت هذه الدراسة على عينات أخذت من مرضى سوريين راجعوا العيادة الجلدية في مستشفى الأمراض الجلدية بدمشق وكانوا من سكان محافظتي حلب ودمشق. واختيرت طريقة التنميط بالسواتل الصغرية لتنميط سلالات الليشمانية المدارية، لكونها تجاوزت مشاكل ومصاعب التنميط بتحليل الإنزيمات متعددة المواضع. فبعد أن جرى اختبار 17 مشرعاً على العينات، انتقيت 9 مشارع استطاعت كشف الفوارق بين السلالات. وحُددت القدرة التمييزية لكل منها بحساب PIC والتي كانت قيمة متوسطه أعلى من 0.5، مما يشير إلى قدرتها التمييزية المرتفعة.
لم تستطع ثمان مشارع تنميط السلالات السابقة. ويمكن أن يعود فشل هذه المشارع في التمييز بين السلالات المحلية إلى متلاكها صفات خاصة بها تجعلها مختلفة عن السلالات المدروسة المدروسة سابقاً التي اعتمدت على هذه المشارع كجزء من المشارع التي استخدمتها في التنميط، أو ربما يعود ذلك إلى عدم ملائمة شروط PCR المستخدمة لتضخيم هذه المواضع. كما أظهرت نتائجنا عند حساب قيمة Fst بين مجموعة حلب ومجموعة دمشق وجود تمايز متوسط بين هاتين المجموعتين ووجود تدفق جيني gene flow بينهما، أي يوجد انتقال للسلالات بين مجموعتي حلب ودمشق. ونستطيع تفسير هذا الأمر بالحركة السكانية العالية بين العاصمتين السياسية (دمشق) والاقتصادية (حلب).
وبالتالي فقد استطاعت دراستنا وضع أول طريقة جزيئية لتنميط السلالات المحلية لليشمانية المدارية بطريقة السواتل الصغرية، حيث أنه من الممكن أن تكون في المستقبل المعيار الذهبي في التفريق بين السلالات (4). إذ يساعد التمييز بين السلالات في الإجابة عن كثير من الأسئلة الوبائية المفتاحية المتعلقة بانتشار داء الليشمانية ومراقبة كيفية تحرك هذه السلالات وإعادة ظهور هذا الداء. والذي يسمح بعد ذلك بوضع استراتيجية مناسبة لمكافحة انتشار هذا الداء والسيطرة على مخازن الطفيلي.
|
| المراجع References |
1-Ul Bari A. and Ber Rahman S.
Cutaneous leishmaniasis: an overview of parasitology and host-parasite-vector inter relationship.
JPAD, 18: 42-48, 2008.
2-Alexender B.
Sampling methods for phlebotomines and flies.
Med Vet Entomol, 14(2): 109-122, 2000.
3-Hepburn N.C.
Cutaneous leishmaniasis.
Clinical and Experimental Dermatology, 25(5): 363-370, 2000.
4-Schonian G. et al.
Molecular approaches for a better understanding of the epideiology and population genetic of leishmania.
Parasitology, 138: 405-425, 2011.
5-Elsheik K. and Eltaweel A.
Epidemiology of Cutaneous leishmaniasis cases in Syria 2011.
Syrian epidemiological bulletin, 6, 2012.
6-Schonian G. et al.
Leishmaniases in the Mediterranean in the era of moleclar epidemiology.
Parasitology, 24(3), 2008.
7-Bulle B. et al.
Practical approach for typing strains of Leishmania infantum by microsatellite analysis.
Clin Microbiol. 40(9): 3391-3397, 2002.
8-Al-Jawabreh A. et al.
Identification of geographically distributed sub-populations of Leishmania (Leishmania) major by microsatellite analysis.
BMC Evol Biol. 24(8): 183, 2008.
9-Ochsenreither S. et al.
Multilocus microsatellite typing as a new tool for discriminationof Leishmania infantum MON-1 strains.
Clin Microbiol, 44(2): 495-503, 2006.
10-Schuster F.L. and Sullivan J.J.
Cultivation of Clinically Significant Hemoflagellates.
Clin Microbiol Rev. 15(3): 374-389, 2002.
11-Shane’s Simple Guide to F-statistics
www.library.auckland.ac.nz/subjects/bio/pdfs/733Pop-g-stats2.
|
| |
| |
