| المجلد 7 ,
العدد 2
, ربيع الأول 1435 - كانون الثاني (يناير) 2014 |
| |
| تعيين المستويات البلازمية لبعض الواصمات الالتهابية لدى مرضى فشل القلب |
| Plasma Levels of Some Inflammation Markers
in Heart Failure Patients
|
| د. منى خيتي وأ.د. فايزة القبيلي |
| Khaity M. and AL-Quobaili F. |
كلية الصيدلة، جامعة دمشق
Faculty of Pharmacy, Damascus University.
|
| الملخص Abstract |
الخلفية: يبدو أن عملية الالتهاب المستمرة، المتضمنة لمستويات زائدة من السيتوكينات الالتهابية والغالكتين-3، تلعب دوراً إمراضياً في فشل القلب (HF)، من خلال التأثير على قلوصية القلب وتحريض فرط الضخامة والاستماتة والمساهمة في إعادة هيكلة العضلة القلبية.
الهدف: هدفت هذه الدراسة إلى استقصاء العلاقة بين المستويات الدورانية لبعض السيتوكينات (عامِلُ نَخَرِ الوَرَم TNF-&alpha والانترلوكين 6) وواصم التليف الغالكتين-3 لدى مرضى فشل القلب.
المواد والطرق: شملت الدراسة 122 مريض فشل قلب و22 من الشواهد الأسوياء. جرى تقسيم مرضى فشل القلب إلى مجموعتين: مجموعة فشل القلب المعتدل mild HF (شملت 40 مريضاً) ومجموعة فشل القلب الوخيم severe HF (شملت 82 مريضاً). قيست المستويات البلازمية للسيتوكينين الالتهابيين (IL-6 وTNF-&alpha) وللغالكتين-3 بمقايسة الممتز المناعي المرتبط بالإنزيم ELISA.
النتائج: كانت تراكيز السيتوكينات الالتهابية (IL-6 وTNF-&alpha) أعلى بشكل يعتد به لدى مرضى الفشل القلبي منها لدى الشواهد الأسوياء، وكانت أيضاً تراكيز الغالكتين-3 أعلى بشكل يعتد به لدى مرضى الفشل القلبي منها لدى مجموعة الشاهد. وتزايدت تراكيز الغالكتين-3 بشكل متوافق مع وخامة الفشل القلبي. وجدنا ارتباطاً بين تراكيز IL-6 وتراكيز الغالكتين-3 (R = 0.16، P =0.0001). ووجدنا أيضاً ارتباطاً يُعتد به بين تراكيز TNF-&alpha وتراكيز Galectin-3 (R = 0.09، P =0.00011).
الاستنتاج: أظهرت نتائجنا ارتفاعاً ملحوظاً في مستويات الواصمات الالتهابية IL-6 وTNF-&alpha والغالكتين-3 لدى مرضى فشل القلب. كما وجدت هذه الدراسة ارتباطاً يُعتد به بين السيتوكينين الالتهابيين ومستويات الغالكتين-3، مما يقترح دور العملية الالتهابية في إمراضية تَلَيُّفُ عَضَلَةِ القَلْب.
|
Background: Persistent inflammation, involving increased levels of inflammatory cytokines and Galectin-3, seems to play a pathogenic role in heart failure (HF), by influencing heart contractility, inducing hypertrophy and promoting apoptosis, contributing to myocardial remodeling.
Aim: This study aimed to investigate the relationship between circulating levels of some cytokines (tumor necrosis factor-α, and interleukin-6) and the fibrosis marker Galectin-3 in patients with HF.
Materials and methods: The study included 122 HF patients and 22 normal controls. HF patients were divided into two groups: mild HF (n=40 patients) and severe HF (n=82 patients). Plasma cytokine levels (TNF-α, IL-6) and Galectin-3 levels were measured by ELISA.
Results: Concentrations of inflammatory cytokines (IL-6 and TNF-α) were significantly higher in heart failure patients than in normal controls, with Galectin-3 concentrations also significantly higher in heart failure patients than control group. Increased Galectin-3 concentrations were compatible with severity of heart failure. A significant correlation was found between IL-6 and Galectin-3 concentrations (r = 0.16; P = 0.0001), and also significant correlation was found between TNF-α and Galectin-3 (r = 0.09; P = 0.00011).
Conclusion: Our results show that Inflammation Markers: IL-6, TNF-α, and Galectin-3 levels were markedly elevated in patients with HF. This study found that inflammatory cytokines levels significantly correlate with galectin-3 levels, which suggests the role of the inflammatory process in the pathogenesis of myocardial fibrosis.
|
| المقدمة Introduction |
| فشل القلب هو متلازمة سريرية ناجمة عن شذوذات في بنية أو عمل القلب، وهي مسؤولة عن عدم قدرة القلب على قذف الدم أو الامتلاء به بمعدل يتلاءم مع المتطلبات الاستقلابية للنسج (1). أشارت إحدى الدراسات أن هنالك في الولايات المتحدة أكثر من 5.2 مليون حالة فشل قلب (2.6 مليون نساء و2.6 مليون رجال) وفي أوروبا 6.5 مليون حالة فشل قلب (2). كما أشارت إحدى الدراسات إلى أنه يجري كل عام تشخيص 550 ألف حالة جديدة في الولايات المتحدة لوحدها. ويموت حوالي 300 ألف مريض كل عام جراء فشل القلب (3). وقُدرت الكلفة المباشرة وغير المباشرة لفشل القلب في الولايات المتحدة عام 2010 بأكثر من 39 مليار دولار (4). يتقدم فشل القلب بشكل مستقل بعد الإساءة البدئية لعضلة القلب، مترافقاً مع خلل أداء بطيني وإعادة هيكلة قلبية، حيث تحدث إعادة الهيكلة كآلية معاوضة تقود في النهاية الى خلل أداء البطين الايسر ومن ثم فشل قلب (5). تلعب العديد من الآليات الى جانب الشد الممارس على الخلايا العضلية القلبية دوراً مهماً في فشل القلب، مثل العملية الالتهابية، حيث ربطت العديد من الأدلة بين تفعيل كل من البلاعم والأرومات الليفية وإمراضية فشل القلب. ويعد الغالكتين-3 من أهم الوسائط المُرشحة للعب هذا الدور (6).
الغالكتين-3 هو لكتين ذواب رابط للـ β غالاكتوزيد (7) يتراوح وزنه بين 29 و35 كيلو دالتون. يتكون هذا البروتين من سلسلة عديد ببتيد وحيدة تشكل ميدانين بنيوين مميزين، ميدان على النهاية الأمينية N-terminal domain (ND) وميدان التعرف على الكربوهيدرات على النهاية الكربوكسيليةcarbohydrate-recognition domain (CRD) C-terminal (8).
يُرمز للغالكتين-3 في الجينوم البشري بجين وحيدة (8) (LGALS3)lectin, galactoside binding, soluble 3، تتوضع على الذراع الطويل للصبغي 14، في الشريط band14q 21–q22 (9) طولها ~17 kb(kilobases) (8)، وتتكون من 6 إكسونات و5 إنترونات (8، 10).
بشكل عام يمكن شرح دور الغالكتين-3 في إعادة الهيكلة القلبية كما يلي: يترافق الالتهاب في الأمراض القلبية مع تفعيل وارتشاح البلاعم. وتُحرر البلاعم المُفعلة العديد من الوسائط الالتهابية وعوامل النمو ومن ضمنها الغالكتين-3، والإنترلوكين-1، وTGF-α، وTNF-α (11). يتعرف الغالكتين-3 على المواقع الرابطة له والمتوضعة على الأرومات الليفية والمطارس خارج الخلوية (6). ويساهم في عملية التليف من خلال تفعيل الأرومات الليفية الساكنة إلى أرومات ليفية منتجة للمطارس (12). ويتميز تفعيل الأرومات الليفية بازدياد التعبير عن بعض البروتينات داخل وفي محيط الأرومات الليفية (13)، حيث يزداد التعبير عن البروتين الهيكلي الخلوي β-SMA (alpha- Smooth muscle actin) وهو واصم داخل خلوي للتليف، كما يزداد التعبير عن السلسة α من الكولاجين نمط 1 (COL1A1) وهو واصم خارج خلوي للتليف.
والغالكتين-3 لا يؤثر فقط على اصطناع مكونات مطارس جديدة، مثل النمط الأول من الكولاجين، وإنما يؤثر أيضاً على تدرك مكونات المطارس خارج خلوية عبر مجموعة من إنزيمات البروتيناز Tissue inhibitor metalloproteinases (TIMPs) وmatrix metalloproteinases (MMPs) (12). ويلعب بذلك دوراً مركزياً في التنظيم المعقد لتطور التليف، عبر تنظيم التعبير عن المكونات التليفية للمطارس (مثلβ-SMA و(COL1A1 وتقلٌب turnover المطارس عبر تنظيم ما بين TIMPs و MMPs (13). وتعاكس عملية تقلب المطارس خارج الخلوية الخطوة التي تؤدي الى اصطناع أنماط الكولاجين (6). كما يحرض الغالكتين-3 على تكاثر الأرومات الليفية من خلال زيادة التعبير عن السيكلين cyclin D1 (وهو منظم لدورة الخلية) (14).
السيتوكينات الالتهابية هي عائلة بروتينية متغايرة المنشأ Heterogeneous، تُفرز من البلاعم واللمفاويات والوحيدات والخلايا البطانية (15)، كاستجابة للمحفزات العدوائية والحركية الدموية ونقص الأكسجة والشدة التأكسدية والتفعيل العصبي الهرموني (16)، كما تتحرر هذه السيتوكينات موضعياً ضمن العضلة القلبية كاستجابة لإجهاد جدار البطين (17).
خلال فشل القلب، تهاجر الكريات البيضاء من الدوران الجهازي إلى العضلة القلبية وتقوم بإفراز السيتوكينات الالتهابية، كما أن خلايا العضلة القلبية والأرومات الليفية القلبية تصطنع سيتوكينات نوعية عبر تعديل التعبير الجيني (17). وتلعب السيتوكينات دوراً مهماً في بدء الإصابة القلبية وإعادة الهيكلة البطينية وترقي خلل الداء البطيني (18). قد يكون التفعيل الجهازي للسيتوكينات هو المسؤول عن الدنف القلبيCardiac Cachexia في فشل القلبي الوخيم، وله تأثير على العضلات الهيكلية، حيث يحرض الهزال Wasting وضعف التقلص (17).
|
| المواد والطرق Materials and Methods |
مجموعات الدراسة: شملت الدراسة 122 مريضاً (91 ذكراً و31 أنثى)، تراوحت أعمارهم بين 24-85 عاماً، حيث كان متوسط العمر لديهم ± الانحراف المعياري هو 58±14 عاماً. ولقد جرى توزيعهم إلى مجموعتين، مجموعة فشل القلب المعتدل Mild HF (مرضى NYHA II) (40 مريضاً)، ومجموعة فشل القلب الوخيم Severe HF (مرضى NYHA III ومرضى NYHA IV) (82 مريضاً).
أُخذت عينات مجموعة الدراسة هذه من مرضى جرى تشخيص حالة فشل قلبي لديهم، بالاعتماد على الأعراض السريرية والقصة المرضية ومخطط صدى القلب. ولقد جرى انتقاء مرضى الفشل القلبي الأيسر على وجه الخصوص بصرف النظر عن سببه. واستبعدنا في دراستنا العديد من المرضى الذين يعانون من حالات مرضية تؤثر على المتثابتات المدروسة بشكل كبير، وهي: الأمراض المناعية الذاتية- الذئبة الحمامية- الأورام بأنواعها- الفشل الكلوي- الداء السكري بنمطيه الأول والثاني- الرثية والتهاب المفاصل- الأمراض المناعية الجلدية- العداوى الحادة والمزمنة. وشملت المجموعة الشاهدة 22 شخصاً، (14 ذكراً و 8 إناث)، جرى انتقاؤهم من الأشخاص الأصحاء عند تبرعهم بالدم، مع مراعاة التوافق في المرحلة العمرية مع مجموعات المرضى.
الاعتيان: جُمعت عينات الدم خلال 9 أشهر (من 5
أيار 2010 إلى 20 كانون الثاني 2011) من مرضى الأقسام والمراكز القلبية التابعة لمستشفيات في دمشق، سورية (مستشفى المواساة، مركز جراحة القلب، مستشفى الأسد الجامعي، مركز الباسل لأمراض وجراحة القلب)، حيث بُزل 5 مل من الدم الكامل للمريض ضمن أنبوب حاوٍ على EDTA كمادة مانعة للتخثر، ثم نُبذت العينات لمدة 15 دقيقة بسرعة 1000xg خلال مدة أقصاها 30 دقيقة من بزلها. وزعت البلازما الطافية ضمن أنابيب ايبندورف، ثم حُفظت في الدرجة -80°م إلى حين إجراء المقايسات.
جرت مقايسة الواصمات جميعها باستخدام جهاز ELISA من نمط ABBOTT- tecan- sun rise، حيث قيس الغالكتين-3 باستخدام عتيدة Human Galectin-3 ELISA Kit لشركة BioVendor التشيكية، وجرت مقايسة IL-6 باستخدام عتيدة Human IL-6 ELISA kit لشركة HYCULBIOTECH الهولندية، أما TNF-α فجرت مقايسته باستخدام عتيدةTNF-α human ELISA kit لشركة Demeditec الألمانية.
|
| التحليل الإحصائي Statistical Analysis |
| استخدمنا برنامج Excel 2007 من أجل الدراسة الإحصائية. حُسبت التراكيز من خلال معادلة المنحنى المعياري لسلاسل معياريات المتثابتات المدروسة والتي رُسمت باستخدام برنامج Excel 2007. جرى التعبير عن القيم باستخدام المتوسط الحسابي ± الانحراف المعياري، ثم استخدم معامل ارتباط بيرسون Person لمعرفة شدة الارتباط وجهته بين المتغيرات. كما استخدم اختبار T test لمعرفة ما إذا كان الفارق بين المتغيرات يعتد به إحصائياً (في حال كانت قيم P value أصغر من
0.05)، أم أنه فارق ناتج عن الحظ أو المصادفة (في حال كانت قيم P value أكبر من 0.05).
|
 |
| النتائج Results |
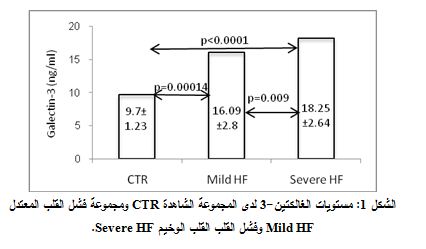
كانت مستويات الغالكتين-3 لدى المجموعة الشاهدة ±9.71.23 نانوغرام/ مل، وجرت مقايسة قيم الغالكتين-3 لدى 122 مريضاً فوُجد أنها تساوي 17.54±2.87 نانوغرام/ مل، حيث كانت مستويات الغالكتين-3 البلازمية لدى مجموعة فشل القلب المعتدل 16.09±2.8 نانوغرام/ مل وكانت 18.25±2.64 نانوغرام/ مل لدى مجموعة فشل القلب الوخيم. ومن ثم جرى تطبيق اختبار T-test لمقارنة المتوسطات بين المجموعات بغية معرفة في ما إذا كان الاختلاف بين هذه المتوسطات اختلافاً جوهرياً ذا دلالة احصائية أم أنه اختلاف عرضي وعشوائي.
لدى تطبيق اختبار T- test للمقارنة بين مجموعتي الدراسة وُجد فارق يعتد به إحصائياً في قيم الغالكتين-3 البلازمية بين المجموعة الشاهدة ومجموعة مرضى الفشل القلبي (P<0.0001). ولدى تطبيق اختبار T- test من أجل مقارنة تراكيز الغالكتين-3 بين المجموعة الشاهدة ومجموعتي مرضى فشل القلب المعتدل والوخيم، وُجد فارق يعتد به إحصائياً بين المجموعة الشاهدة ومجموعتي مرضى الفشل القلبي المعتدل والوخيم، P=0.00014) وP<0.0001، على الترتيب) (الشكل 1). كما وُجد أيضاً فارق يُعتد به إحصائياً بين مجموعة مرضى فشل القلب المعتدل ومجموعة فشل القلب الوخيم P=0.009)) (الشكل 1).
بلغ متوسط مستويات IL-6 ± الانحراف المعياري لدى المجموعة الشاهدة 30.6± بيكوغرام/ مل، وكانت هذه القيم لدى مرضى فشل القلب تساوي 4.93±4.91 بيكوغرام/ مل. ولدى تطبيق اختبار T-test من أجل مقارنة تراكيز IL-6 لكلا المجموعتين، وُجد فارق يعتد به إحصائياً بين المجموعة الشاهدة ومجموعة مرضى الفشل القلبي (P<0.0001). أما متوسط مستويات TNF-α ± الانحراف المعياري فكان 0.4±2.9 بيكوغرام/ مل لدى المجموعة الشاهدة و4.3±1.37 بيكوغرام/مل لدى مرضى فشل القلب.
وبتطبيق اختبار T-test لمقارنة تراكيز IL-6 للمجموعة الشاهدة ومجموعة فشل القلب، وُجد فارق يعتد به إحصائياً بين المجموعة الشـاهـدة ومجموعة مرضى الفشل القلبي (P<0.0001).
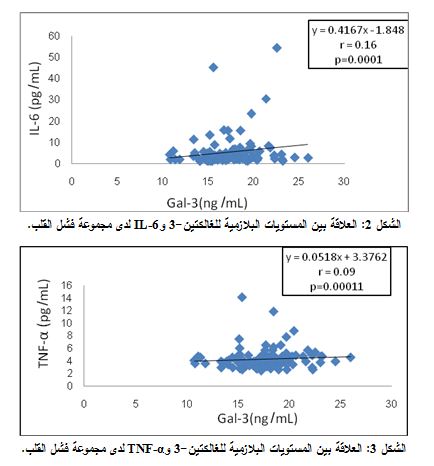
تبين لدى دراسة العلاقة بين مستويات الغالكتين-3 البلازمية ومستويات IL-6 لدى مجموعة مرضى الفشل القلبي، وجود علاقة ارتباط إيجابية طردية (R=0.16). ولقد كانت هذه العلاقة معتداً بها إحصائياً (P=0.0001) (الشكل 2).
كما تبين لدى دراسة العلاقة بين مستويات الغالكتين-3 البلازمية ومستويات TNF-α لدى مجموعة مرضى الفشل القلبي وجود علاقة ارتباط إيجابية طردية (R=0.09). ولقد كانت هذه العلاقة معتداً بها إحصائياً (P=0.00011) (الشكل 3).
|
| المناقشة Discussion |
بيّنت نتائج دراستنا ارتفاع مستويات الغالكتين-3 البلازمية لدى مرضى الفشل القلبي مقارنةً مع المجموعة الشاهدة وذلك بفارق يُعتد به إحصائياً (p<0.0001). كما بينت دراستنا ارتفاع مستويات الغالكتين-3 البلازمية بشكلٍ متوافق مع ازدياد وخامة الفشل القلبي. ويقترح ارتفاع الغالكتين-3 تورطه المباشر في تقدم التليف وإعادة الهيكلة القلبية الضائرة وهما الآليتان الفيزيولوجيتان الإمراضيتان المسؤولتان عن تقدم وتطور الفشل القلبي (7، 19)، حيث تحرره البلاعم القلبية المفعلة (7)، وهو يعزز هجرة البلاعم وتكاثر الأرومات الليفية واصطناع لييفات الكولاجين، كما أنه يُفعل الاستجابة المناعية، التي تلعب دوراً مهماً في تفعيل وتكاثر الأرومات الليفية (5). وتؤدي هذه العمليات المعقدة إلى زيادة سماكة البطين وتمدده وإعادة تشكيلreshaping في جداره، مما يقود إلى فرط ضخامة العضلة القلبية (4). يُسبب الغالكتين-3 خسارة سريعة في العمل القلبي وازدياد اختطار الإدخال إلى المستشفى، فهو يُحرض على تشكيل لُييفات الكولاجين وبالتالي يقلل قدرة القلب على الضخ بشكل طبيعي (20).
توافقت نتائج دراستنا هذه مع العديد من الدراسات العالمية الأخرى، منها دراسة Anand I وزملائه عام 2013 (21)، وكذلك دراسة Toprak G وزملائه في عام 2013 (22)، ودراسة Thor Ueland وزملائه في عام 2011 (23). حيث أظهرت هذه الدراسات جميعها ارتفاع مستويات الغالكتين-3 البلازمية لدى مرضى الفشل القلبي، مقارنة بالمجموعة الشاهدة، كما أظهرت ارتفاع الغالكتين-3 مع ازدياد شدة الفشل القلبي.
تؤدي الحالة الالتهابية لعضلة القلب إلى زيادة مستويات السيتوكينات الالتهابية، التي تلعب دوراً إمراضياً هاماً في الفشل القلبي المزمن، من خلال التأثير على قلوصية العضلة القلبية والتحريض على فرط الضخامة والاستماتة وإعادة الهيكلة في العضلة القلبية (24، 25).
بيّنت نتائج دراستنا تزايد مستويات السيتوكينين الالتهابيين IL-6 وTNF-α لدى مرضى فشل القلب، مقارنة مع الأشخاص الأسوياء. وتوافقت نتائجنا مع نتائج دراسة Anita Deswal وزملائها عام 2001 (26)، ودراسة Christian Stumpf وزملائه عام 2003 (27)، ودراسة Feridun Kosar وزملائه عام 2006 (28)، ومع دراسة Petretta M وزملائه عام 2000 (29).
حيث أبدت هذه الدراسات جميعها تزايد التعبير عن السيتوكينات الالتهابية. كما أثبتت بعض هذه الدراسات (26، 27، 29) ازدياد مستويات مستقبلات السيتوكينات الذوابة في الدوران استجابة لتفعيل عناصر المناعة المتوضعة في القلب أو الدوران أو كليهما عند مرضى الفشل القلبي ودور هذه السيتوكينات الهام في تقييم اختطار الحالة، وهذا ما أثبتته دراسة Kalogeropoulos A. وزملائه في عام 2010 (30) التي شملت 2610 أشخاص مسنين تمت متابعتهم لفترة 9.4 عاماً، حيث تطور لدى 311 منهم فشل قلبي، ووُجد في هذه الدراسة أن زيادة السيتوكينين الالتهابيين TNF-αوIL-6 تتوافق مع ازدياد اختطار الإصابة بفشل القلب.
أظهرت دراستنا وجود علاقة ارتباط يعتد بها إحصائياً بين السيتوكينين الالتهابيين المدروسين (IL-6 وTNF-α) والغالكتين-3 (P=0.0001، P=0.00011، على الترتيب).
لقد توافقت نتائج دراستنا مع دراسة Toprak G. وزملائه عام 2013 (22)، ودراسة Rudolf De. Boer وزملائه في عام 2010 (31). ويفسر ذلك بأن العملية المناعية والالتهابية تلعب دوراً مهماً في القلوب البشرية المعيبة، حيث تعدل السيتوكينات الالتهابية العديد من الآليات القلبية الوعائية، كما تفعل الوحيدات والبلاعم التي تتورط في إمراضية أشكال فشل القلب جميعها. فلقد جرى إثبات أن البلاعم القلبية تتفعل في المراحل المبكرة من القلوب المعرضة للفشل، كما تعبر هذه البلاعم عن الغالكتين-3 (32)، الذي يحرض بدوره على تكاثر الأرومات الليفية القلبية وإنتاج الكولاجين والخلل في الأداء القلبي (6).
أكدت دراستنا دور الحالة الالتهابية في التأثير على وظيفة عضلة القلب، من حيث إحداث التضخم وإعادة الهيكلة القلبية وتليف النسيج القلبي، حيث أثبتت ارتفاع السيتوكينين الالتهابيين IL-6 وTNF-α والغالكتين-3 لدى مرضى فشل القلب مقارنة بالأسوياء، وكان ارتفاع الغالكتين-3 متوافقاً مع ارتفاع هذين السيتوكينين الالتهابيين، مما يؤكد الدور الإمراضي الذي تلعبه العملية الالتهابية في إحداث التليف في عضلة القلب. |
 |
| المراجع References |
1-Braunwald E.
Heart failure and Cor pulmonale in Harrison's Principles of Internal Medicine 19th ed.
McGraw-Hill, 1367-1378, 2005.
2-William Dec G.
Preface in ''Heart Failure a comprehensive guide to diagnosis and treatment''; Marcel Dekker 2005.
3-Dyke D. and Koelling T.
Heart Failure Due to Left Ventricular Systolic Dysfunction in ''Practical Cardiology: Evaluation and Treatment of Common Cardiovascular Disorders 2nd ed.
Lippincott Williams & Wilkins, 247-284, 2008.
4-http://www.galectin-3.com home/ galectin-3 in heart failure/impact of galectin-3 mediated heart failure/; 7 May 2012.
5-Lok D; Van Der Meer P; Bruggink-Andre de la Porte P; Lipsic E; Van Wijngaarden J; Hillege H. and van Veldhuisen D.
Prognostic value of galectin-3, a novel marker of fibrosis, in patients with chronic heart failure: data from the DEAL-HF study.
Clin Res Cardiol, 7, 1-6, 2010.
6-Lin Y; Yu Lin L; Wu Y; Chien K; Lee C; Hsu R; Chao C; Wang S; Hsein Y; Liao L; Ho Y. and Chen M.
The relationship between serum galectin-3 and serum markers of cardiac extracellular matrix turnover in heart failure patients.
Clinica Chimica Acta, 409, 96-99, 2009.
7-Felker M; Fiuzat M; Shaw L; Clare R; Whellan D; Bettari L; Shirolkar S; Donahue M; Kitzman; Zannad F; Pina I.and O'Connor C.
Galectin-3 in Ambulatory Pateints with Heart Failure Results From the HF-ACTION Study.
Circulation heart failure, 5(1), 72-78, 2012.
8-Dumic J; Dabelic S. and Fl?gel M.
Galectin-3: An open-ended story; Biochimica et Biophysica Acta, 1760, 616-635, 2006.
9-Stock M; Scha fer H; Stricker S; Gross G; Mundlos S. and Florian Otto.
Expression of Galectin-3 in Skeletal Tissues Is Controlled by Runx2.
The Journal of biological chemistry 278, 19, 17360-17367, 2003.
10-Krzeslak A. and Lipinska A.
Galectin-3 as a multifunctional protein.
Molecular biology letters, 9, 305-328, 2004.
11-Sharma U; Rhaleb N; Pokharel S; Harding P; Rasoul S; Peng H. and Carretero O.
Novel anti-inflammatory mechanisms of N-Acetyl-Ser-Asp-Lys-Pro in hypertension-induced target organ damage.
Am J Physiol Heart Circ Physiol 294, H1226-H1232, 2008.
12-de Boer R; Voors A; Muntendam P; van Gilst W. and van Veldhuisen D.
Galectin-3: a novel mediator of heart failure development and progression.
European Journal of Heart Failure 11, 811-817, 2009.
13-http://www.galectin-3.net/page-id= 17; 6 May 2012.
14-Sharma U; Pokharel S; van Brakel T; van Berlo J; Cleutjens J; Schroen B; André S; Crijns H; Gabius H; Maessen J. and Pinto Y.
Galectin-3 Marks Activated Macrophages in Failure-Prone Hypertrophied Hearts and Contributes to Cardiac Dysfunction.
Circulation, 110; 3121-3128, 2004.
15-Ganong W. and McPhee S.
Cardiovascular Disorders: Heart Disease in ''Pathophysiology of Disease: An Introduction to Clinical Medicine 5th ed.
McGraw-Hill, 260-299, 2006.
16-de Candia A; Villacorta J?nior H and Mesquita E.
Immune-Inflammatory Activation in Heart Failure.
Arq Bras Cardiol, 89, 3, 183-190, 2007.
17-Kasper E.
Cardiomyopathies and Myocarditis in ''Essential Cardiology principles and practice 2nd ed.
Humana Press, 641-650, 2005.
18-McNamara D.
Neurohormonal and Cytokine Activation in Heart Failure in ''Heart failure a comprehensive guide to diagnosis and treatment.
Marcel Dekker, 117-130, 2005.
19-Christenson R; Duh S; Wu A; Smith A; Abel G; DeFilippi C; Wang S; Adourian A; Adiletto C. and Gardiner P.
Multi-center determination of galectin-3 assay performance characteristics: Anatomy of a novel assay for use in heart failure.
Clinical Biochemistry, 43, 683-690, 2010.
20-http://www.galectin-3.com/galectin-3-a-mediator-in-hf/6 23 May 2012.
21-Anand I; Rector T; Kuskowski M; Adourian A; Muntendam P. and Cohn J.
Baseline and serial measurements of galectin-3 in patients with heart failure: relationship to prognosis and effect of treatment with valsartan in the Val-HeFT.
Eur J Heart Fail, 15 (5), 511-518, 2013.
22-Toprak G; Yuksel H; Demirpence O; Islamoglu Y; Evliyaoglu O. and Mete N.
Fibrosis in heart failure subtypes.
European Review for Medical and Pharmacological Sciences, 17, 2302-2309, 2013.
23-Ueland T; Aukrust P; Broch K; Aakhus S; Skardal R; Muntendam P. and Gullestad L.
Galectin-3 in heart failure: high levels are associated with all-cause mortality.
International Journal of Cardiology 150(3), 361-364, 2011.
24-Aukrust P; Gullestad L; Ueland T; Dam?s J. and Yndestad A.
Inflammatory and anti-inflammatory
cytokines in chronic heart failure: potential therapeutic implication.
Ann Med; 37(2), 74-85, 2005.
25-Wollert K. and Drexler H.
The role of interleukin-6 in the failing heart”; National institutes of health 6(2), 95-103, 2001.
26-Deswal A; Petersen N; Feldman A; Young J; White B. and Mann D.
Cytokines and Cytokine Receptors in Advanced Heart Failure, An Analysis of the Cytokine Database from the Vesnarinone Trial (VEST.
Circulation, 103, 2055-2059, 2001.
27-Stumpf C; Lehner C; Yilmaz A; Daniel W. and Garlichs C.
Decrease of serum levels of the anti-inflammatory cytokine interleukin-10 in patients with advanced chronic heart failure.
Clinical Science, 105, 45-50, 2003.
28-Kosar F; Aksoy Y; Ozguntekin G; Ozerol I. and Varol E.
Relationship between cytokines and tumour markers in patients with chronic heart failure.
Eur J Heart Fail, 8 (3), 270-274, 2006.
29-Petretta M; Condorelli GL; Spinelli L; Scopacasa F; de Caterina M; Leosco D; Vicario ML. and Bonaduce D.
Circulating levels of cytokines and their site of production in patients with mild to severe chronic heart failure.
American Heart Journal, 140 (6), E28, 2000.
30-Kalogeropoulos A; Georgiopoulou G; Psaty B; Rodondi N; Smith A; Harrison D; Liu Y; Hoffmann U; Bauer D; Newman A; Kritchevsky S; Harris T. and Butler G.
Inflammatory Markers and Incident Heart Failure Risk in Older Adults.
The Health ABC, 55, 2129-2137, 2010.
31-De Boer R; Lok D; Jaarsma T; DerMeer P; Voors A; Hillege H. and Van Veldhuisen D.
Predictive value of plasma galectin-3 levels in heart failure with reduced and preserved ejection fraction.
Annals of Medicine, 43, 60-68, 2011.
32-Van Kimmenade R; Januzzi J; Ellinor P; Sharma U; Bakker J; Low A; Martinez A; Crijns H; Macrae C; Menheere P. and Pinto Y.
Utility of Amino-terminal Pro-Brain Natriuretic Peptide, Galectin-3, and Apelin for the Evaluation of Patients With Acute Heart Failure.
Journal of the American College of Cardiology, 48(6), 1217-1224, 2006.
|
| |
| |
| المجلد 7 ,
العدد 2
, ربيع الأول 1435 - كانون الثاني (يناير) 2014 |
|
|
|
