| المجلد 7 ,
العدد 2
, ربيع الأول 1435 - كانون الثاني (يناير) 2014 |
| |
| دراسة مستويات الإيوتاكسين في الداء الرئوي الانسدادي المزمن |
| Levels of Eotaxin in Chronic Obstructive Pulmonary Disease |
| د. محمد عدنان الميداني*، أ.د. عمار الزين، أ.د. خليل القوتلي* |
| Al-Midani A*; Al-Zain A. and AL-Kwatly Kh*. |
*كلية الصيدلة، جامعة دمشق
Faculty of Pharmacy, Damascus University.
|
| الملخص Abstract |
الإيوتاكسين هو كيموكين يتصف بتأثيرات كيميائية جاذبة ومفعلة للحمضات، التي تشارك في التهاب المجرى الهوائي للداء الرئوي الانسدادي المزمن (COPD).
هدفت هذه الدراسة إلى تعيين قيم الأيوتاكسين، كواصم حيوي في التقييم السريري لمرضى COPD، ومقارنة مستوياته مع مستويات IL-8 وCRP.
شملت هذه الدراسة 35 مريضاً بالداء الرئوي الانسدادي المزمن بحالة السورة و30 مريضاً بحالة الهدأة و23 من الشواهد الأسوياء. حيث أجري تعداد الحمضات آلياً وقيس الإيوتاكسين والانترلوكين-8 في المصل بطريقة الممتز المناعي المرتبط بالإنزيم ELISA، كما قيس البروتين المُتَفاعِلُ C في المصل باستخدام الاختبار العكري المناعي.
أظهرت نتائجنا زيادة في المستويات المصلية للإيوتاكسين، IL-8، CRP، النسبة المئوية للحمضات لدى مرضى COPD بحالة السورة ](228.003±479.484 بكغ/مل) (>P0.0001)؛ (76.949±19.268 بكغ/مل) (>P0.0001)؛ (17.819±42.165 ملغ/ل) (>P0.0001)،(3.388% ±2.002) (>P0.0001)، على الترتيب[ مقارنة مع الشواهد الأسوياء.
ارتفعت تراكيز الإيوتاكسين، IL-8، CRP، النسبة المئوية للحمضات لدى مرضى الهدأة لكن بدرجة أقل من ارتفاعها لدى مرضى السورة ](318.295±142.446 بكغ/مل) (>P0.0001)؛ (50.854± 11.029 بكغ/مل) (>P0.001)؛ (15.203±9.462 ملغ/ل) (>P0.0001)، (2.01%±1.506) (
يشير هذا إلى الدور الهام للإيوتاكسين في العملية الالتهابية للمرض وارتباط تراكيزه المصلية بوخامة COPD. لهذا يمكن استخدام الإيوتاكسين كواصم حيوي في التقييم السريري للداء الرئوي الانسدادي المزمن.
|
Introduction: Eotaxin is a chemokine which characterized by eosinophil chemotactic and activating effects, which takes part in airway inflammation in chronic obstructive pulmonary disease (COPD).
This study aimed to determine eotaxin values, as a biomarker in clinical evaluation of COPD patients, and to compare its levels with IL-8 and CRP levels.
This study included 35 patients with exacerbation of COPD, 30 patients with stable COPD, and 23 healthy controls. Automated eosinophil count was done, serum Eotaxin and IL-8 were assessed by ELISA, and serum CRP was assessed by immunoturbidimetric test.
Our results showed an increase in the serum levels of Eotaxin, IL-8, CRP, and Eosinophil percentage in exacerbation COPD patients [(479.484±228.003 pg/mL) (p<0.0001); (76.949±19.268 pg/mL) (p<0.0001); (42.165±17.819 mg/L) (p<0.0001); (3.388%±2.002) (p<0.0001) respectively] compared to healthy controls.
Serum levels of Eotaxin, IL-8, CRP and Eosinophil percentage in stable COPD patients increased – but less than their increase in exacerbation COPD patients – [(318.295±142.446 pg/mL) (p<0.0001); (50.854±11.029 pg/mL) (p<0.0001); (15.203±9.462 mg/L) (p<0.0001); (2.01%±1.506) (p>0.05) respectively] compared to healthy controls.
This indicates the important role of eotaxin in the inflammatory process of the disease, and the association between eotaxin concentrations and COPD severity. Therefore eotaxin could might be used as a biomarker in the clinical evaluation of COPD.
|
| المقدمة Introduction |
يحتل الداء الرئوي الانسدادي المزمن المرتبة الرابعة في الأسباب المؤدية للموت في العالم. وهو مرض يمكن الحد من تطوره ومعالجته بشكل جزئي مع ملاحظة تأثيرات خارج رئوية تشارك في شدة الحالة المرضية. وتُشخَص المظاهر الرئوية للمرض بانسداد الجريان الهوائي انسداداً غير عكوس بشكل كامل يكون مترافقاً عادة مع استجابة التهابية غير طبيعية للرئة تجاه الجزيئات السمية أو الغازات (1).
من العلامات المرضية للداء الرئوي الساد المزمن: تخرب البرانشيم الرئوي (الذي يميز النفاخ) ، التهاب الطرق الهوائية المركزية (الذي يميز التهاب القصبات)، التهاب الطرق الهوائية المحيطية (الذي يميز التهاب القصيبات). ويساهم النفاخ في تقييد المجرى الهوائي بتقليل الارتداد المرن للرئة عبر تخرب البرانشيم الرئوي، وأيضاً بتقليل الحمل الإيلاستيني المطبق على المجرى الهوائي عبر تخريب الاتصالات السنخية. ومن ناحية أخرى يساهم التهاب القصيبات في انسداد الطريق الهوائي بتضييق وطمس اللمعة وتقييد المجرى.
لوحظ أن فرط تنسج الخلايا الكأسية في المرض يرتبط بزيادة عدد العدلات (2)، والإيلاستاز المتحرر من العدلات هو عامل فعال في تنبيه إفراز هذه الخلايا. ووجود العدلات داخل الظهارة يمكن أن يكون حاسماً في تفعيل الوظيفة الإفرازية للخلايا الكأسية. ويحفز دخان السجائر تحرير IL-8، الذي يعمل بشكل رئيسي كجاذب كيميائي للعدلات وعامل تفعيل قوي لها، كما أن له وظائف متعددة في المرض، مما يوجه إلى أن الاختلاف بين مرضى COPD والمدخنين الأسوياء يمكن أن يرتبط بكمية IL-8 المنتجـة والمتحررة من الخلايا الظهارية للطرق الهوائية (3). وتزداد حمضات جدار المجرى الهوائي بدرجة مشابهة لما هي عليه في الربو، مع زيادة مرتبطة بالتعبير عن الإيوتاكسين من قبل الخلايا الظهارية وتحت الظهارية (4). فالإيوتاكسين يُنتج بشكل رئيسي من الخلايا الظهارية والبطانية في الطرق الهوائية، بعد أن تحرضها السيتوكينات الداعمة للالتهاب، التي تتضمن IL-1، IL-4، TNF-α. ويظهر الإيوتاكسين في مصل مرضى COPD وترتفع مستوياته المصلية بانخفاض نسبة FEV1 (5).
يعد الإيوتاكسين الكيموكين السائد في عملية تجنيد الحمضات (6) والتخرب النسيجي المتواسط بالحمضات ـ العدلات، كما أن له دوراً في تنظيم تحرر الحمضات، حيث يحفز تكونها وهو مسؤول عن انتقال سليفة الحمضات من نقي العظم إلى الدوران الدموي. كما أنه يتشارك مع المستويات المرتفعة من MCP-1 ليسببا تزايداً في هجرة الوحيدات إلى الطرق الهوائية، مما يؤدي إلى زيادة البلاعم في النسج المرتبطة بالداء الرئوي الساد المزمن (7).
|
| المواد والطرقMaterials and Methods |
مجموعات الدراسة Study Subjects
شملت الدراسة 88 شخصاً (74 ذكراً و14 أنثى) جرى تقسيمهم إلى المجموعات التالية:
* مجموعة مرضى الداء الرئوي الانسدادي المزمن أثناء السورة: بلغ عددهم 35 مريضاً شُخِّص لهم COPD مسبقاً أو حديثاً من قبل أطباء الداخلية في الشعبة الصدرية والإسعاف في مستشفى المواساة بدمشق. وتراوحت أعمارهم بين 42-81 عاماً (المتوسط 65.37 عاماً).
* مجموعة مرضى الداء الرئوي الانسدادي المزمن في حالة الهدأة: بلغ عددهم 30 مريضاً، وهم مرضى COPD في فترة النقاهة، ما بعد السورة وبهدوء الأعراض السريرية تماماً، أو عند عدم حدوث السورة لديهم لشهرين سابقين على الأقل. وتراوحت أعمارهم من 44-82 عاماً (المتوسط 63.36 عاماً).
* مجموعة الأسوياء: بلغ عددهم 23 شخصاً، أسوياء ظاهرياً لا يعانون أية إصابة التهابية أو ربوية أو تحسسية أو طفيلية، كونها تؤثر على الواصمات المدروسة وكانت أعمارهم موافقة لأعمار المرضى (المتوسط 62.78 عاماً).
الاعتيان Sampling
جُمع 5 مل دم في أنبوب جاف ونُبذت العينة خلال 45 دقيقة كحد أقصى، بسرعة 1200 دورة/ دقيقة، لمدة خمس دقائق وبدرجة حرارة 18Cْ، وحُفظ المصل في أنبوب ايبندورف في الدرجة -80Cْ.
المقايساتAssays
جرت مقايسة الإيوتاكسين باستخدام عتيدة Human Eotaxin ELISA Kit لشركة RayBio® الأمريكية. وهي تسمح بالقياس الكمي للإيوتاكسين البشري في المصل والبلازما وأوساط الزرع الخلوية والبول. وتعتمد مبدأ مقايسة الممتز المناعي المرتبط بالإنزيم بطريقة الشطيرة Sandwich ELISA للتحديد الكمي للإيوتاكسين. كما قيس الإنترلوكين-8 بطريقة تعتمد المبدأ السابق ذاته Sandwich ELISA. وقيس البروتين المتفاعل C بطريقة مقياس العكر المناعي. وجرى تعداد الحمضات آلياً.
التحليل الإحصائي Statistical Analysis
استخدم برنامجا Excel 2007 وSPSS 18 من أجل الدراسة الإحصائية. وجرى التعبير عن القيم باستخدام المتوسط الحسابي ± الانحراف المعياري، كما استخدم معامل ارتباط سبيرمان Spearman لمعرفة شدة الارتباط وجهته ما بين المتغيرات. كما استخدم اختبار T test لمعرفة ما إذا كان الفارق بين المتغيرات يعتد به إحصائياً (في حال كانت قيمة P value أصغر من 0.05) أم انه فارق ناتج عن الحظ أو المصادفة (في حال كانت قيمة P أكبر من 0.05). واعتمدت المساحة تحت منحنى ROC لتحديد القيمة التشخيصية للواصمات المدروسة.
|
| النتائج Results |
تعيين قيم الإيوتاكسين Eotaxin لدى أفراد الدراسة
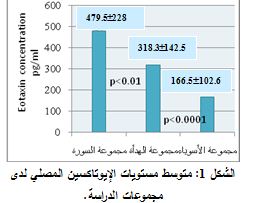
تراوح مجال قيم الإيوتاكسين في المصل لدى مجموعة الأسوياء بين 384.4-56.3 بكغ/ مل، وبلغ المتوسط 166.5 بكغ/ مل ± الانحراف المعياري 102.6 (SD = 102.588) . وتراوح مجال قيم الإيوتاكسين في المصل لدى مجموعة مرضى COPD في حالة الهدأة بين 584.4-104.4 بكغ/ مل، وبلغ المتوسط 318.3 بكغ/ مل ± الانحراف المعياري 142.5 (SD = 142.446). أما مجال قيم الإيوتاكسين المصلي لدى مجموعة مرضى COPD في حالة السورة فتراوح بين 895.6-140.6 بكغ/ مل، وبلغ المتوسط 479.5 بكغ/ مل ± الانحراف المعياري 228 (SD =228.003 ) (الشكل 1).
بتطبيق اختبار T-student وجد فارق يعتد به إحصائياً بين مجموعة السورة ومجموعة الأسوياء (p<0.0001). كما وجد فارق يعتد به إحصائياً بين مجموعة الهدأة ومجموعة الأسوياء (p<0.0001). وكان هناك فارق يعتد به إحصائياً بين مجموعة الهدأة ومجموعة السورة (p<0.01).
حساسية ونوعية الإيوتاكسين المصلي في تقييم حالة المريض (بين حالة السورة والهدأة)
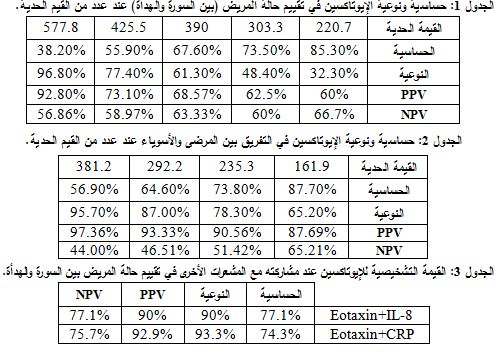
لدى دراسة حساسية ونوعية مستويات الإيوتاكسين المصلي في تقييم حالة المريض بين حالتي السورة والهدأة عند عدد من القيم الحدية Cut-offs، حصلنا على قيم الحساسية والنوعية المبينة في الجدول 1.
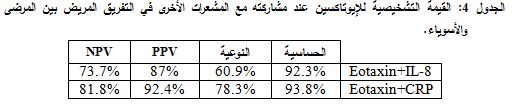
فتبين أنه عند القيمة الحدية pg/ml 577.8 نحصل على نوعية جيدة جداً تبلغ 96.80% لتقييم حالة المريض، حيث تساعد النوعية العالية في الحصول على تفريق جيد بين مرضى السورة ومرضى الهدأة، وبموجبها تكون PPV = 92.80% وNPV = 56.86%. وفي دراستنا يمثل هذا التركيز أفضل قيمة وتمثل القيم الأعلى منها المرضى بحالة السورة. وكانت المساحة تحت المنحنى 0.703 (الشكل 2).
حساسية ونوعية الإيوتاكسين في التفريق بين المرضى والأسوياء.
لدى دراسة حساسية ونوعية مستويات الإيوتاكسين المصلي للتفريق بين المرضى والأسوياء عند عدد من القيم الحدية، حصلنا على القيم المبينة في الجدول 2.
فعند القيمة الحدية 235.3 pg/ml نحصل على حساسية جيدة تبلغ 73.80% لتفريق المرضى عن الأسوياء، حيث تساعد الحساسية العالية في الكشف عن أكبر نسبة من المرضى، ونحصل بموجبها على نوعية 78.3%، PPV 90.56%= و=NPV 51.42%. وتكون التراكيز الأعلى من هذه القيمة ممثلة للحالات المرضية. وبلغت المساحة تحت المنحنى 0.872 (الشكل 3).
حساب القيمة التشخيصية للإيوتاكسين المصلي عند مشاركته مع المشعرات الأخرى في تقييم حالة المريض بين السورة والهدأة.
عند دراسة القيمة التشخيصية للإيوتاكسين المصلي في تقييم حالة المريض بين الهجمة الحادة والهدأة عند قيمته الحدية pg/ml 577.8 بالمشاركة مع IL-8 عند قيمته الحدية pg/ml 64، أو مع CRP عند قيمته الحدية5 mg/l .32. حصلنا على النتائج المدرجة في الجدول 3.
حساب القيمة التشخيصية للإيوتاكسين المصلي عند مشاركته مع المشعرات الأخرى في التفريق بين المرضى والأسوياء.
عند دراسة القيمة التشخيصية للإيوتاكسين المصلي في التفريق بين المرضى والأسوياء عند قيمته الحدية 235.3 pg/ml بالمشاركة مع IL-8 عند قيمته الحدية 44.3 pg/ml، أو مع CRP عند قيمته الحدية mg/l 6.3 حصلنا على النتائج المدرجة في الجدول 4.
دراسة علاقات الارتباط بين إيوتاكسين المصل وباقي الواصمات المدروسة لدى مرضى COPD:
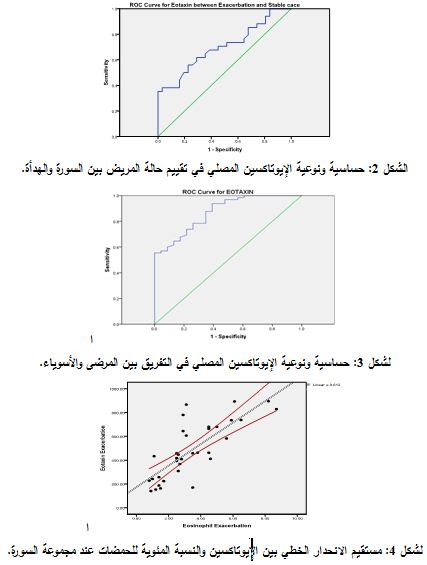
* لوحظ وجود علاقة ارتباط قوية معتد بها إحصائياً، بحسب معامل ارتباط Spearman، بين الإيوتاكسين والنسبة المئوية للحمضات في مجموعة السورة، حيث كانت P <0.0001
وR = 0.779). كما لوحظ وجود علاقة ارتباط يعتد بها إحصائياً، بحسب معامل ارتباط Spearman، بين الإيوتاكسين والنسبة المئوية للحمضات في مجموعة الهدأة، حيث كانت P<0.0001 و R = 0.681 (الشكل 4).
* لوحظ عدم وجود علاقة ارتباط يعتد بها إحصائياً، بحسب معامل ارتباط Spearman بين الإيوتاكسين و IL-8 في مجموعة السورة، حيث كانت (P =0.743>0.05 وR=0.058)، وأيضاً في مجموعة الهدأة (P=0.651>0.05 وR=0.086).
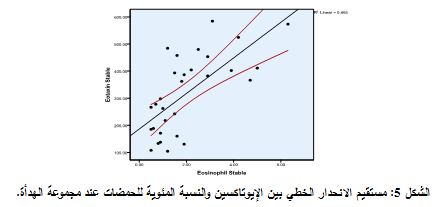
* كذلك لم يكن هنالك ارتباط معتد به إحصائياً، بحسب معامل ارتباط Spearman بين الإيوتاكسين وCRP في مجموعة السورة، حيث كانت (P=0.555>0.05 وR=0.103). وأيضاً في مجموعة الهدأة (P=0.19>0.05 وR=0.246) (الشكل 5).
|
 |
| المناقشة Discussion |
* ارتفاع مستويات الإيوتاكسين المصلية عند مرضى السورة بالمقارنة مع مرضى الهدأة والأسوياء
أظهرت النتائج ارتفاعاً واضحاً في مستويات الإيوتاكسين المصلي لدى مجموعة السورة مقارنة مع مجموعة الهدأة وبفارق إحصائي هام (P=0.0015) ، كما كانت مستويات الإيوتاكسين لدى مجموعـة الهدأة أعلى منها لدى المجموعـة الشاهدة وبفارق إحصائي (P= 9.37×10-5).
يدل هذا التبدل في تراكيز الإيوتاكسين على أن التبدلات في تجمع الحمضات داخل الرئتين قد تكون عاملاً هاماً في التأثير على استقرار المرض، وأن الإيوتاكسين المتحرر من خلايا جدار الطريق الهوائي يفعل مستقبل الكيموكين CCR3 الذي يعبر عنه على الحمضات. وهكذا يجري جذب هذه الخلايا إلى النسيج في الالتهاب الحاصل في حالة السورة (8) وفي حالة الهدأة (9).
توافقت نتائج دراستنا مع عدة دراسات، منها دراسة D'Armiento JM وزملائه (10) عام 2009، التي وجدت أن مستويات الأيوتاكسين لدى مرضى بحالة السورة كانت أعلى وبشكل يعتد به منها لدى الأسوياء (p < 0.02)، وأعلى أيضاً منها لدى المرضى بحالة الهدأة وبصورة يعتد بها إحصائياً (p < 0.05). ولكنها لم تتوافق معها في أن المستويات البلازمية للإيوتاكسين تكون منخفضة لدى مرضى هدأة COPD مقارنة بالأسوياء.وبالمقابل توافقت دراستنا مع دراسة Jahnz-Rozyk K وزملائه (11) عام 2000 والتي شملت 15 مريضاً بالداء الرئوي الانسدادي المزمن بحالة الهدأة، فبلغ متوسط تراكيز الإيوتاكسين المصلي لديهم 286.0±101.4 بكغ/مل و15 من الأسوياء بلغ متوسط تراكيز الإيوتاكسين المصلي لديهم 109.6±56.1 بكغ/مل، وكان الفارق معتد به إحصائياً بين المجموعتين (P<0.0001).
كما كان هنالك توافق مع دراسة Zhu J. وزملائه (12) عام 2001 والتي أثبتت أن هنالك زيادة ملحوظة في الإيوتاكسين عند المدخنين المرضى بالداء الرئوي الانسدادي المزمن بحالة الهدأة مقارنة مع الأسوياء غير المدخنين.
* وجود علاقة ارتباط بين الإيوتاكسين والنسبة المئوية للحمضات عند مرضى COPD
وجدت علاقة ارتباط معتد بها إحصائياً بين الإيوتاكسين والنسبة المئوية للحمضات لدى مرضى COPD بحالة الهدأة (P <0.0001 وR = 0.681) وبحالة السورة (P <0.0001 و R = 0.779).
يفسر هذا الارتباط الآلية الالتهابية بالحمضات التي تحدث لدى مرضى الداء الرئوي الانسدادي المزمن، بتجنيد الإيوتاكسين لهذه الخلايا وجذبها
النوعي من الدوران إلى النسيج الرئوي.
توافقت دراستنا مع دراسة K. Fujimoto وزملائه (13) عام 2005، التي وجدت أن الإيوتاكسين كجاذب كيميائي للحمضات يمكن أن يساهم في العملية الالتهابية بالحمضات لدى مرضى الهدأة، كما أنه يشارك في التفاقم الزائد للالتهاب بالحمضات بحالة السورة الحادة.
- مشاركة قياس مستويات الإيوتاكسين مع قياس مستويات CRP و IL-8
* أظهرت النتائج أنه من الممكن مشاركة قياس مستويات الإيوتاكسين مع قياس مستويات IL-8 للحصول على قيمة تشخيصية أفضل في تقييم حالة المريض بين السورة والهدأة، وذلك عند دراسة القيمة التشخيصية للإيوتاكسين عند قيمته الحدية pg/ml 577.8 بالمشاركة مع IL-8 عند قيمته الحدية pg/ml 64. حيث ترتفع الحساسية إلى %77.1، بعد أن كانت %38.20 للإيوتاكسين و70.60% للـ IL-8، ونحصل على نوعية عالية (90%) تسمح بمعرفة نسبة كبيرة من المرضى بعد تحسن أعراض السورة والدخول في حالة الهدأة.
كما أظهرت النتائج أنه من الممكن مشاركة قياس مستويات الإيوتاكسين مع قياس مستويات IL-8 للحصول على قيمة تشخيصية أفضل في التفريق بين المرضى والأسوياء. وذلك لدى دراسة القيمة التشخيصية للإيوتاكسين عند قيمته الحدية 235.3 pg/ml بالمشاركة مع IL-8 عند قيمته الحدية 44.3 pg/ml. حيث ترتفع حساسية التشخيص إلى %92.3 بعد أن كانت %73.80 للإيوتاكسين و50.81% للإنترلوكين-8، مما يسمح بكشف نسبة كبيرة من المرضى.
أظهرت النتائج أنه من الممكن مشاركة قياس مستويات الإيوتاكسين مع قياس مستويات CRP للحصول على قيمة تشخيصية أفضل في تقييم حالة المريض بين السورة والهدأة، وذلك عند دراسة القيمة التشخيصية للإيوتاكسين المصلي عند قيمته الحدية pg/ml 577.8 بالمشاركة مع CRP عند قيمته الحدية 5 mg/l .32. حيث ارتفعت الحساسية إلى %74.3، بعد أن كانت %38.20 للإيوتاكسين و70.64% للبروتين المتفاعل C، ونحصل بموجبها على نوعية عالية (3.39%).
وأظهرت النتائج أنه من الممكن مشاركة قياس مستويات الإيوتاكسين مع قياس مستويات CRP للحصول على قيمة تشخيصية أفضل في التفريق بين المرضى والأسوياء، وذلك عند دراسة القيمة التشخيصية للإيوتاكسين المصلي عند قيمته الحدية 235.3 pg/ml بالمشاركة مع CRP عند قيمته الحدية mg/l 6.3. حيث ترتفع حساسية التشخيص إلى %93.8 بعد أن كانت %73.80 للإيوتاكسين، وبقيت النوعية على حالها 78.3%. وهذه الحساسية العالية تسمح بكشف نسبة كبيرة من مرضى الداء الرئوي الانسدادي المزمن COPD.
|
| الاستنتاج Conclusion |
| ترتفع مستويات الإيوتاكسين المصلية لدى مرضى الالتهاب الرئوي الانسدادي المزمن بصورة يعتد بها إحصائياً مقارنة بالأسوياء، ويبدي الإيوتاكسين قيمة تشخيصية جيدة في تقييم حالة المريض والتفريق بين المرضى والأسوياء. كما أن مشاركة قياس مستويات الإيوتاكسين المصلية مع مستويات IL-8 أو CRP تزيد القيمة التشخيصية في تقييم حالة المريض وفي التفريق بين المرضى والأسوياء. |
| المراجع References |
1-Global Initiative for Chronic Obstructive Lung Disease. Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease.
www.goldcopd.com. 2007.
2-Saetta M; Turato G; Baraldo S; Zanin A; Braccioni F; Mapp Ce; Maestrelli P; Cavallesco G; Papi A. and Fabbri LM.
Goblet cell hyperplasia and epithelial inflammation in peripheral airways of smokers with both symptoms of chronic bronchitis and airflow limitation.
Am J Respir Crit Care Med., 161: 1016-1021, 2000.
3-Schulz C; Wolf K; Harth M; Kratzel K; Kunz-Schughart L. and Pfeifer M.
Expression and release of interleukin-8 by human bronchial epithelial cells from patients with chronic obstructive pulmonary disease, smokers, and never-smokers.
Respiration, 70: 254-261, 2003.
4-Saha S. and Brightling CE.
Eosinophilic airway inflammation in COPD.
International Journal of COPD., 1(1): 39-47, 2006.
5-Lee JS; Rosengart MR; Kondragunta V; Zhang Y; McMurray J; Branch RA; Choi AM. and Sciurba FC.
Inverse association of plasma IL-13 and inflammatory chemokines with lung function impairment in stable COPD: a cross-sectional cohort study.
Respir. Res 14, 8-64, 2007.
6-Griffiths-Johnson D.A. and Collins P.D.
The chemokine, eotaxin, activates guinea pig eosinophils in vitro and causes accumulation into the lungs in vivo.
Biochem Biophys Res Commun; 197: 1167, 1993.
7-Traves SL. and Donnelly LE.
Chemokines and their Receptors as
Targets for the Treatment of COPD.
Curr Respir Med Rev., 1: 15-32, 2005.
8-Bocchino V. et al.
Eotaxin and CCR3 are up-regulated in exacerbations of chronic bronchitis.
Allergy, 57(1): 17-22, 2002.
9-Brightling CE. et al.
Sputum eosinophilia and short-term response to prednisolone in chronic obstructive pulmonary disease: a randomised controlled trial.
Lancet, 356 (9240): 1480-1485, 2000.
10-D'Armiento JM; Scharf SM; Roth MD; Connett JE; Ghio A; Sternberg D; Goldin JG; Louis TA; Mao JT; O'Connor GT; Ramsdell JW; Ries AL; Schluger NW; Sciurba FC; Skeans MA; Voelker H; Walter RE; Wendt CH; Weinmann GG; Wise RA. and Foronjy RF.
Eosinophil and T cell markers predict functional decline in COPD patients.
Respir. Res., 10:113, 2009.
11-Jahnz-Royzk K; Plusa T. and Mierzejewska J.
Eotaxin in serum of patients with asthma or chronic obstructive pulmonary disease: relationship with eosinophil cationic protein and lung function.
Mediators Inflamm., 9: 175-179, 2000.
12-Zhu J; Qiu YS; Majumdar S; Gamble E; Matin D; Turato G; Fabbri LM; Barnes N; Saetta M. and Jeffery PK.
Exacerbations of Bronchitis: bronchial eosinophilia and gene expression for interleukin-4, interleukin-5, and eosinophil chemoattractants.
Am J Respir Crit Care Med., 164: 109-116, 2001.
13-Fujimoto K; Yasuo M; Urushibata K; Hanaoka M; Koizumi T. and Kubo K.
Airway inflammation during stable and acutely exacerbated chronic obstructive pulmonary disease.
Eur Respir J., 25: 640-646, 2005.
|
| |
| المجلد 7 ,
العدد 2
, ربيع الأول 1435 - كانون الثاني (يناير) 2014 |
|
|
|
