| المجلد 7 ,
العددان 3-4
, رمضان 1435 - تموز (يوليو) 2014 |
| |
| تعيين قيم المستضدM30 المصلية خلال العلاج لدى مرضى سرطان ثدي سوريين |
| Determination the Serum Values of M30 Antigen During Therapy in Syrian Breast Cancer Patients |
| د. باسم بطاح و أ.د. جمانة الصالح |
| Battah B. and Salh J. |
| كلية الصيدلة، جامعة دمشق
Faculty of Pharmacy, Damascus University.
|
| الملخص Abstract |
| يمكن اكتشاف شدف السيتوكيراتين 18 المشطور بفعل الكاسباز (المستضد M30) في دوران مرضى الكارسينوما، ويعتقد بأنها تعكس موت خلايا الأورام ذات الأصل الظهاري. اكتشفت المستضدات M30 المشطورة عند الحمض الأميني ASP396 باستخدام ضد نوعي للحاتمة (الضد M30).
شملت الدراسة 87 شخصاً (45 مريض سرطان ثدي، 21 شواهد أصحاء، 21 شواهد مرضى). قمنا بمراقبة مستويات المستضد M30 لدى 45 مريض سرطان ثدي قبل 24 ساعة من الجرعة الأولى وبعدها، وكذلك بعد أسبوع من الجرعة الثالثة. ولاحظنا أن المرضى الذين كانت زيادة M30 لديهم بين 0 و0.9 ضعف تقدم لديهم المرض أو بقي مستقراً، والمرضى الذين كان الارتفاع لديهم بين 1 و 5 أضعاف استجابوا بشكل جزئي أو كامل للمعالجة الكيميائية، كما لاحظنا أن المرضى الذين لديهم ER(+) أوPR(+) يبدون إنذاراً أفضل، وبالتالي تقترح هذه النتائج أن المستضد M30 المصلي يمكن أن يُستخدم كواصم حيوي للتنبؤ بالاستجابة، بالإضافة إلى مراقبة فعالية المعالجة الكيميائية لدى مرضى سرطان الثدي.
|
Caspase-cleaved cytokeratin 18 fragments (M30 antigen) can be detected in the circulation of patients with carcinoma, and are believed they reflect cell death of tumors of epithelial origin. M30 antigens cleaved at Asp396 are detected using an epitope-specific antibody (M30 antibody).
Our study included 87 subjects (45 of breast cancer patients, 21 of healthy controls and 21 of patient control). We monitored the levels of M30 antigen in 45 breast cancer patient before and after 24 h from the first dose of chemotherapy, and after one week from the third dose. We observed that the patients with increase between 0 and 0.9 fold had progression or stable disease, and the patients with fold increase between 1 and 5 fold had a partial or a complete response to chemotherapy. And we observed that patients with ER(+) or PR(+) have a better prognosis. These results suggest that serum M30 antigen might be used as a biomarker for prediction of response, as well as for monitoring the efficiency of chemotherapy in breast cancer patients.
|
| المقدمة Introduction |
| استخدمت الكيراتينات كواصمات ورمية في تشخيص السرطان منذ أكثر من 20 عاماً (1). والكيراتينات الخلوية هي عائلة من أكثر من 20 بروتيناً خيطياً متوسطاً معبراً عنها في الخلايا ذات الأصل الظهاري والخلايا البطانية (2). وهي تُقسم إلى مجموعتين: مجموعة النمط الثاني CKs1-8 والتي تتألف من بروتينات معتدلة إلى أساسية 53-68 KDa، ومجموعة النمط الأول CKs9-20، والتي تتضمن البروتينات الحامضية ذات الوزن الجزيئي 40-56 KDa. تتركب الكيراتينات الخلوية من معقدات من بروتين من النمط الأول وبروتين من النمط الثاني والتي تصبح منظمة بتركيبات بَلْمَرات polymers خيطية أكبر. الكمية الأكبر من CKs هي 8، 18، 19 والمثال الشائع للبلمر المتغاير هو التوليف من CKs8 وCKs18. يكون نموذج التعبير عن CK بشكل عام ثابتاً حتى خلال الاستحالة الخبيثة، ولذلك يستخدم في علم الأمراض لتمييز كينونات ورمية مختلقة. يتم التعبير عن CK8، CK18، CK19 في معظم أنماط السرطانات، بما فيها سرطانات الثدي، والبروستات، والرئة، والقولون والمبيض. تكون CK18 تحت الظروف الفيزيائية الطبيعية مركبة في خيوط متوسطة للخلايا الظهارية وتبقى بشكل غير ذواب (3). تحتوي الخلايا السرطانية المتكاثرة على CKs ذوابة (CK8، 18 and 19) والتي تزداد مستوياتها عند التعرض للإجهاد (4). تتواجد CKs في الدوران كمعقدات بروتينية كبيرة أو صغيرة أو بشكل شدف بروتينية متدركة جزئياً(5) . تزداد مستويات CKs بشكل ملحوظ لدى المرضى الذين يعانون من خباثات مشتقة من الخلايا الظهارية. حيث تتحرر CKs من الخلايا الورمية المتكاثرة بسرعة أومن الخلايا الميتة (6). تُظهر معظم CKs من النمط الأول مواقع شطر الكاسباز سامحةً بالتحري عن استماتة الخلية عبر تقييم الحواتم المتشكلة الجديدة في عملية تدركها النوعي. خلال التنخر يحدث تحرك CK18 إلى الجميعة الذوابة soluble pool عبر إعادة تشكيل أو تجديد الخيوط المتوسطة Ifs (7). بينما خلال الاستماتة تكون بروتينات الخيوط المتوسطة متضمنة CK18 هدفاً للتخرب أو الانهيار السريع بوساطة الكاسبازات المفعلة 3، 7، 9 لتسهيل تشكيل أجسام الاستماتة (8). يعد السيتوكيراتين 18 عضواً من عائلة بروتينات السيتوكيراتين التي تتواجد في الخلايا الظهارية (9). عندما تتحرض الاستماتة تنشطر Ck18 عند الحمض الأميني أسبارتات المتوضع في الموقعين 238 و396. تُميِّز الأضداد وحيدة النسيلة M30 منتج تخرب الكاسباز Ck18-Asp396 والذي يسمى أيضاً المستضد M30، حيث يجري التعبير عن Ck18 في معظم السرطانات ومن ضمنها سرطانات الثدي، البروستات، الرئة، القولون (10،11). إن التبدلات التي تحدث في الاستماتة وتكاثر الخلايا بتحريض المعالجة ضرورية لتحديد الاستجابة أو مقاومة الورم للعلاج الكيميائي. وبالتالي يفيد الكشف المبكر عن حساسية الورم للعلاج الكيميائي في تيسير العلاج الكيميائي (12). |
| المواد والطرق |
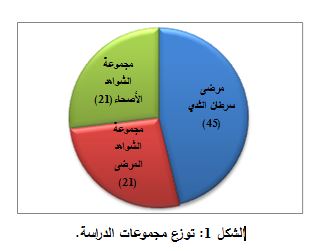
جرت الدراسة على 87 شخصاً، تراوحت أعمارهم
بين 27 و73 عاماً، وزعوا ضمن ثلاث مجموعات:
1- مجموعة مرضى سرطان الثدي.
2- مجموعة الشواهد المرضى.
3- مجموعة الشواهد الأصحاء (الشكل 1).
1- مجموعة مرضى سرطان الثدي
شملت الدراسة 45 مريضاً ومريضة (مريضين ذكور و43 إناثاً) تراوحت أعمارهم مابين 32 و70 عاماً. مشخص لديهم سرطان ثدي من الدرجة الثالثة: نقائلي أو ورم ثدي متقدم موضعياً غير قابل للجراحة، وذلك استناداً إلى نتائج التشريح المرضي والتصوير الشعاعي.
2- مجموعة الشواهد المرضى
شملت 21 مريضة سرطان ثدي تراوحت أعمارهن بين 26 و73 عاماً، خضعن للعلاج الهرموني منذ عام على الأقل، والورم لديهن مستقر نسبياً استناداً إلى نتائج التشريح المرضي.
3- مجموعة الشواهد الأصحاء
شملت 21 شاهداً سليماً من ذكور وإناث تراوحت أعمارهم مابين 28 و59 عاماً.
الاعتيان:
جُمعت كمية 5 مل دم على أنبوب جاف ونُبذت لمدة 10 د بسرعة 0300 دورة/ د، ثم حُفظ المصل بدرجة حرارة -80˚C إلى حين إجراء المقايسة. وجرى العمل في مستشفى البيروني الجامعي على ثلاث مراحل:
المرحلة الأولى: امتدت من 2012/11/15 إلى 2013/4/15، جُمعت العينة الأولى من مرضى سرطان الثدي قبل البدء بالمعالجة الكيميائية، وجُمعت العينة الثانية بعد مدة أقصاها 24 ساعة من المعالجة.
المرحلة الثانية: امتدت من 2013/4/15 إلى 2013/8/20 وتعد هذه المرحلة من العمل متداخلة مع المرحلة السابقة، حيث عمدنا إلى متابعة معالجة كل مريض ومريضة حتى نهايتها، ثمّ جُمعت العينة الثالثة.
المرحلة الثالثة: امتدت من 2013/8/21 إلى 2013/9/10، حيث جرت متابعة كل مريضة بعد إنهاء المعالجة الكيميائية والتحري عن مدى استجابتها للمعالجة، وفقاً للمعطيات الشعاعية والسريرية التي يراها الطبيب المعالج (تصوير طبقي محوري – دراسة الخزعة(. خضع مرضى النقائل والمرضى الذين لديهم ورم متقدم موضعياً إلى المعالجة الكيميائية (Docetaxel 75mg/m2-Doxorubicin 60 mg/m2) بطريقة التسريب الوريدي على ثلاث دورات علاجية بفاصل 21 يوماً بين كل جرعة.
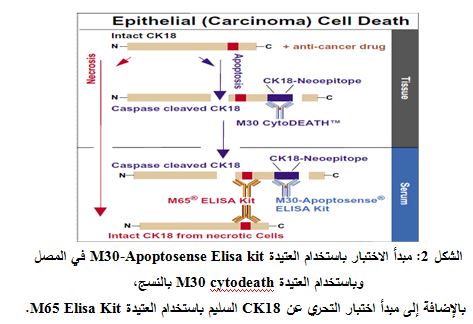
أجريت مقايسة M30 باستخدام العتيدة M30 Apoptosense ELISA من شركة PEVIVA السويدية على مصل المرضى وهذه المقايسة هي مقايسة مناعية إنزيمية من نمط الشطيرة (السندويش Sandwich)، حيث تقيس العتيدةM30 Apoptosense Elisa (الشكل 2) مستويات شدف K18 الذوابة المشطورة بفعل الكاسباز (ccCK18) الحاوية على الحاتمة الجديدة K18Asp396 neo-epitope في المصل.
- اعتمدت قيمة P<0.05 للدلالة الهامة إحصائياً.
|
 |
| النتائج Results |
أظهرت الدراسة وجود علاقة ارتباط قوية مابين تركيز الواصم بعد 24 ساعة من إعطاء الجرعة تلاحظ الزيادات في ccCK18 بعد تحريض الاسـتماتــة أولاً في الخلاصات الخلوية، بينما يحدث تحرر المستضد إلى الحيز خارج الخلوي لاحقا بسبب تنخر الأجسام الاستماتية.
حُسبت النتائج باستخدام الاختبارات الإحصائية التالية:
- اختبار Spearman′s لدراسة علاقات الارتباط.
- اختبار Mann–Whitney للمقارنة بين المتوسطات.
- اختبار كاي مربع لدراسة العلاقة مابين أنماط الاستجابة المشخصة من قبل الطبيب والارتفاعات في الواصم M30 بعد 24 ساعة من إعطاء الجرعة الأولى وبعد أسبوع من الجرعة الثالثة وحالة كل من ER، PR و Her-2.
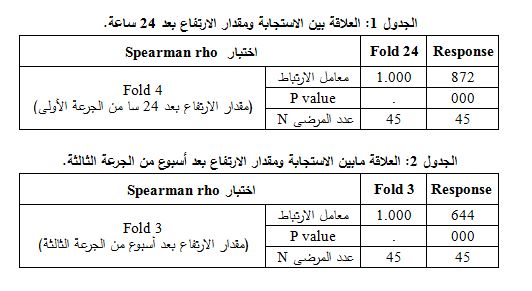
الأولى والاستجابة التشخيصية المقدمة من قبل الطبيب، حيث تم تطبيق اختبار Spearman فكانت قيمة معامل الارتباط r=0.872 وكانت قيمة P المقابلة لها >0010.000 وبالتالي نستطيع القول بأنه يوجد علاقة ارتباط قوية بين مقدار الارتفاع بعد 24 ساعة من الجرعة الأولى والاستجابة التشخيصية المقدمة من الطبيب وذلك بمستوى ثقة 95% (الجدول 1). كما أظهرت وجود علاقة ارتباط بين تركيز الواصم بعد أسبوع من الجرعة الثالثة والاستجابة التشخيصية المقدمة من قبل الطبيب، حيث جرى أيضاً تطبيق اختبار Spearman فكانت قيمة معامل الارتباط r= 0.644 وكانت قيمة P المقابلة لها > 0.000001 وبالتالي نستطيع القول بأنه يوجد علاقة ارتباط بين مقدار الارتفاع بعد أسبوع من الجرعة الثالثة والاستجابة التشخيصية المقدمة من الطبيب وذلك بمستوى ثقة 95% (الجدول 2). وكانت نتائج المرضى كما هو موضح في الجدول 3.
|
|
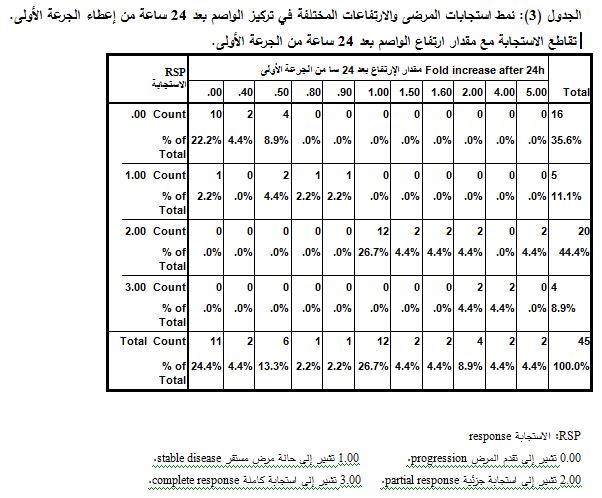
ولاختبار وجود علاقة يُعتد بها إحصائياً بين أنماط الاستجابة والارتفاعات في التراكيز بعد 24 سا من إعطاء الجرعة الأولى جرى تطبيق اختبار كاي مربع، فكانت P< 0.05أي يوجد علاقة يُعتد بها إحصائياً بين أنماط الاستجابة والارتفاعات في التراكيز بعد 24 سا من الجرعة الأولى (fold increase). وبناءً عليه نلاحظ من النتائج في الجدول 3 أن %35.6 من المرضى (16 مريضاً( تطور لديهم المرض دون أي تحسن، وبالنظر إلى مقدار ارتفاع تركيز الواصم M30 بعد 24 سا من إعطاء الجرعة الأولى نلاحظ بأنه لدينا 10 مرضى منهم (22.2% من إجمالي المرضى( لم يحدث لديهم أي ارتفاع في تركيز الواصم M30 بعد 24 ساعة من الجرعة الأولى، أي بقي التركيز نفسه وبالتالي يكون مقدار الارتفاع (0 fold)، وارتفع لدى مريضين منهم (4.4% من إجمالي المرضى) بعد 24 ساعة من الجرعة الأولى بمقدار0.4 fold))، وارتفع لدى 4 مرضى (8.9% من إجمالي المرضى) بعد 24 ساعة من الجرعة الأولى بمقدار ( 0.5 fold)، بينما نلاحظ أيضاً بأنه لدينا %11.1 من المرضى )5 مرضى( بقى المرض لديهم ثابتاً، أي مستقراً ولم يتطور stable disease، ومريض واحد منهم (2.2% من إجمالي المرضى( لم يحصل لديه ارتفاع في تركيز الواصم M30 أي (0 fold)، بينما ارتفع لدى مريضين منهم (4.4% من إجمالي المرضى) بمقدار 0.5 fold وارتفع لدى مريض واحد منهم (2.2% من إجمالي المرضى) بمقدار 0.8 fold وارتفع أيضاً لدى مريض واحد منهم (%2.2) بمقدار 0.9 fold. نلاحظ أيضاً من الجدول 3 أنه لدينا 20 مريضاً (%44.4 من المرضى) أظهروا استجابة جزئية partial response، 12 مريضاً منهم (26.7% من المرضى) ارتفع لديهم الواصم M30 بمقدار 1fold ومريضين منهم (%4.4 من إجمالي المرضى) ارتفع الواصم لديهما بمقدار 1.5 fold ومريضين منهم (%4.4 من إجمالي المرضى) كان الارتفاع لديهما بمقدار 1.6 fold ومريضين منهم (4.4% من إجمالي المرضى) بمقدار 2 fold ومريضين أيضاً (%4.4 من إجمالي المرضى) بمقدار 5 fold بعد 24 ساعة من إعطاء الجرعة الأولى. نلاحظ أيضاً أن %8.9 من المرضى)4 مرضى) أظهروا استجابة كاملة complete response، مريضين منهم (%4.4 من إجمالي المرضى( ارتفع الواصم لديهما بمقدار 2 fold ومريضين أيضاً (4.4% من إجمالي المرضى) ارتفع لديهما بمقدار 4 fold بعد 24 سا من إعطاء الجرعة الأولى.
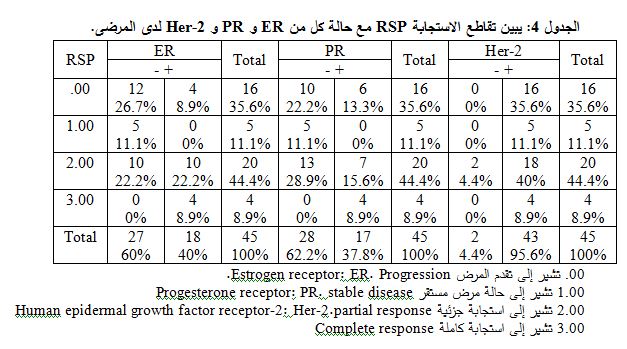
للمقارنة بين تركيز هذا الواصم لدى الشواهد المرضى والشواهد الأصحاء جرى استخدام اختبار Mann-Whitney Test فكانت P= 0.980، أي لا يوجد فارق يُعتد به إحصائياً في تركيز الواصم بين الشواهد المرضى والشواهد الأصحاء. وللمقارنة بين تركيز هذا الواصم لدى الشواهد المرضى والتركيز البدئي قبل البدء بالمعالجة استخدمنا اختبار Mann-Whitney Test، حيث يلاحظ أن قيمة P = 0.630، أي لا يوجد فارق يُعتد به في تركيز الواصم بين الشواهد المرضى والتركيز البدئي قبل البدء بالمعالجة. وللمقارنة أيضاً بين تركيز هذا الواصم لدى الشواهد الأصحاء والتركيز البدئي قبل المعالجة استخدمنا اختبار Mann-Whitney Test فكانت P=0.965، أي لا يوجد فارق يُعتد به في تركيز الواصم بين الشواهد الأصحاء والتركيز البدئي. جرى أيضاً تطبيق اختبار Mann-whiteny للمقارنة بين التركيز البدئي للواصم M30 وتركيزه بعد 24 سا من الجرعة الأولى وتركيزه بعد أسبوع من الجرعة الثالثة، لدى المرضى الذين تطورت لديهم نقائل والمرضى الذين لم تتطور لديهم نقائل، حيث لوحظ أن قيم P 0.05>بالنسبة لكل من تركيز هذا الواصم البدئي وبعد 24 ساعة من المعالجة، أي يوجد فارق يُعتد به. أما عند الجرعة الثالثة فكانت P>0.05، أي لا يوجد فارق يُعتد به، حيث كان متوسط التراكيز البدئية لدى المرضى الذين لم تتطور لديهم نقائل 99.6667 U/L، بينما كان متوسط التراكيز البدئية لدى مرضى النقائل 329.2051 U/L، فهي أعلى بشكل ملحوظ. وكان متوسط تراكيز الواصم بعد 24 سا من الجرعة الأولى لدى المرضى الذين لم تتطور لديهم نقائل 254.0000 U/L، بينما متوسط تراكيز الواصم بعد 24 سا من الجرعة الأولى لدى مرضى النقائل 586.8205 U/L وهي أعلى بشكل ملحوظ. وبلغ متوسط تراكيز الواصم بعد أسبوع من الجرعة الثالثة لدى المرضى الذين لم تتطور لديهم نقائل 194.6667 U/L، بينما كان متوسط تراكيز الواصم بعد أسبوع من الجرعة الثالثة لدى مرضى النقائل 335.9487 U/L وهي أعلى بشكل طفيف. قمنا أيضاً بدراسة العلاقة بين حالة كل من مستقبلات الاستروجين ER ومستقبلات البروجستيرون PR وHer-2 مع أنماط الاستجابة المقدمة من الطبيب وذلك باستخدام اختبار كاي مربع والذي أظهر وجود علاقة يعتد بها إحصائياً بين حالة ER والاستجابة، حيث كانت 0.05>P ، وأيضا وجود علاقة يعتد بها إحصائياً بين حالة PR والاستجابة المقدمة من قبل الطبيب، حيث كانت 0.05>P ، ولدى دراسة العلاقة بين حالة Her-2 والاستجابة كانت P > 0.05 وبالتالي لا توجد علاقة يعتد بها إحصائيا، كما هو مبين في الجدول 4.
|
 |
| المناقشة Discussion |
| نلاحظ من الجدولين 1 و2 انخفاض معامل الارتباط من r= 0.872، بين مقدار الارتفاع (fold increase) بعد 24 ساعة من الجرعة الأولى والاستجابة التشخيصية المقدمة من الطبيب، إلى r = 0.644 بين مقدار الارتفاع بعد أسبوع من الجرعة الثالثة والاستجابة التشخيصية المقدمة من الطبيب. وبالتالي يعد مقدار الارتفاع بعد 24 سا من الجرعة الأولى مؤشراً أفضل من مقدار الارتفاع بعد أسبوع من الجرعة الثالثة ويمكن الاعتماد عليه في استنتاج استجابة المريض للعلاج الكيميائي. وهذا ما دعى إلى التركيز على البحث عن وجود علاقة بين نمط الاستجابة التشخيصية المقدمة من قبل الطبيب (complete – partial – stable – progression) ومقدار الارتفاع بعد 24 سا من الجرعة الأولى كونها المؤشر الأفضل في استنتاج استجابة المريض للعلاج الكيميائي. كما بينت دراستنا بعد تطبيق اختبار كاي مربع وجود علاقة ارتباط قوية بين أنماط الاستجابة المشخصة من قبل الطبيب والارتفاعات في تركيز الواصم M30 بعد 24 سا من إعطاء الجرعة الأولى، حيث كانت P < 0.05. ونستنتج من الجدول 3 أن المرضى الذين حدث لديهم تبدل في تركيز الواصم M30 بعد 24 سا من الجرعة الأولى بمقدار 0 إلى 0.5 ضعف يعد مؤشراً على تطور المرض لدى المريض، حيث يمكن التنبؤ بأن المريض لن يستجيب للمعالجة ويفضل إيقاف نظام المعالجة المستخدم واستبداله بنظام آخر، وبالتالي تجنيب المريض خطر الآثار الجانبية للمعالجة المستخدمة وتوفير كل من الوقت والجهد والكلفة الاقتصادية. نستنتج أيضاً من الجدول 3 أنه بارتفاع تركيز الواصم بعد 24 سا من الجرعة الأولى من 0 إلى 0.9 ضعف يمكن التنبؤ بتقدم المرض progression disease أو بقائه ثابتاً مستقراً stable disease، أي أن المرض إما أن يتطور لدى المريض أو أن المريض لن يستجيب للمعالجة. وهذا يتفق مع ما وجده Ulukaya وزملاؤه عام 2011 في دراسة أجريت على مرضى سرطان ثدي، حيث بينت الدراسة أن الواصم M30 ارتفع بشكل طفيف بعد 24 سا من إعطاء الجرعة الأولى لدى المرضى الذين تقدم لديهم المرض أو بقي مستقراً (13). ونستنتج أيضاً من الجدول 3 أن ارتفاع تركيز الواصم M30 من 1 إلى 5 أضعاف بعد 24 سا من الجرعة الأولى يمكن أن يكون مؤشراً على أن المريض سيبدي استجابة كاملة أو جزئية للمعالجة الكيميائية. وهذا يتفق مع دراسة Ulukaya وزملائه عام 2011 والتي أظهرت أن المرضى الذين ارتفع لديهم الواصم بمقدار 3 أضعاف، بعد 24 سا من الجرعة الأولى، تراجع المرض لديهم. وأظهرت الدراسة ارتفاع تركيز الواصم بشكل ملحوظ بعد 24 سا من إعطاء الجرعة الأولى وبعد أسبوع من إعطاء الجرعة الثالثة، مقارنة مع تركيز الواصم البدئي، وهذا يتفق مع نتائج دراسة Ulukaya وزملائه التي أجريت عام 2007 على مرضى سرطان الرئة(14) وعام 2011 في دراسة أجريت على مرضى سرطان الثدي (13). كما بينت النتائج أن متوسط تراكيز الواصم لدى مرضى النقائل أعلى بشكل ملحوظ من متوسط تراكيز الواصم لدى المرضى الذين لم تتطور لديهم نقائل. ونلاحظ من الجدول 4 أن المرضى جميعهم الذين أظهروا استجابة كاملة كانت لديهم ER(+) وPR(+) ولم نجد أي مريض أبدى استجابة كاملة ولديه ER(-) أو PR(-). وكانت نسبة المرضى الذين لم يستجيبوا للعلاج ولديهم ER(-) أو PR(-) أكبر من نسبة المرضى الذين لم يستجيبوا للعلاج ولديهمER(+) أو PR(+). وبالتالي نستنتج أن المرضى الذين لديهم ER(+) يبدون إنذاراً أفضل من المرضى الذين لديهم ER(-). والمرضى الذين لديهم PR(+) يبدون إنذاراً أفضل من المرضى الذين لديهم PR(-). |
| الاستنتاج Conclusion |
| تبين من خلال دراستنا وجود علاقة ارتباط قوية بين ارتفاع الواصم بعد 24 ساعة من الجرعة الأولى وأنماط الاستجابة المقدمة من قبل الطبيب. ويمكن من خلال تعيين القيم المصلية للواصم M30، بعد 24 ساعة من إعطاء الجرعة الأولى، التنبؤ باستجابة المريض للبروتوكول العلاجي المعطى وبالتالي تبديل المعالجة في حال عدم الاستجابة. |
| المراجع References |
1-Weber K; Osborn M; Moll R; Wiklund B. and Lüning B.
Tissue polypeptideantigen (TPA) is related to the non-epidermal keratins 8, 18 and 19 typical of simple and non-squamous epithelia: reevaluation of a human tumor marker.
EMBO J. 3 (11): 2707-2714,1984.
2-Ekman S; Eriksson P; Bergstrom S; Johansson P; Goike H; Gullbo J; Henriksson R; Larsson A. and Bergqvist M.
Clinical value of using serological cytokeratins as therapeutic markers in
thoracic malignancies.
Anticancer Res., 27(5): 3545-3553, 2007.
3-Fuchs E; and Weber K.
Intermediate filaments structure, dynamics, function, and Disease.
Annual Review of Biochemistry, 63: 345-382, 1994.
4-Schutte B; Henfling M; Kölgen W; Bouman M; Meex S; LeersMP; Nap M; Björklund V; Björklund P; Björklund B; Lane EB; Omary MB; Jörnvall H. and Ramaekers FC.
Keratin 8/18 breakdown and reorganization during apoptosis.
Exp Cell Res., 297(1): 11-26, 2004.
5-Ku NO; Liao J. and Omary MB.
Apoptosis generates stable fragments of human type I keratins.
JBC., 272(52): 33197-33203, 1997.
6-Linder S; Havelka AM; Ueno T. and Shoshan MC.
Determining tumor apoptosis and necrosis in patient serum using cytokeratin 18 as a biomarker.
Cancer Lett., 214 (1): 1-9, 2004.
7-StrnadP; Windoffer R. and Leube RE.
Induction of rapid andreversible cytokeratinfilament network remodeling by inhibition of tyrosine phosphatases.
Journal of Cell Science, 115(21): 4133-4148, 2002.
8-Kramer G; Erdal H; Mertens HJ; Nap M; Mauermann J; Steiner G; Marberger M; Bivén K; Shoshan MC. and Linder S.
Differentiation between cell death modes using measurements of different soluble forms of extracellular cytokeratin.
Cancer Res., 18. 64(5): 1751-1756, 2004
9-Linder S.
Cytokeratin markers come of age.
Tumour Biol., 28:189-95,2007.
10-Ueno T; Toi M; Linder S.
Detection of epithelial cell death in the body by cytokeratin 18 measurement.
Biomed Pharmacother, 59: S359-S362, 2005.
11-Leers MP, Kölgen W, Björklund V, Bergman T, Tribbick G, Persson B, et al.
Immunocytochemical detection and mapping of a cytokeratin 18 neoepitope exposed during early apoptosis.
J Pathol., 187(5): 567-572. 1999.
12-Hamilton G. Cytokeratin 18 (CK18) and Caspase-Cleaved CK18 (ccCK18) as Response Markers in Anticancer Therapy in Cytokeratin-Tools in Oncology, Chapter 8, under CC BY 3.0 license, 139-143, 2012.
13- Ulukaya, E., E. Karaagac, F. Ari, A.Y. Oral, S.B. Adim, A.H. Tokullugil and T. Evrensel. Chemotherapy ıncreases caspase-cleaved cytokeratin 18 in the serum of breast cancer patients.
Radiol. Oncol., 45: 116-122, 2011.
14- Ulukaya, E., A. Yilmaztepe, S. Akgoz, S. Linder and M. Karadag.
The levels of caspase-cleaved cytokeratin 18 are elevated in serum from patients with lung cancer and helpful to predict the survival.
Lung Cancer, 56: 399-404, 2007.
|
| |
| |
| |
| المجلد 7 ,
العددان 3-4
, رمضان 1435 - تموز (يوليو) 2014 |
|
|
|
