| المجلد 7 ,
العددان 3-4
, رمضان 1435 - تموز (يوليو) 2014 |
| |
| تعيين قيم Caspase-3 وCaspase-7 لدى مرضى سرطان ثدي سوريين معالجين |
| Determination the Values of "Caspase-3 and Caspase-7" in Treated Syrian Breast Cancer Patients |
| هيمى حمود وجمانة الصالح
H
|
| Hammoud H. and Saleh J. |
كلية الصيدلة، جامعة دمشق
Faculty of Pharmacy, Damascus University
|
| الملخص Abstract |
يعد Caspase-3 فرداً من عائلة بروتياز السيستئين، والذي يلعب دوراً حاسماً في سبيل الاستماتة عبر إشارات متنوعة محدثة للموت، بما فيها عوامل المعالجة الكيميائية.
الهدف من هذه الدراسة هو تقييم نجاعة الاستجابة السريرية في تقدير المقاومة أو الحساسية تجاه المعالجة الكيميائية بربطه مع معدل ارتفاع Caspase-3، في سرطان الثدي المتقدم، وكذلك قياس المستويات المصلية للـ Caspase-7 للتأكد من تفعيل شلال Caspases.
تضمنت الدراسة 60 مريض/ة قسّموا إلى مجموعتين: مجموعة مرضى سرطان ثدي متقدم مؤلفة من 39 مريض/ة ومجموعة شاهدة ضمت 21 مريضة. قسنا المستويات المصلية لكلّ من Caspase-3 وCaspase-7 قبل البدء بالمعالجة الكيميائية وبعد 24 ساعة من الجرعة الأولى وبعد أسبوع من الجرعة الثالثة. حيث جرى قياس Caspase-3 وCaspase-7 باستخدام عتائد تعتمد على مبدأ المقايسة المناعية المرتبطة بالإنزيم نمط الشطيرة المضاعفة.
أظهرت الدراسة وجود ارتباط قوي ( r=0.846) بين معدل ارتفاع Caspase-3 والاستجابة السريرية النهائية. فكانت هنالك زيادة 0 - 9.0 ضعف وزيادة ≤1 ضعف في مستويات Caspase-3 المصلية، بعد 24 ساعة من الجرعة الأولى، في المرض السريري المترقي أو الثابت وفي الاستجابة السريرية التامة أو الجزئية، على الترتيب.
تقترح الدراسة أنّ Caspase-3 مفيد كواصم جيد للتنبؤ بالمقاومة أو الحساسية تجاه المعالجة الكيميائية.
|
Caspase-3 is a member of Cysteine protease family, which plays a crucial role in apoptosis pathway by diverse death-inducing signals, including the chemotherapeutic agents.
The aim of this study is to evaluate the efficacy of clinical response in assessing the Chemo-sensitivity/ resistance in correlation with caspases-3 fold increase, in advanced breast cancer, and measure of Caspase-7 serum levels to assure the activation of caspase cascade.
The study included 60 patients, divided into two groups: 39 advanced breast cancer patients and 21 were control subjects. We measured the serum levels of Caspase-3 and Caspase-7 prior to chemotherapy, after 24 hours from the 1st cycle and after one week from the 3rd Cycle. Caspase-3 and Caspase-7 were measured by double sandwich ELISA Kits.
The study showed a strong correlation (r=0.846) between caspase-3 fold increase and the final clinical response. There was 0 - 0.9 and ≥ 1 fold increase in Caspase-3 serum levels, after 24 hours from the 1st cycle, in clinical progressive or stable disease and clinical partial or complete response, respectively.
The study suggests that Caspase-3 is useful as a good marker to predict chemosensitivity/resistance.
|
| المقدمة Introduction |
تعد الاستماتة أو الموت الخلوي المبرمج آلية هامة في الخباثات وذلك للسببين التاليين:
الأول: يعد كبح الاستماتة حدث هام في كل من بدء السرطان وترّقيه.
الثاني: تسبب معظم العوامل المضادة للسرطان ذات السمية الخلوية تراجعاً في الورم بشكل جزئي على الأقل، عبر تحفيز حدوث الاستماتة (1، 2). وعلى الرغم من تدخل مورثات عديدة في الاستماتة فإنّ الوسائط الأساسية في هذه الآلية هي Caspases.
إنّ Caspases هي بروتيازات سيستئين نوعية للأسبارتات aspartate-specific cysteine proteases تقوم بتدرك ركائزها من البروتينات من جهة الكربوكسيل لثمالة الأسبارتات (3).
تمّ حتى الآن التعرف على 14 نوعاً من Caspases المختلفة (4، (5، ويمكن تقسيم Caspases، اعتماداً على دورها في عملية الاستماتة، إلى مجموعتين رئيستين:
• المُبْدِئات initiators أو caspases upstream (Caspases 8و9 و10) والتي يجري تفعيلها بوساطة مجموعة متنوعة من إشارات الاستماتة، مما ينجم عنه تفعيل caspases المجموعة الثانية.
• المنَفِذات executioners أو downstream caspases (Caspases 3و6 و7) تقوم بعد تفعيلها بتواسط التدرك النوعي لبروتينات خلوية متعددة والتي تكون مسؤولة عن تبدلات الناحية الشكلية المميزة في عملية الاستماتة (5).
يعد Caspase-3 من مجموعة Caspases executioner (المنَفِذة) الأكثر دراسة، فهو يلعب دوراً رئيسياً في كل من سبيل مستقبلات الموت الذي يجري البدء به مع Caspase-8 وسبيل المتقدرات الذي يتدخل فيه Caspase-9 (6). ولقد أشارت دراسات متعددة إلى أنّ Caspase-3 يلعب دوراً مهماً في الحساسية الخلوية لإحداث الاستماتة استجابة لأدوية المعالجة الكيميائية مثل: Doxorubicine وDtopoisde (7) وcisplatin (8). يكون Caspase-3 بشكل طليعة إنزيم غير فعالة، وزنها 32 كيلودالتون، يجري تدركها عند ثمالة الأسبارتات ليعطي وحيدتين 12 كيلودالتون P12)) و17 كيلودالتون ((P17. وتجتمع وحيدتان P12 ووحيدتان P17 ليتشكل لدينا إنزيم Caspase-3 فعّال، ليقوم Caspase-3 الفعّال بتحطيم سلسلة واسعة من الركائز الخلوية تتضمن: بروتينات بنيوية (مثل Lamins) وإنزيمات إصلاح كسور DNA (PARP: Poly ADP-ribose polymerase-1 وPARG: Poly ADP-riboseglycohydrolase)، كذلك يقوم أيضاً بتفعيل إنزيم ICAD (Inhibitor of caspases-activated DNAse) الذي يسبب تشدّف DNA. ويعد هذا من المظاهر الوصفية للاستماتة (9). أكدت العديد من الدراسات ارتباط Caspase-3 مع معدلات الاستماتة في سرطان الثدي، ولذلك فهو يمكن أن يُعد واصماً كامناً potential marker من أجل التنبؤ بالاستجابة أو مقاومة عوامل المعالجة الكيميائية في سرطان الثدي(1) .
يضم سرطان الثدي المتقدم: سرطان الثدي المتقدم موضعياً Locally advanced breast cancer (LABC) وسرطان الثدي النقائلي Metastatic breast cancer (MBC) (10). والمعالجة النموذجية هي: المعالجة الكيميائية Neoadjuvant therapy والجراحة والمعالجة الإشعاعية (11).
تعد المعالجة الكيميائية المساعدة Neoadjuvant فرصة لإمكانية تقييم المعالجة في الأحياء in vivo وقياس حساسية الورم لعوامل المعالجة الكيميائية وتعديل النظام العلاجي في حال عدم استجابة الورم (10). لذلك أُجريت هذه الدراسة لتقييم التعبير عن Caspase-3 وCaspase-7 وعلاقته بالاستجابة السريرية للمعالجة الكيميائية المطبقة والعمل على ربط هذه الاستجابة مع معدل التبدل الحاصل في تركيز Caspase-3 وأيضاً للتحقق في ما إذا كان من الممكن استخدام Caspase-3 كواصم بديل للتنبؤ بالاستجابة أو بمقاومة المعالجة الكيميائية في وقت مبكر من تطبيق النظام العلاجي. وبالتالي إيقاف المعالجة غير الفعالة مبكراً وتجنيب المريض التعرض غير الضروري للتأثيرات الجانبية الناتجة عن الأدوية. وكذلك جرى ربط نتائج Caspase-3 مع Caspase-7 للتأكد من حدوث تفعيل لشلال الاستماتة بشكل كامل.
|
 |
| مواد وطرق الدراسة Materials and Methods |
مجموعة الدراسة Study
group
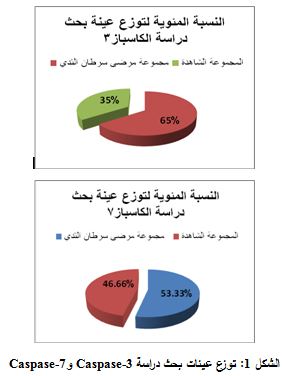
أُجريت دراسة Caspase-3 على 60 مريضاً/ مريضة، تراوحت أعمارهم بين 26-73 عاماً، جرى توزيعهم ضمن
مجموعتين (الشكل 1).
·
مجموعة مرضى سرطان الثدي: مريضان ذكران
و37 أنثى، مشخص لديهم سرطان ثدي متقدم من الدرجة الثالثة: سرطان ثدي نقائلي أو
سرطان ثدي متقدم موضعي غير قابل للجراحة، وذلك استناداً إلى معايير TNM من نتائج التشريح المرضي والتصوير الشعاعي، تراوحت أعمارهم ما بين 31-70 عاماً.
يخضعون للمعالجة الكيميائية التالية:
Docetaxel
75 mg/m2 وDoxorubicine
60mg/m2
يعد
هذا النظام العلاجي خط العلاج الرئيسي لرعاية هؤلاء المرضى، حيث أخذ المعالجة على ثلاث دورات Cycles، بفاصل 21 يوماً بين الدورة والأخرى، يليها تقييم سريري لاستجابة
المرضى للمعالجة من قبل الطبيب المختص، بينما اكتفينا في دراسة Caspase-7 من مجموعة مرضى سرطان الثدي بـ 24 مريضاً: مريض ذكر و23 مريضة من
شريحة مرضى Caspase-3 نفسها.
جُمعت عينات مصل
المرضى من مستشفى البيروني في دمشق، في الفترة الواقعة بين تشرين الثاني 2012 وأيلول 2013 وذلك على
ثلاثة مراحل:
المرحلة الأولى: جُمعت العينة
الأولى قبل البدء بالمعالجة الكيميائية، بينما جُمعت العينة الثانية بعد مدة
أقصاها 24 ساعة من أخذ الجرعة الأولى.
المرحلة الثانية: تعد هذه
المرحلة من العمل متداخلة مع المرحلة السابقة، حيث عمدنا إلى تتبع كل مريض/ة حتى
إنهاء المعالجة الكيميائية، ثمّ جُمعت العينة الثالثة بعد مدة أقصاها أسبوع من أخذ
الجرعة الثالثة.
المرحلة الثالثة: وهي مرحلة متابعة كل مريض/ة بعد إنهاء المعالجة
الكيميائية، والتحري عن مدى الاستجابة للمعالجة وفقاً للمعطيات الشعاعية والسريرية
التي يراها الطبيب المعالج.
·
المجموعة الشاهدة: شملت 21 سيدة تخضعن للعلاج الهرموني منذ عام على الأقل،
والورم مستقر نسبياً لديهن، استناداً إلى نتائج التشريح المرضي. وتراوحت
أعمارهن بين 26-73 عاماً.
يعتمد تصنيف الاستجابة السريرية للعلاج معايير RECIST (Response Evaluation Criteria In Solid Tumors) كما يلي:
الاستجابة الكاملة Complete Response (CR) الاستجابة
الجزئية (Partial Response (PR المرض المترّق Progressive
Disease (PD) المرض الثابت Stable Disease (SD) (12).
جرى التحري وقياس
مستويات Caspase-3 في المصل والبلازما باستخدام عتيدتين من
شركة SunRed الصينية، وكذلك أجريت مقايسة Caspase-7 في المصل
والبلازما باستخدام عتيدة SunRed الصينية،
وتعتمد هذه العتائد مبدأ مُقَايَسَةُ المُمْتَزِّ المَناعِيِّ
المُرْتَبِطِ بالإِنْزِيْم نمط الشطيرة المضاعفة.double-antibody
Sandwich enzyme – linked ELISA.
|
| التحليل الإحصائي Statistical Analysis |
جرى حساب النتائج باستخدام الاختبارات الإحصائية التالية:
* اختبار Spearman′s لدراسة علاقات الارتباط.
* اختبار Mann – Whitney للمقارنة بين المتوسطات.
* اختبار كاي مربع لدراسة العلاقة بين أنماط الاستجابة السريرية المقدمة من قبل الطبيب والتبدلات في تركيز Caspase-3 بعد 24 ساعة من إعطاء الجرعة الأولى.
* اعتمدت قيمة P<0.05 كقيمة يعتد بها إحصائياً.
|
| النتائج Results |
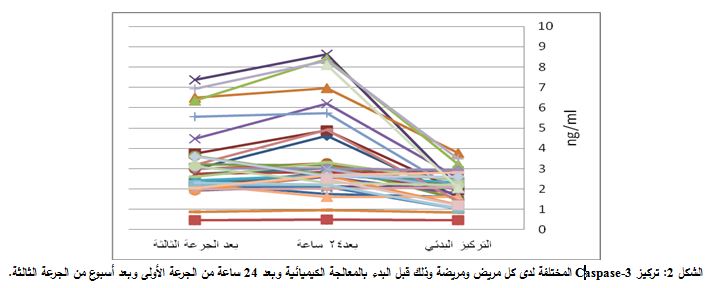
يعد المعيار الأساسي في دراستنا الإحصائية هو قياس مقدار الارتفاع Fold increase الحاصل انطلاقاً من التركيز البدئي، حيث عمدنا إلى حساب عدد الأضعاف في ارتفاع التركيز سواءً بعد 24 ساعة من الجرعة الأولى أو بعد أسبوع من الجرعة الثالثةوقمنا بنسبه إلى التركيز البدئي الذي تمّ قياسه لدى كل مريض. وبناءً على ذلك وجدنا ارتفاعات بمقدار 1.0 ضعفاً، 2.0 ضعفاً، 3.0 ضعفاً، 2 ضعفاً، 4 أضعاف.
الجرعة الثالثة. ويُظهر الشكل 2 نتائج مقايسة Caspase-3 التي جرت على ثلاث مراحل لكل مريض.
ولدى دراسة علاقة الارتباط بين مقدار الارتفاع الحاصل في تركيز Caspase-3، بعد 24 ساعة من إعطاء الجرعة الأولى والاستجابة السريرية، بتطبيق اختبار Spearman's rho، تبين وجود علاقة ارتباط قوية (r = 0.846) وكانت قيمةP = 0.0001.
بينما عند تطبيق اختبار Spearman's rho لدراسة علاقة الارتباط بين مقدار الارتفاع الحاصل في تركيز Caspase-3 بعد أسبوع من إعطاء الجرعة الثالثة والاستجابة السريرية تبين قمنا بدايةً بقياس تركيز Caspase-3 (نانوغرام/ مل) لكل مريض/ة في كل مرحلة، ثمّ عمدنا إلى حساب مقدار الارتفاع Fold increase الحاصل بعد 24 ساعة من الجرعة الأولى وبعد أسبوع من وجود علاقة ارتباط قوية ولكنها كانت أقل من سابقتها (r =0.731) وكانت P = 0.0001.
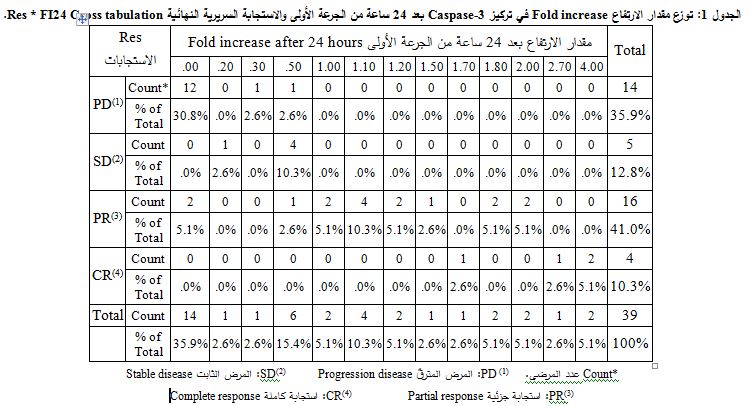
قمنا بفرز الاستجابات السريرية المختلفة لدى المرضى مع مقدار ارتفاعات Caspase-3 الناتجة بعد 24 ساعة من أخذ الجرعة الأولى فظهرت لدينا النتائج الموضحة في الجدول 1. ومن أجل اختبار وجود علاقة بين أنماط الاستجابات المختلفة المذكورة سابقاً والارتفاعات في التركيز بعد 24 ساعة من إعطاء الجرعة الأولى جرى تطبيق اختبار Chi-Square والذي أكد وجود علاقة ذات دلالة إحصائية بين الاستجابة ومقدار ارتفاع Caspase-3 بعد 24 ساعة من الجرعة الأولى increase fold، حيث وجد أنّ قيمة P = 0.0001.
تناولت دراستنا أيضاً 21 مريضة كمجموعة شاهدة Control group، حيث جرى قياس تركيزCaspase-3 لدى هذه المجموعة ومقارنته مع تركيز Caspase-3 البدئي لدى مجموعة المرضى، فكان متوسط تركيز Caspase-3 للمجموعة الشاهدة 2.9 نانوغرام/مل، بينما متوسط تركيز Caspase-3 البدئي لدى مجموعة المرضى كان 2.0 نانوغرام/مل.
وللمقارنة بين تركيز Caspase-3 لدى المجموعة الشاهدة والتركيز البدئي لدى مجموعـة المرضى
استخدمنا اختبار Mann-Whitney Test فكانت قيمة الاختبار 199.000 وقيمة P = 0.001، أي يوجد فارق معتد به إحصائياً بين تركيز Caspase-3 البدئي لدى المرضى وتركيزه لدى المجموعة الشاهدة.
وأيضاً بدراسة علاقة الارتباط بين تراكيز Caspase-3 الناتجة بعد 24 ساعة من إعطاء الجرعة الأولى وتراكيز Caspase-7 المقابلة لها وجدنا أنّ قيمة P = 0.0001. وهذا يؤكد أيضاً وجود علاقة ارتباط قوية، فمعامل الارتباط الموافق r = 0.796.
جرى أيضاً حساب المتوسط الحسابي لدى مجموعة المرضى لكلّ من:
تراكيز Caspase-3 البدئية، تراكيز Caspase-3 بعد 24 ساعة من الجرعة الأولى، أيضاً التراكيز بعد أسبوع من الجرعة الثالثة، فكان متوسط تراكيز Caspase-3 البدئي كما ذكر سابقاً 2.0225 نانوغرام/مل ومتوسط تراكيز Caspase-3 بعد 24 ساعة من الجرعة الأولى 3.5606 نانوغرام/مل، بينما متوسط تراكيز Caspase-3 بعد أسبوع من
الجرعة الثالثة 3.1312 نانوغرام/مل. وبتطبيق اختبار Mann-Whitney Test للمقارنة بين تركيز Caspase-3 البدئي لدى المرضى وتركيز Caspase-3 بعد 24 ساعة من الجرعة الأولى، وجد أنّ قيمة P = 0.0001، أي يوجد فارق معتد به إحصائياً بين تركيز Caspase-3 البدئي وبين تركيزه بعد 24 ساعة من الجرعة الأولى. وقمنا بدراسة علاقة الارتباط بين تراكيز Caspase-3 البدئية وتراكيز Caspase-7 البدئية المقابلة فوجدنا أنّ قيمة P 0.0001 = وهذا يؤكد وجود علاقة ارتباط قوية (r = 0.824).
قمنا كذلك بدراسة علاقة الارتباط Pearson Correlation بين تراكيز Caspase-3 الناتجة بعد 24 ساعة من إعطاء الجرعة الأولى وتراكيز Caspase-7 المقابلة لها فوجدنا أنّ قيمة= P 0.0001 وهذا يؤكد أيضاً وجود علاقة ارتباط قوية (r = 0.796).
|
 |
| المناقشة Discussion |
يساهم فقدان القدرة على الخضوع للاستماتة إلى حد كبير في نشوء الورم Tumor genesis وترقيه Tumor progression وإنّ واحداً من أهم وسائط الاستماتة هو Caspase-3 (1)، حيث أكدت العديد من الدراسات المجراة على خلايا MCF-7 وهي خلايا سرطان ثدي فاقدة جين Caspase-3، أنّ حساسية هذه الخلايا في الخضوع للاستماتة تزداد بشكل ملحوظ استجابة للعديد من أدوية المعالجة الكيميائية وذلك عند إعادة التعبير عن Caspase-3 في هذه الخلايا 13)). وهذا ما قمنا بالتحري عنه في دراستنا عن علاقة ارتفاع مستويات التعبير عن Caspase-3 والاستجابة السريرية، حيث أظهرت الدراسة بدايةً انخفاض معامل الارتباط من r = 0.846 والذي يظهر الارتباط بين مقدار الارتفاع في التركيز بعد 24 ساعة من الجرعة الأولى والاستجابة السريرية النهائية إلى r = 0.731 الذي يظهر بالمقابل الارتباط بين مقدار الارتفاع في التركيز بعد أسبوع من الجرعة الثالثة والاستجابة السريرية النهائية المقدمة من الطبيب. وبالتالي يعد مقدار الارتفاع الحاصل في تركيز Caspase-3 الذي جرى قياسه بعد 24 ساعة من الجرعة الأولى مؤشراً أفضل من مقدار الارتفاع الحاصل بعد أسبوع من الجرعة الثالثة، ويمكن الاعتماد عليه في استنتاج الاستجابة المبكرة للمريض للمعالجة الكيميائية والتنبؤ بإمكان إتمام النظام العلاجي أو إيقافه.
كما أظهرت دراستنا أنّ ارتفاع تركيز Caspase-3 بعد 24 ساعة من الجرعة الأولى من 1 ضعف (1 fold) إلى 4 أضعاف (4 fold) يمكن أن يكون مؤشراً على أنّ المريض سيبدي استجابة كاملة CR أو استجابة جزئية PR للمعالجة الكيميائية، أي أنّ المرضى الذي يحصل عندهم ارتفاع في تركيز Caspase-3 بعد 24 ساعة من الجرعة الأولى بمقدار < 1 ضعف (1 fold) يكون مؤشراً بأنّ هؤلاء المرضى لديهم احتمال كبير للاستجابة للمعالجة الكيميائية المطبقة ولاحقاً الشفاء من المرض، بينما المرضى الذين حصل لديهم تبدل طفيف في تركيز Caspase-3 بعد 24 ساعة من الجرعة الأولى، ابتداءً من 0 ضعف (0 fold) إلى 0.5 ضعف (0.5 fold)، فهذا يعد مؤشراً على ترّقي المرض لدى المريض. ويمكن التنبؤ بأن المريض لن يستجيب للعلاج الكيميائي، ويفضل إيقاف النظام العلاجي المستخدم واستبداله بنظام آخر جديد. وبالتالي تجنيب المريض خطر الآثار الجانبية للعلاج الحالي وتوفير كلّ من الوقت والجهد والكلفة الاقتصادية.
وبالنتيجة إذا كان مقدار ارتفاع تركيز Caspase-3 بعد 24 ساعة من الجرعة الأولى من 0 ضعف (0 fold) إلى 9.0 ضعف (0.9 fold) يمكن التنبؤ بأن المرض يتقدم progression disease أو أنه ثابت مستقر stable disease، أي أنّ المريض إمّا أن يتطور المرض لديه أو لن يستجيب للعلاج، وهذا يعود ويؤكد فكرة أنّ فقدان التعبير عن Caspase-3 قد يمثل آلية مهمة في بُقيا الخلية الورمية ومقاومتها للمعالجة الكيميائية لدى مرضى سرطان الثدي.
كذلك أظهرت الدراسة وجود فارق معتد به إحصائياً بين تركيز Caspase-3 البدئي لدى مجموعة المرضى وبين تركيزه لدى المرضى ذوي الورم المستقر نسبياً (المجموعة الشاهدة) وأيضاً بين تركيز Caspase-3 البدئي لدى مجموعة المرضى وبين تركيزه بعد 24 ساعة من إعطاء الجرعة الأولى. وهذا يؤكد حدوث تفعيل في شلال Caspases لحدوث عملية الاستماتة، التي تعمل على قتل الخلايا الورمية وإنقاص حجم الورم. وبالتالي تحسن حالة المريض حيث أنّ الارتفاع في تركيز Caspase-3 بعد 24 ساعة من إعطاء الجرعة الأولى يؤكد ذلك، بينما نلاحظ غياب أي ارتفاع في تركيز Caspase-3 لدى المرضى غير المستجيبين وبالتالي قد يشير ذلك إلى حصول تعطيل في عملية الاستماتة لديهم، مما يؤكد أهمية Caspase-3 ودوره في تقييم استجابة المرضى للمعالجة الكيميائية، وإمكان استخدامه كعامل مساهم للتنبؤ باستجابة المريض أو مقاومته للمعالجة.
كذلك قمنا بدراسة العلاقة بين Caspase-3 وCaspase-7 للتأكد من أنّ تفعيل شلال Caspases الناتج عن تأثير المعالجة الكيميائية ينتهي بحدوث عملية استماتة الخلايا الورمية، وبأن حدوث ارتفاع في تركيز Caspase-3 يقتضي بالضرورة حدوث ارتفاع أيضاً في تركيز Caspase-7 وهذا ما أكدته نتائج الدراسة، حيث ظهر وجود علاقة ارتباط قوية (r = 0.824) بين تراكيز Caspase-3 البدئية وتراكيز Caspase-7 البدئية المقابلة، وكذلك بين تراكيز Caspase-3 الناتجة بعد 24 ساعة من إعطاء الجرعة الأولى وتركيز Caspase-7 المقابلة لها (r = 0.796)، مما يؤكد أنّ غياب حصول ارتفاع في تركيز Caspase-3 يقتضي إيقاف شلال الاستماتة وبالتالي منع حدوث استجابة للمعالجة الكيميائية.
توافقت نتائج دراستنا المصلية مع نتائج دراسة Branham et al. عام 2012 (14) والمجراة على 80 مريضة سرطان ثدي نقائلي وسرطان ثدي متقدم موضعي، حيث كانت العينات في هذه الدراسة عبارة عن خزع من الورم خلال مراحل مختلفة من تطبيق المعالجة الكيميائية، واتفقت نتائجنا أيضاً مع دراسة Roth et al. عام 2011 (15) والتي أجريت على عينات مصل من مرضى سرطان رئة، حيث أكدت هذه الدراسة وجود ارتباط قوي بين ارتفاع تركيز Caspase-3 و Caspase-7 في مصول مرضى سرطان الرئة جميعهم مقارنة مع الأفراد السليمين.
ومن الجدير بالذكر أنّ دراستنا تعد الدراسة المصلية الأولى التي أجريت على مرضى سرطان الثدي في بلادنا لتقييم تبدل تركيز Caspase-3 وCaspase-7 خلال مراحل المعالجة الكيميائية وعلاقتها بالاستجابة السريرية النهائية.
|
| الاستنتاج Conclusion |
| أكدت هذه الدراسة وجود علاقة ارتباط قوية بين مقدار الارتفاع الحاصل في تركيزCaspase-3 بعد 24 ساعة من الجرعة الأولى والاستجابة السريرية، مما يقترح إمكانية إضافة Caspase-3 كواصم محتمل لأخذ القرار بمتابعة النظام العلاجي المطبق أو إيقافه واستبداله بنظام علاجي آخر، وإنّ النتائج التي حصلنا عليها لا تشير فقط إلى أهمية Caspase-3 كواصم فقط وإنّما يمكن أن يكون في المستقبل هدفاً علاجياً لمرضى سرطان الثدي. |
كلمة شكر Acknowledgment
الشكر الموصول للأستاذ الدكتور مروان بشور رئيس قسم وحدة سرطان الثدي في مستشفى البيروني والدكتور ماهر سلمون لتوفيرهما كل العون والمساعدة لإتمام هذا البحث، ووافر الشكر والعرفان لجامعة دمشق على تمويلها هذا البحث العلمي.
|
| المراجع References |
1-O'Donovon N; Crown J; Stunell H; Hill K.D.A; McDermott E; O'Higgins N. and Duffy J.M.
Caspase 3 in breast cancer.
Clin Cancer Res, 9: 738-742, 2003.
2-Evan G.I. and Vousden K.H.
Proliferation, cell cycle and apoptosis in cancer.
Nature, 411: 342-348, 2001.
3-Sakamaki K. and Satou Y.
Caspases: evolutionary aspects of their functions in vertebrates.
J Fish Biol, 74(4): 727-753, 2009.
4-Fan T.J; Han L.H; Cong R.S. and Liang J.
Caspase Family Proteases and Apoptosis.
Acta Biochimica et Biophysica Sinica, 37(11): 719-727, 2005.
5-Devarajan E; Sahin A. A; Chen S.J; Krishnamurthy R.R; Aggarwal N; Brun A; Sapino A; Zhang F; Sharma D; Yang X; Tora D.A. and Mehta K.
Down-regulation of caspase 3 in breast cancer: a possible mechanism for chemoresistance.
Oncogene, 21(57): 8843-8851, 2002.
6-Suzuki A; Kawabata T. and Kato M.
Necessity of interleukin-1β converting enzyme cascade in taxotere-initiated death signaling.
Eur. J. Pharmacol, 343: 87-92, 1998.
7-Yang X.H; Sladek T.L; Liu X; Butler B.R; Froelich C.J. and Thor A. D.
Reconstitution of caspase 3 sensitizes MCF-7 breast cancer cells to doxorubicin- and etoposide-induced apoptosis.
Cancer Res, 61(1): 348-354, 2001.
8-Faleiro L. and Lazebnik Y.
Caspases disrupt the nuclear-cytoplasmic barrier.
J Cell Biol, 151(5): 951-959, 2000.
9-Lamkanfi M; Declercq W;Depuydt B; Kalai M; Saelens X. and Vandenabeele P.
The Caspase Family; in "Caspases- Their Role in Cell Death and Cell Survival".
Ed. Los M. and Walczak H;
Pub. LANDES Bioscience,1-40, 2002.
10-Campos S.M; Hayes D.F. and Chen W.Y.
Breast cancer: epidemiology, histology, diagnosis and staging; in "Breast Cancer". Ed. Chen W.Y; Wardley A. and Skarin A.T.
Pub. Mosby Elsevier, 21-68, 2007.
11-Faneyte I.F; Schrama J.G; Peterse J.L; Remijnse P.L; Rodenhuis S. and Van de Vijver M.J.
Breast cancer response to neoadjuvant chemotherapy: Predictive markers and relation with outcome.
British J Cancer, 88(3): 406-412, 2003.
12-Eisenhauer E.A; Therasse P; Bogaerts J; Schwartz .H. L; Sargent D; Ford R; Dancey J; Arbuck S; Gwyther S; Mooney M; Rubinstein L; Shankar L; Dodd L; Kaplan R; Lacombe D. and Verweij J.
New response evaluation criteria in solid tumours: Revised RECIST guideline (version 1.1).
Eur J Cancer, 45: 228-247, 2009.
13-Simstein R; Burow M; Parker A; Weldon C. and Beckman B.
Apoptosis, chemoresistance, and breast cancer: insights from the MCF-7 cell model system.
Exp Biol Med, 228(9): 995-1003, 2003.
14-Branham K.S; Krishna V.M; Gopal R.S.V. and Raju A.J.S.
Study to evaluate the efficacy of clinical response in assessing the chemo-sensitivity in correlation with caspases-3 amplification in advanced breast cancer.
JBMAS, 1(2): 11-22, 2012.
15-Roth C; Kasimir-Bauer S; Pantel K. and Schwarzenbach H.
Screening for circulating nucleic acids and caspase activity in the peripheral blood as potential diagnostic tools in lung cancer.
Mol Oncol, 5(3): 281-291, 2011.
|
| |
| |
| المجلد 7 ,
العددان 3-4
, رمضان 1435 - تموز (يوليو) 2014 |
|
|
|
