| الملخص Abstract |
هدفت هذه الدراسة إلى تقييم الفائدة السريرية من تعيين مستويات Fas المصلية sFas لدى مريضات سرطان ثدي معالجات كيميائياً وإشعاعياً، من خلال تعيين تراكيزه المصلية قبل المعالجة وبعدها. وتقييم دوره كواصم إنذاري للنكس والنقائل. يلعب sFas دوراً في ترقي السرطان بتثبيط الاستماتة المتواسطة بالـ Fas. وهي آلية للإفلات المناعي للورم لدى مرضى السرطان. تضمنت الدراسة 85 امرأة: 60 مريضة مصابة بسرطان الثدي (44 مريضة في المرحلتين الأولى والثانية II&I و16 مريضة في المرحلة الثالثة III؛ متوسط أعمارهن 50.2 عاماً)؛ ومجموعة شاهدة: 25 امرأة سليمة ظاهرياً؛ متوسط أعمارهن 32.3 عاماً. جُمعت عينة مصل أولى بعد إخضاع المريضة للعلاج الجراحي وقبل خضوعها لأي علاج آخر، كما جُمعت عينة مصل ثانية بعد أسبوع من إنهاء المريضة للمعالجة الكيميائية والمعالجة الإشعاعية.
عُينت تراكيز sFas المصلية باتباع طريقة المُمْتَزِّ المَناعِيِّ المُرْتَبِطِ بالإِنْزِيْم نمط الشطيرة Sandwich ELISA. وتمت متابعة حالة المريضات السريرية وتشخيص النكس أو النقائل خلال مدة اثني عشر شهراً وفقاً للمعطيات الشعاعية والسريرية التي يراها الأطباء. تبين أثناء المتابعة حدوث نكس لدى 3 مريضات (5%) ونقائل لدى 5 مريضات (8.33%)، بينما كانت الحالة السريرية جيدة لدى الـ 52 مريضة الباقية (%86.66)، خلال مدة المتابعة.
كانت مستويات Fas المصلية أعلى بشكل يُعتد به لدى مجموعة المريضات منها لدى المجموعة الشاهدة (p<0.01). وكانت مستويات sFas أعلى بشكل يُعتد به بعد المُعالَجَةُ الإِشْعاعِيَّة والمُعالَجَةُ الكِيمْيائِيَّة منها قبل المعالجة(p<0.001) . وفي نهاية المعالجة، كانت مستويات sFas أعلى بشكل يُعتد به لدى المريضات الناكسات ومريضات النقائل منها لدى المريضات اللاتي لم يشخص لديهن أي نكس أو نقائل (p<0.01). قد تدعم نتائجنا إمكانية الاستفادة من تعيين تراكيز Fas المصلية في الممارسة السريرية، كواصم إنذاري. وبهذا يمكن أن يُستخدم في التنبؤ بحدوث نكس أو نقائل لدى مريضات سرطان الثدي المعالجات.
|
| The study aimed to assess the clinical usefulness of determination of serum Fas (sFas) levels in breast cancer patients treated with chemotherapy and radiotherapy, by determining its serum concentration before and after therapy. And assessing its role as a prognostic marker for recurrence and matastasis. Serum sFas plays an important role in cancer progression by inhibiting Fas mediated-apoptosis. This is a mechanism of tumor immune escape in cancer patients. The study included 85 women: 60 breast cancer patients (44 patients with I&II stages and 16 patients with III stage; mean age 50.2 years), and a control group: 25 apparently healthy women; mean age 32.3 years. First serum sample was collected after the patient had undergone to a surgical operation and before she underwent to any other treatments. Second sample was collected after a week of the patient had finished chemotherapy and radiotherapy treatments. Serum sFas levels were determined by sandwich ELISA method. Through the next twelve months after treatments, the patients were followed up to assess their clinical cases and to diagnose recurrence and metastasis states, according to the physicians. It was noted three patients (5%) with recurrence and five patients (8.33%) with metastasis, while the other 52 patients (86.66%) had good clinical cases, through the follow up period. The serum Fas levels were significantly higher in the patients group than in the control group (p<0.01).The levels of sFas were significantly higher after radiotherapy and chemotherapy than before therapy (p<0.001). At the end of therapy, sFas levels were significantly higher in patients with recurrence and metastasis than in patients with none (p<0.01). Our results may support that determination of serum Fas levels can be useful in clinical practice, as a prognostic marker. So it can be used in predicting recurrence and metastasis in treated breast cancer patients. |
| المقدمة Introduction |
| يعد سرطان الثدي السرطان الأكثر شيوعاً لدى النساء في كثير من أنحاء العالم، حيث تعاني فيه المريضات من النكس وتشكل نقائل وهما المسببان الرئيسان للوفيات المتعلقة بالسرطان (1). تعتمد أغلب المعالجات المضادة للسرطان، بما فيها المعالجات الكيميائية والإشعاعية على حدثية الاستماتة في قتل الخلايا السرطانية. ويعد الخلل في هذه العملية أحد أهم العوامل التي تؤدي إلى تطور السرطان ومقاومة الخلايا السرطانية لهذه المعالجات (2). إن الاستماتة عبارة عن شلال منظم بدقة مكون من تفاعلات إنزيمية تقود في النهاية إلى تدرك الدنا DNA وتلاشي البنى الخلوية دون إحداث استجابة التهابية. هنالك سبيلان متراكبان لنقل الإشارة يقودان في النهاية إلى الاستماتة هما: السبيل الداخلي intrinsic pathway المتواسط بالمتقدرات والسبيل الخارجي extrinsic pathway المتواسط بالمستقبل، وتعد جملة الموت FasL/Fas أحد أهم الجمل المنظمة الأساسية للاستماتة الخلوية. إن Fas عبارة عن بروتين سكري عبر غشائي من النمط الأول (I)، وزنه 45 كيلودالتون، ينتمي إلى طائفة مستقبل عامل النخر الورمي TNF، كما يرمز له أيضاً Apo-1 أو CD-95. يُعبّر عن Fas بشكل مطلق في نسج كثيرة، بينما ترتفع مستويات التعبير عنه بشكل خاص في التوتة، والكبد، القلب والكليتين، كما يُعبّر عنه على سطح خلايا سرطانية عديدة بما فيها سرطان القولون وسرطان الثدي. يُعد المستقبل Fas العنصر الأساسي في المرحلة الفعالة من الاستجابة المناعية تجاه الخلايا الورمية المعبرة عن Fas، ويتميز بمنطقتين منطقة خارج خلوية وهي عبارة عن ثلاثة أذرع مكونة من تكرارات السيستئين، ومنطقة داخل خلوية مكونة من ذراع الموت DD (death domain) الذي يلعب دوراً هاماً في نقل إشارة الاستماتة. يتواجد Fas بشكلين: الشكل عبر الغشائي والشكل الذواب. يحرض الشكل الأول Fas الاستماتة من خلال الارتباط باللجينة FasL بشكل رئيسي، أما الشكل الذواب منه sFas فهو يفتقر للذراع عبر الغشائي، ويتولد من خلال ظاهرة التضفير المتناوب للرنا المرسال لجين Fas (lternative mRNA splicing) وليس عبر الشطر بالتحلل البروتيني (3). أما بالنسبة لمنشأ sFas في المصل فهناك ثلاث نظريات محتملة: قد يُشتق من الورم بذاته، أو من اللمفاويات في الدم المحيطي، أو قد ينتجه النسيج السدوي stromal tissue المحيط بالورم بشكل بديل كاستجابة للورم أو كاستجابة ثانوية للتفعيل المناعي. لقد لوحظ أن إنتاج sFas لدى مريضات سرطان الثدي يترافق مع إنذار سيء للمرض عادة، وسُجلت تراكيز مرتفعة من sFas لدى مريضات سرطان الثدي الناكس (4). يمكن تصور الدور البيولوجي للشكل الذواب sFas بحيث يشمل ارتباط وتعديل الشكل اللجيني المرتبط بالغشاء الخلوي FasL أو الشكل اللجيني الذواب sFasL، بحيث يمنعه من التآثر مع المستقبل Fas المرتبط بالغشاء الخلوي (الشكل 1). وهكذا يلعب sFas دوراً في ترقي السرطان من خلال القيام بدور هام في تنظيم الاستماتة كمثبط للاستماتة المتواسطة بالمستقبل Fas، وبذلك فهو يعد آلية من آليات التهرب المناعي للورم لدى مرضى السرطان. وعلى اعتبار أن الاستماتة المتواسطة بالمستقبل Fas تعد مشتملة في الاستماتة المحرضة بالأدوية المضادة للسرطان، لذلك فمن الطبيعي أن تسبب التراكيز المصلية المرتفعة من sFas مقاومة للعلاج من خلال تثبيط الاستماتة المتواسطة بالمستقبل Fas في الخلايا السرطانية (4). |
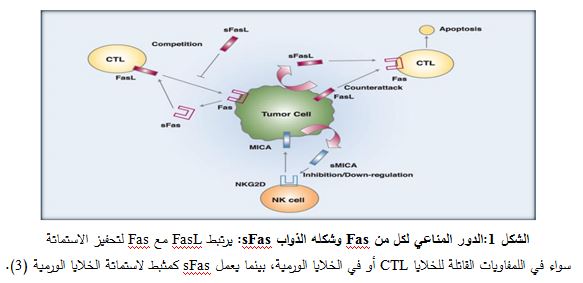 |
| المواد والطرق Materials and methods |
وصف عينة البحث: المجموعة المرضية: ضمت 60 مريضة مصابة بسرطان ثدي استناداً إلى نتائج التشريح المرضي (44 مريضة في المراحل الأولية II&I و16 مريضة في المراحل المتقدمة III خاضعات للعلاج الجراحي ولم يخضعن لأي علاج آخر بعد، تراوحت أعمارهن بين 21-80 عاماً)، والمجموعة الشاهدة: ضمت 25 امرأة سليمة ظاهرياً، تراوحت أعمارهن بين 23-50 عاماً.
الاعتيان Sampling
بُزل من كل مريضة 5 مل من الدم ضمن أنبوب بعد خضوعها لعمل جراحي وقبل أن تخضع لأي علاج آخر. كما جُمعت عينة أخرى من كل مريضة بعد إتمام خضوعها للعلاج الكيميائي والعلاج الشعاعي بأسبوع. نُبذت العينات بسرعة 3000 دورة/ الدقيقة لمدة 10 دقائق، ثم وُزع المصل الناتج على 4 أنابيب إيبندورف وحُفظت بدرجة حـــرارة –80C ˚ في المجمدة الخاصة بالمستشفى إلى حين إجراء المقايسة. جرت متابعة حالة المريضات السريرية بعد المعالجة وتشخيص النكس والنقائل خلال فترة اثني عشر شهراً وفقاً للمعطيات الشعاعية والسريرية التي يراها الطبيب المعالج. لوحظ وجود نكس لدى 3 مريضات (5%) ونقائل لدى 5 مريضات (8.33%) من أصل المريضات المعالجات، بينما لم يجرِ تشخيص أي نكس أو نقائل لدى بقية المريضات وهنّ 52 مريضة) 86.66%) وكانت حالتهن مستقرة وذلك خلال مدة المتابعة (الشكل 2).
استخدم في العمل جهاز ELISA آلي لشركة Human الألمانية.
جرت مقايسة sFas في مصول المريضات اعتماداً على طريقة مقايسة الممتز المناعي المرتبط بالإنزيم نمط الشطيرة ELISA sandwich، وذلك باستخدام عتيدة ELISA Human sAPO-1/Fas لشركة BioVendor التشيكية، وجرت المقايسة وفق تعليمات الشركة المصنعة للعتيدة.
الدراسة الإحصائية Statistic analysis
جرى التعبير عن القيم المختلفة بحساب المتوسط الحسابي والانحراف المعياري لكل مجموعة، واعتمد اختبار T- student لتحديد كون الفارق بين المتوسطات ناجماً عن الصدفة أم أنه فارق يُعتد به إحصائياً، كما تم اعتماد قيمة p<0.05 للدلالة الهامة إحصائياً.
|
| النتائج Results |
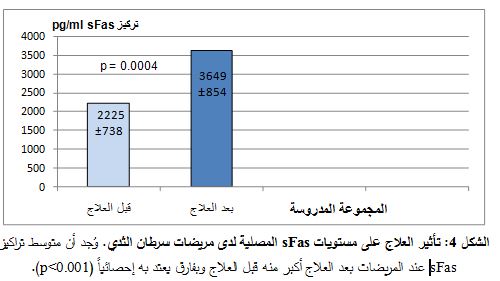
| كانت مستويات sFas المصلية لدى مجموعة المريضات أعلى منها لدى المجموعة الشاهدة وبفارق يعتد به إحصائياً 0.002=p)) (الشكل 3). أما بعد المعالجة فكانت مستويات sFas لدى المريضات أعلى منها قبل المعالجة وبفارق يعتد به إحصائياً أيضاً (0.004=p) (الشكل 4).
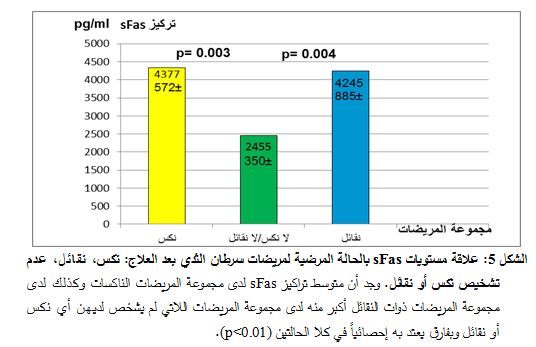
ولدى دراسة علاقة مستويات sFas المصلية بحالة المريضات السريرية كانت مستويات sFas لدى مجموعة المريضات الناكسات وكذلك لدى مجموعة المريضات ذوات النقائل أعلى منها لدى مجموعة المريضات اللاتي لم يشخص لديهن أي نكس أو نقائل وبفارق يعتد به إحصائياً (0.003=p و 0.004=p)، على الترتيب، كما هو موضح في الشكل 5.
|

 |
| المناقشة Discussion |
تعد المعالجة الكيميائية والإشعاعية وسائل تقليدية مستخدمة في معالجة السرطانات التي ليس من السهل أن تشفى بالعلاج الجراحي وحده مثل سرطان الثدي. وعلى الرغم من أن مثل هذه المعالجات تؤدي عادةً إلى تراجع الورم، فإنها نادراً ما تكون شافية وعادةً ما يعرقلها انبثاق خلايا سرطانية مقاومة. لقد ازداد الاهتمام في السنوات الأخيرة بدور الاستماتة في الخباثات بشكل عام وفي سرطان الثدي بشكل خاص، حيث يعد الخلل في عملية الاستماتة أحد أهم العوامل التي تؤدي إلى تولد السرطان وكذلك مقاومة الخلايا السرطانية للمعالجة الكيميائية والإشعاعية، على اعتبار أن أغلب المعالجات المضادة للسرطان تعتمد على الاستماتة في قتل الخلايا السرطانية. وبما أن sFas يعد أحد العوامل المتورطة في التهرب المناعي للسرطان والتي تساهم في ترقي السرطان (2)، لذا فإننا نعتقد أن مقايسة sFas في المصل ربما تساعد في تقييم مقاومة المريضات ضد معالجات سرطان الثدي والتنبؤ بالنكس وتشكل النقائل لدى مريضات سرطان الثدي المعالجات.
بينت دراستنا أن مستويات sFas لدى المريضات أعلى منها لدى المجموعة الشاهدة وبفارق معتد به إحصائياً (p<0.01)، حيث أنه من المثبت علمياً إنتاج sFas في الأحياء in vivo لدى الأشخاص الأصحاء، حيث يعبّر عن Fas وبالتالي عن sFas في نسج كثيرة، خاصة في التوتة، والكبد، والقلب والكليتين، كما يعبّر عنه على سطح خلايا سرطانية عديدة بما فيها سرطان الثدي. وهذا يتوافق مع دور sFas المناهض وظيفياً في الاستماتة المعتمدة على اللجينة FasL بهدف تعطيل وظيفة Fas المرتبط بسطح الخلية والذي يعد مفتاح الاستماتة بالسبيل الخارجي. وبالتالي فإن ارتفاع التراكيز المصلية للشكل الذواب sFas يعكس التثبيط الشديد لاستماتة خلايا سرطان الثدي والذي يدعم تطور الورم السرطاني ويساهم في بيولوجية سرطان الثدي (3). توافقت دراستنا مع دراسة et al. Fersching (2012) على مريضات سرطان الثدي (4)، ودراسة Sachan et al. (2012) على مريضات سرطان عنق الرحم وسرطان المهبل (5)، وعند دراستنا لتأثير العلاج على مستويات sFas لدى مريضات سرطان الثدي تبين ارتفاع مستويات sFas بعد العلاج مقارنة بها قبل العلاج وبفارق يُعتد به إحصائياً (p<0.001).Hewala et al. (2012) بالنسبة لسرطان الثدي (6)، ودراسة Naumnik et al.. (2007) بالنسبة لسرطان الرئة (7)، حيث ارتفعت تراكيز sFas بعد العلاج ارتفاعاً يُعتد به إحصائياً. وقد يعزى ارتفاع تراكيز sFas بعد العلاج إلى أن العديد من الأدوية المضادة للسرطان وكذلك المعالجة الإشعاعية تفعل سبيل FasL/Fas لتحريض الاستماتة في الخلايا، إلا أن إنتاج sFas في المصل بتراكيز مرتفعة من قبل الخلايا السرطانية يسبب مقاومة للعلاج من خلال تثبيط الاستماتة المتواسطة بالمستقبل Fas في الخلايا السرطانية، وبذلك يعد sFas آلية من آليات التهرب المناعي للورم عند مريضات سرطان الثدي (7).
كما بينت دراستنا أن مستويات sFas لدى المريضات الناكسات وكذلك لدى المريضات النقائليات أعلى منها لدى المريضات اللواتي لم يشخص لديهن أي نكس أو نقائل وبفارق معتد به إحصائياً في كلا الحالتين. توافقت دراستنا مع دراسة Naumnik et al. (2007) بالنسبة لسرطان الرئة (7) التي وجدت علاقة قوية بين ارتفاع مستويات sFas بعد العلاج والإنذار الضعيف poor prognosis. إن هذا يتوافق مع الدور الحيوي للشكل الذواب sFas في الارتباط مع FasL المرتبط بالغشاء، مما يفقد Fas الموجود على سطح الخلايا السرطانية وظيفته، الأمر الذي يعزز من تواتر الورم وينقص من كمونه latency ويزيد من حدوث النقائل الورمية التلقائية.
ومن المعلوم أن الخلايا الورمية الخبيثة التي تكتسب مقاومة للاستماتة هي أيضاً مقاومة للمعالجة الكيميائية والمعالجة الإشعاعية، وبالتالي يمكن أن يكون ازدياد إنتاج sFas لدى مريضات سرطان الثدي بعد العلاج قد لعب دوراً في تثبيط استماتة الخلايا السرطانية بالسبيل المتواسط بالمستقبل Fas، مما يؤكد دوره الهام في التهرب المناعي للسرطان عند مريضات سرطان الثدي الناكسات والمشخصات بوجود نقائل (7).
|
| الاستنتاج Conclusion |
| يمكننا أن نستنتج من خلال هذه المعطيات كلها أهمية مقايسة sFas المصلية في الممارسة السريرية لإمكانية التنبؤ بحدوث نكس أو نقائل لدى مريضات سرطان الثدي المعالجات. |
| المراجع References |
1-Gerber B; Freund M and Reimer T.
Recurrent breast cancer: treatment
strategies for maintaining and prolonging good quality of life.
Deutsches Arzteblatt. 2010; 107(6): 85-91.
2-Li X. and Qifeng Y.
Molecular Mechanism and Morphology in Cancer, The Role of Bcl-2 in Breast Cancer.
Ed. Nakamura M. and Kakudo K; Pub. Bentham Science. 2009; 57-80.
3-AL-Haidary B.A; Mahmood A.Sh and Yousif S.O.
Assessment of P53 and soluble FasL (sFasL) serum concentration in females with benign & malignant breast tumors.
Iraqi J. Comm. Med. 2013; 26(2): 124-128.
4-Fersching DM1; Nagel D; Siegele B; Salat C; Heinemann V; Holdenrieder S. and Stoetzer OJ.
Apoptosis-related biomarkers sFAS, MIF, ICAM-1 and PAI-1 in serum of breast cancer patients undergoing neoadjuvant chemotherapy.
Anticancer Res. 2012; 32(5): 2047-2058.
5-Sachan R; Patel M; Agarwal R; Srivastava M. and Natu S.
Serum Soluble Fas (sFas) concentrations in patientswith cervical cancer and vaginal cancer-A hospital based study in North Indian population.
Biomedical Research, 2012; 23: 169-175.
6-Hewala TI; Abd El-Monaim NA; Anwar M. and Ebied SA.
The clinical significance of serum soluble Fas and p53 protein in breast cancer patients: comparison with serum CA 15-3.
Pathology Oncology Research. 2012;
18(4): 841-848.
7-Naumnik W; Iżycki T; Ossolińska M. and Chyczewska E.
Serum levels of sfas and sfasl during chemotherapy of lung cancer.
Experimental Oncology. 2007 June; 29(2): 132-136.
|
| |
| |
