| المجلد 7 ,
العددان 3-4
, رمضان 1435 - تموز (يوليو) 2014 |
| |
| دراسة المستقبل II الذواب لعامل النخر الورمي ألفا لدى سوريين مصابين بفشل القلب |
| Study of Soluble Receptor II of Tumor Necrosis Factor Alpha in Syrian Patients with Heart Failure |
| د. علا مشمش و أ.د. فايزة القبيلي |
| Mushmush O. and Al Quabili F. |
كلية الصيدلة، جامعة دمشق
Faculty of Pharmacy, Damascus University
|
| الملخص Abstract |
تلعب السيتوكينات دوراً هاماً في تدهور الإصابة القلبية. ومن هذه السيتوكينات عامل النخر الورمي α (TNF α). وهو سيتوكين يفرز من العديد من الخلايا المناعية ويؤدي إلى ترقي الفشل القلبي (HF)، من خلال ارتباطه إلى المستقبلات الموجودة على القلب (TNF-R1 وTNF-R2) مما يحرض استماتة الخلايا القلبية. لهذا هدف بحثنا إلى دراسة المستويات المصلية للمستقبل II الذواب لعامل النخر الورمي ألفا (sTNFαRII) وعامل النخر الورمي ألفا لدى مصابين بفشل القلب وارتباطهما مع وخامة المرض والخلل الوظيفي القلبي المتقدم.
جرت مقايسة المستويات المصلية للمستقبل IIالذواب لعامل النخر الورمي ألفا وعامل النخر الورمي ألفا لدى 60 مريضاً مصاباً بفشل القلب، و28 من الأشخاص الأصحاء ظاهريا ً)المجموعة الشاهدة).
واستناداً لتصنيف جمعية نيويورك للقلب NYHA جرى تصنيف المرضى من الناحية السريرية إلى المجموعات التالية: مرضى NYHAI (3 مرضى)، NYHAII (23 مريضاً)، NYHAIII (28 مريضاً)، NYHAIV (6 مرضى).
أظهرت دراستنا أن مستويات المستقبل IIالذواب لعامل النخر الورمي ألفا (sTNFαRII) كانت مرتفعة بشكل يعتد به إحصائياً (P<0.0001) لدى مرضى فشل القلب بالمقارنة مع المجموعة الشاهدة (3360.34±122.09 بيكوغرام/ مل و1383.53±72.05 بيكوغرام/ مل، على الترتيب). ازدادت مستويات المستقبل II الذواب لعامل النخر الورمي ألفا بشكل يُعتد به إحصائياً (P<0.0001) بالتوازي مع تقدم المرض. ارتفعت المستويات المصلية لعامل النخر الورمي ألفا TNFα بشكل يعتد به إحصائياً (P<0.0001) لدى مرضى فشل القلب بالمقارنة مع المجموعة الشاهدة (0.09±4.46 بيكوغرام/ مل و1.15±0.17 بيكوغرام/ مل، على الترتيب). وكانت المستويات المصلية لعامل النخر الورمي ألفا أعلى بشكل يعتد به إحصائياً (P<0.0001) لدى مرضى NYHAIII (المتوسط ± الخطأ المعياري: 4.93±0.1) مقارنة بمرضى NYHAII (3.87±0.07)، لكن هذه المستويات لم ترتفع بشكل يعتد به إحصائياً (P=1.0) لدى مرضى NYHAIV مقارنة بمرضى NYHAIII. وكاستنتاج يعدsTNFαRII متنبئاً أفضل من TNFα لمرضى القلب المتقدم (NYHAIV).
|
Cytokines play an important role in the deterioration of cardiac injury. Tumor necrosis factor α (TNF α) is one of these cytokines. It is cytokine secreted by many immune cells and leads to the progression of heart failure (HF), by binding to receptors on the heart (TNF-R1 and TNF-R2), which stimulates apoptosis of myocardial cells. For this, our research aimed to study the serum levels of soluble receptor II of tumor necrosis factor alpha (sTNFα RII) and TNFα in patients with heart failure, and its relation with the severity of disease and advanced cardiac dysfunction.
Serum levels of the soluble receptor II of tumor necrosis factor alpha and tumor necrosis factor alpha were measured in 60 patients with heart failure and 28 apparently healthy subjects (control group). According to the classification of the New York Heart Association (NYHA), patients were clinically classified to the following groups: NYHAI (3 patients), NYHAII (23 patients) NYHAIII (28 patients), NYHAIV (6 patients).
This study showed that the serum levels of soluble receptor II of tumor necrosis factor alpha (sTNFαRII) were significantly elevated (p<0.0001) in patients with heart failure, compared with the control group (3360.34±122.09 pg/ ml and 1383.53±72.05 pg/ ml. respectively). Serum levels of soluble receptor II of tumor necrosis factor alpha significantly increased (p=0.0001) in parallel with disease progression. Serum levels of tumor necrosis factor alpha were significantly elevated (p<0.0001) in patients with heart failure, compared with control group (4.46±0.09 pg/ ml and 1.15±0.17 pg/ml, respectively) Serum TNFα levels were significantly higher (p<0.0001) in NYHAIII patients (mean±SE: 4.93±0.1 pg/ml) than in NYHAII patients (mean±SE: 3.87±0.07 pg/ml), but these levels did not increased significantly (p=1.0) in NYHAIV than in NYHAIII patients.
As conclusion, sTNFαRII is better predictor of advanced heart failure (NYHAIV) than TNFα.
|
| المقدمة Introduction |
يعد الفشل القلبي Heart Failure المرحلة النهائية لأغلب الأمراض التي تصيب القلب وهو سبب أساسي للمراضة morbidity والموت mortality في أغلب المجتمعات (1). يعرف الفشل القلبي بأنه متلازمة سريرية clinical syndrome تبدأ بخَلَلٌ وَظيفِيّ قلبي Cardiac dysfunction، تسبب إما تراجعا ًفي قدرة القلب على ضخ كمية كافية من الدم تتناسب مع حاجات الجسم، وإما ارتفاعا ًفي ضغوط امتلاء البطنيات وما يرافقها من أعراض احتقان Congestion دموي أو كلتا الحالتين معاً وهو الأكثر شيوعاً (2). يعاني مرضى فشل القلب من أذية بدئية في العضلة القلبية myocardium يليها تدهور تدريجي في وظيفة مضخة القلب (3). و حتى الآن لم تُحدد الآليات الفيزيولوجية المرضية Pathophysiological mechanisms للفشل القلبي، إلا أن أغلب الدراسات أشارت إلى حدوث تنشيط مناعي متزايد لدى مرضى فشل القلب، حيث يظهر هؤلاء المرضى تراكيز بلازمية مرتفعة من الـ pro-inflammatory cytokine (مثل عامل النخر الورمي ألفا (TNFα تتناسب مع تزايد شدة المرض (3، 4).
يعمل عامل النخر الورمي α ( TNF α) Tumor necrosis factor alpha على تعديل وظيفة العضلة القلبية من خلال عدة آليات، هي التالية: شذوذ تنظيم التعبير عن إنزيم أُكسيد النِّتْرِيك سينثاز nitric oxid synthase، زيادة التعبير عن جذور الأكسجين الحرة oxygen Free radical، تحريض استماتة العضلة القلبية والخلايا البطانية Endothelial cells (5).
يعد عامل النخر الورمي α سيتوكيناً مؤيداً للالتهاب proinflammatory cytokine، يُفرز من خلايا وحيدات النوى المفعلة في الدم المحيطي activated Peripheral Blood Mononuclear Cell (PBMC). ويرتبط بعد إفرازه بمستقبلين نوعيين موجودين على غشاء خلايا عضلة القلب وهما:
أ- TNFR1 المستقبل الأقل ألفة Lower affinity receptor لعامل النخر الورمي ألفا.
ب- TNFR2 المستقبل الأكثر ألفة higher-affinity receptor لعامل النخر الورمي ألفا (5).
وبعد ارتباط المستقبلين بـعامل النخر الورمي ألفا يخضعان لشطر حال للبروتين من غشاء الخلية. وبالتالي يتواجدان في الدوران كمستقبلات ذوابة يشار إليها بـ sTNFαRI و sTNFαRII (5). حيث يعمل هذان المستقبلان الذوابان على تنظيم الفعالية الحيوية لعامل النخر الورمي ألفا، إما من خلال تثبيط ارتباط مثلوث عامل النخر الورمي ألفا TNF Trimer بمستقبلات الغشاء TNFR1 وTNFR2، وإما من خلال منع مثلوث عامل النخر الورمي ألفا من التفكك dissociation إلى موحودات Monomers غير فعالة (6).
لذلك تقيّم جملة عامل النخر الورمي TNF system بشكل أفضل عن طريق قياس مستويات مستقبلاته الذوابة (المستقبل الثاني الذواب لعامل النخر الورمي ألفا sTNFαRII بشكل خاص) (7، 8).
لذلك اتجهت الأبحاث الحديثة ]دراسة Anita Deswal عام 2001 (9)، ودراسة Christian Stump عام 2003 (10) ودراسة Margit Niethemmer وزملائها عام 2008 (11)[، إلى دراسة علاقة المستقبلات الذوابة مع الفشل القلبي إلى جانب TNFα، ومن هنا هدف بحثنا إلى تقييم أهمية مقايسة المستقبل الثاني الذواب لعامل النخر الورمي ألفا لدى مرضى فشل القلب.
|
| المواد والطرق Materials and Methods |
شملت دراستنا 88 فرداً من الذكور والإناث، تراوحت أعمارهم بين 28 و85 عاماً. جرى الحصول على عينات المرضى من المراجعين لمركز الباسل لأمراض وجراحة القلب ومستشفى الأسد الجامعي ومستشفى المواساة، خلال الفترة ما بين8 تموز عام 2012 و12 آذار عام 2013 ووزع أفراد الدراسة على النحو التالي:
1- مجموعة الأصحاء ظاهرياً (المجموعة الشاهدة) وعددهم 28 فرداً.
2- مجموعة مرضى الفشل القلبي وعددهم 60 مريضاً.
سجلت بيانات المرضى والشواهد في بطاقات استبيان خاصة، متضمنة القصة المرضية والعادات الشخصية من تدخين، الأدوية المتناولة، وبيانات صورة صدى القلب Echocardiography. وجرى استبعاد المرضى الذين خضعوا لعمل جراحي خلال ستة أشهر سابقة والمرضى المصابين بالعداوى والالتهابات وأمراض المناعية الذاتية ومرضى السرطان ومرضى الفشل الكلوي والسكري والمرضى المتناولين لمضادات التهاب خلال الأسبوعين السابقين لأخذ العينة منهم، مع استثناء المرضى الذين يتناولون الأسبرين بجرعات منخفضة.
1ـ المجموعة الشاهدة
شملت 28 فرداً (15 ذكراً + 13 أنثى) أصحاء ظاهرياً ولا يعانون من أمراض قلبية أو ضيق في النفس ولا يراجعون أي مركز طبي، وبلغ المتوسط الحسابي X والخطأ المعياري SE للعمر (X±SE) 68.2±0.98 عاماً.
2ـ مجموعة مرضى الفشل القلبي
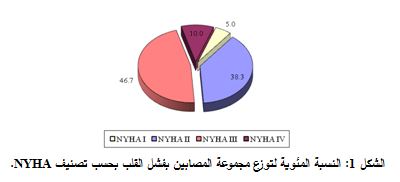
شملت 60 مريضاً (42 ذكراً + 18 أنثى) وكان متوسط أعمارهم ± الخطأ المعياري 61.5±1.51 عاماً. وقسم المرضى من الناحية السريرية إلى 4 مجموعات بحسب تصنيف NYHA الوظيفي: class I NYHA (3 مرضى)، NYHA class II (23 مريضاً)، class III NYHA (28 مريضاً)، class IV NYHA (6 مرضى) (الشكل 1).
بزلت عينات الدم الصيامي (5 مل) لكل من المرضى والشواهد ضمن أنابيب جافة ونبذت بسرعة xg1000 بالدرجة Co 4+ لمدة 15 دقيقة، وزع المصل ضمن3 أنابيب إيبندورف (500 مكل تقريباً في كل أنبوب) وحفظت بالدرجة Co 80- إلى حين إجراء المقايسة.
عينت قيم TNFα و sTNFαRIIالمصلية بطريقة الممتز المناعي المرتبط بالإنزيم (ELISA) Enzyme Linked Immuno Sorbent Assay المعتمدة على مبدأ الشطيرة Sandwich باستخدام عتيدة Kit من شركة Komabiotech الكورية.
الدراسة الإحصائية
استخدمنا اختبار T. student لتقييم الفروقات بين المجموعات إن كانت حقيقية أم ناجمة عن المصادفة، واستخدمنا معامل الارتباط بيرسون لدراسة طبيعة العلاقة بين قيم الجزء المقذوف من القلبEF وقيم كل من تركيز عامل النخر الورمي ألفا TNF-α وتركيز sTNFαRII.
|
 |
| النتائج Results |
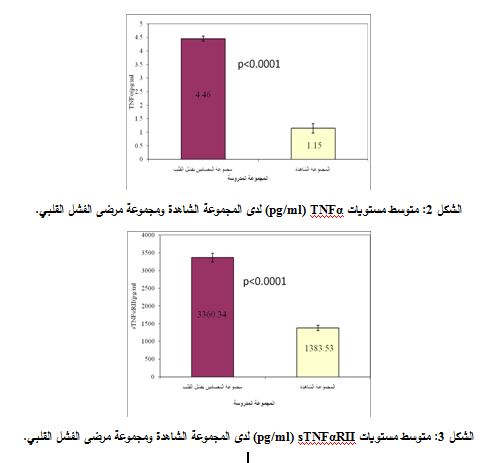
بلغ متوسط قيم TNFα± الخطأ المعياري (SE±X) ±1.150.17 بيكوغرام/ مل لدى مجموعة الشواهد. و (±4.460.09) بيكوغرام/ مل لدى مجموعة مرضى فشل القلب. بلغ متوسط قيم sTNFαRII ± (SE±X) الخطأ المعياري ±1383.5372.05 بيكوغرام/ مل لدى مجموعة الشواهد و±3360.34122.09 بيكوغرام/ مل لدى مجموعة مرضى فشل القلب.
وبتطبيق اختبار T. Student لتحري الفروقات بين مجموعتي مرضى الفشل القلبي والشواهد، تبين وجود فارق يعتد به إحصائياً في مستويات TNFα ومستويات sTNFαRII (P<0.0001). (الشكلان 2 و3).
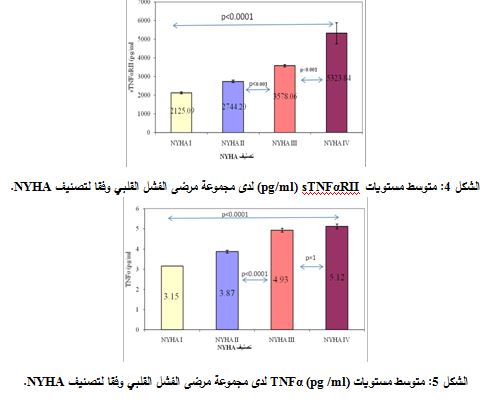
بينت نتائج مقايسة مستويات sTNFαRII المصلية لدى مجموعة مرضى الفشل القلبي، تبعاً لتصنيف NYHA الوظيفي، أن متوسط القيم±الخطأ المعياري لدى مرضى NYHAI هو ±2125.0962.00 بيكوغرام/ مل وهو ±2744.273.72 بيكوغرام/ مل لدى مرضى NYHAII، وهو ±3578.0660.08 بيكوغرام/ مل لدىNYHAIII ، وهو 5323.84 ±562.67 بيكوغرام/ مل لدى مرضى NYHAIV. وبتطبيق اختبار T. Student للمقارنة بين مستويات sTNFαRII، تبعاً لمراحل فشل القلب تبين ازدياد مستويات sTNFαRII بالتوازي مع تقدم تصنيف NYHA (ازدياد شدة فشل القلب)، وبفارق يعتد به بين مرحلة وأخرى، حيث كان الفارق معتد به إحصائياً (P<0.0001( في مستويات sTNFαRII المصلية بين المرحلتين NYHAII و NYHAIII. وكذلك بين المرحلتين NYHAIII وNYHAIV (الشكل 4).
أما عند تطبيق اختبار T-student للمقارنة بين مستويات TNFα تبعاً لمراحل الفشل القلبي فلقد تبين زيادة مستويات TNFα بالتوازي مع تقدم تصنيف NYHA (ازدياد شدة فشل القلب)، حيث ازدادت مستويات TNFα لدى مجموعة مرضى NYHAIII بالمقارنة مع مجموعة مرضى NYHAII (3.87±0.07 ،4.93±0.10، على الترتيب)، وبفارق يعتد به إحصائياً (P<0.0001(. ولكن تزايد هذه المستويات لم يكن معتدا ًبه إحصائياً لدى مرضى NYHAIV (5.12±0.12) مقارنة مع مرضى NYHAIII (4.93±0.1) (P=1.0) (الشكل 5).
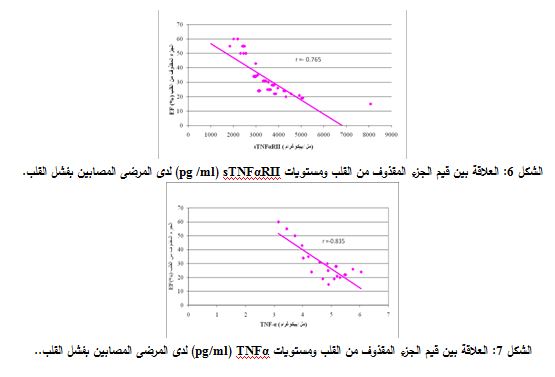
اعتمد معامل الارتباط personلدراسة الارتباط بين مستويات sTNFαRII ومستويات TNFα وقيم الجزء المقذوف من القلب (EF) Ejection Fraction، فبينت دراستنا وجود تناسب عكسي بين sTNFαRII والجزء المقذوف من القلب (0.765-=r) وكذلك تناسب عكسي بين مستويات TNFα والجزء المقذوف من القلب EF (0.835-=r) (الشكلان 6 و7).
|
 |
| المناقشة |
أظهرت دراستنا ارتفاع
تراكيز TNFα وsTNFαRII لدى مرضى فشل القلب مقارنة مع
المجموعة الشاهدة وذلك بفارق يعتد به إحصائياً (P<0.0001(. ويمكن تفسير ارتفاع مستويات TNFα لدى مجموعة مرضى
الفشل القلبي كاستجابة للحالة الالتهابية الحاصلة وإفراز TNFα من الوحيدات، حيث أثبتت الدراسات ارتفاع مستويات
الواصم neopterin، مؤشر عن تفعيل الوحيدات، لدى مرضى الفشل القلبي
(5). ويترافق
هذا مع زيادة في تراكيز مستقبل هذا السيتوكين sTNFαRII. ويتفق هذا مع دراسة Christian stump وزملائه في ألمانيا عام 2003 ودراسة pergola وزملائه عام 2000 (10، 12).
بينت نتائج دراستنا أن المستويات المصلية لـ TNFα وsTNFαRII ترتفع بشكل متزامن مع درجة تطور
المرض القلبي، فمرضى NYHAII كانت التراكيز
لديهم أقل منها لدى مرضى NYHAIII والأخيرة أقل منها لدى مرضى NYHAIV. يمكن تفسير هذا الارتفاع في مستويات TNFα وsTNFαRII بزيادة التأثيرات السيئة على
خلايا العضلة القلبية، والتي تتفاقم بتطور الحالة المرضية، فالتعبير عن TNFα يزداد بزيادة المناطق المتأذية
التي تعمل على إفرازه من عضلة القلب (12). وتوافقت نتائجنا مع دراسة Christian stump عام 2003 (10).
يدعم هذا التفسير
النتيجة التي حصلنا عليها بدراسة
العلاقة بين المستويات المصلية للـ STNFαRII والـ TNFα مع مستويات الجزء المقذوف من
القلبEF، وجدت علاقة ارتباط عكسية بين مستويات sTNFαRIIومستويات TNFαوالجزء المقذوف من القلب، توافقت نتائج دراستنا مع نتائج
دراسة Margit Niethemmer وزملائه عام 8200 (12).
وجدنا من خلال دراسة العلاقة بين ارتفاع مستويات TNFα وRIIαsTNF وتطور شدة المرض ازدياداً معتداً
به إحصائياً (P<0.0001( في مستويات TNFα لدى مرضى NYHAII بالمقارنة مع
مرضى NYHAIII، بينما لم
تكن هنالك زيادةً معتداً بها إحصائياً (P=1.0) في مستويات TNFα لدى مرضـى NYHAIV، بالمقارنة مع مرضى NYHAIII.
أما بالنسبة لمستويات sTNFαRIIفكانت زيادتها معتداً بها إحصائياً (P<0.0001( بين المجموعات المدروسة جميعها.
توافقت نتائج دراستنا مع نتائج دراسة Anita Deswal عام 2001 (9)، لتي شملت 1200 مريضاً مصاباً بالفشل القلبي، وأبدت تلك الدراسة
تزايداًً ملحوظاً غي مستويات sTNFαRIIلدى مرضى NYHAIV، بالمقارنة مع مرضى NYHAIII لكنها لم تبدِ تزايداً ملحوظاً في
مستويات TNFαلدى
مرضى NYHAIV بالمقارنة مع مرضى NYHAIII،
مما دعاهم لاستنتاج أن هذا السيتوكين ليس له دور موثوق لدى مرضى المرحلة النهائية
للفشل القلبي.
لذلك فإنه من الأفضل قياس مستويات المستقبلات الذوابة
لعامل النخر الورمي ألفا، خاصة المستقبل sTNFαRII. وهذا ما أكدته دراسة MarcoTesta وزملائه عام 1996 (7).
أظهرت دراستنا أن ارتفاع مستويات TNFα وsTNFαRII لدى مرضى فشل القلب لا يتعلق
بأسباب الفشل القلبي (كارتفاع الضغط أو نقص التروية أو اعتلال العضلة القلبية الضخامي
مجهول السبب)، حيث لم نجد فارقاً معتداً به إحصائياً بين مستويات هذين الواصمين
لدى مرضى الفشل القلبي لأسباب مختلفة. واتفقت نتائج دراستنا هذه مع دراسة Christian Stump وزملائه عام 2003 (10) واختلفت مع دراسة Anita Deswal وزملائها عام 2001 (9)، فلقد أظهرت ارتفاع تراكيز TNFα وsTNFαRII المصلية بشكل أكبر لدى مرضى فشل
القلب الناجم عن نقص التروية، مقارنة بمرضى اعتلال العضلة القلبية التوسعي. وقد
يعزى ذلك إلى اختلاف مرحلة الإصابة الشريانية التاجية لدى مرضى نقص التروية الحاد
والمزمن. والذي أكدته
نتائج دراسة Mehdi Hassan Zadeh وزملائه عام 2006 (13). والتي أظهرت أن تراكيز TNFα ترتفع بشكل أكبر لدى مرضى فشل
القلب الناجم عن نقص التروية الحاد مقارنة
بمرضى نقص التروية المزمن.
|
| |
| الاستنتاج Conclusion |
|
ترتفع المستويات المصلية للـ sTNFαRII لدى مرضى فشل القلب وبشكل يتناسب مع وخامة المرض. وينصح بمقايسة sTNFαRII المصلي كواصم لترقي الإصابة بفشل القلب وتقييم الحالة الإنذارية للمريض، حيث يعكس ارتفاع مستويات sTNFαRII تراجع الوظيفة القلبية واختطار المرض. ويقترح استهداف TNFα علاجياً لتحسين النتائج السريرية للمريض وإطالة البقيا.
|
| المراجع References |
1-Gibbs C.R; Davies M.K. and Lip Y.H.
ABC of Heart Failure.
1sted' Eds. Gibbs C.R; Davies M.K. and Lip G.Y.H.
BMJ; 1-46, 2000.
2-Dyke D.B. and Koelling T.M.
Heart Failure due to left ventricular systolic dysfunction; Baliga R.R. and Eagle K.A. Practical cardiology: evaluation and treatment of common cardiovascular disorders 2 nded, Eds. Baliga R.R. and Eagle K.A.
Lippincott williams and wilkins; 246-285, 2008.
3-Steven M.S; Mohammad K.H.S; Simon G.W. and James E.F.
Immunological mechanisms of pentoxifylline in chronic heart failure European Journal of Heart Failure; 11 (2): 113-118, 2009.
4-Gullestad L; Ueland T; Vinge L.E; Finsen A; Yndestad A. and Aukrust P.
Inflammatory Cytokines in Heart Failure: Mediator and Marker.
Cardiology, 122 (1): 23-35, 2012.
5-Afreed J.
The cytokines and Heart Failure A Review.
Cardiovascular Journal; 3 (2): 200-212, 2011.
6-Roberto F; Tiziana B; Cristina O; Angelo C. and Odoardo V.
Tumor Necrosis Factor Soluble Receptor in patient With Various Degree of Congestive Heart Failure.
American Heart Association; 92: 1474-1486, 1995.
7-Marco T. et al.
Circulating Levels of Cytokin and Their Endogenous Modulators in Patients with Mild to Sever Congestive Heart Failure Due to Coronary Artery Disease or Hypertension.
JACC; 28 (4): 964-971, 1996.
8-Catherine N. et al.
Soluble Tumor Necrosis Factor Receptor and Heart Failure Risk in Older Adults.
Circulation: Heart Failure, 7: 5-11, 2013.
9-Anita D; Nancy J.P; Arthur M.F; James B.Y; Bill G.W. and Douglas L.M.
Cytokines and cytokine Receptors in Advanced Heart Failure.
American Heart Association; 103: 2055-2059, 2001.
10-Christian S; Christoph L; Atilla Y; Werner G.D. and Christoph D.G.
Decrease of Serum Level of the anti inflammatory cytokine interleukin 10 in patients with advanced chronic heart Failure.
Clinical Science, 105: 45-50, 2003.
11- Niethammera M; Siebera M; Von Haehling S; Anker S; Munzela T; HorstickaG. and Genth-Zotza S.
Inflammatory pathways in patients
with heart failure and preserved ejection fraction.
Int J Cardiol; 129: 111-117, 2008.
12-Pergola V; Disalvo G; Martiniello AR; Irace L; Tedesco MA; Scialdone A. and Lacono A.
TNF alpha and heart Failure.
Minevra Cardioangiol; 48 (12): 475-484, 2000.
13- Mehdi H; Reza F; Marjane M; Farhad F.H. and Alireza R.
Serum Levels of TNF-a, IL6 and Selenium in pateins with Acute and Chronic Coronary Artery Disease.
Iran. J. Immunol; 3(3): 142-145, 2006.
|
| |
| |
| المجلد 7 ,
العددان 3-4
, رمضان 1435 - تموز (يوليو) 2014 |
|
|
|
