| الملخص Abstract |
| تعد سورية من المناطق الموبوءة بداء الليشمانيات الجلدية. ونظراً لعدم وجود أدوية فعالة ومأمونة، فإن الوقاية تكتسب أهمية كبيرة للحد من انتشار هذا الداء.
هدفت دراستنا إلى تعيين قدرة طفيليات الليشمانية المثبطة الانقسام بالميتوميسين-c (MIL) على إعطاء الاستجابة المناعية، التي كُشفت بدراسة حجم الآفات الجلدية، وحمل الطفيلي في الآفات والعقد اللمفية النازحة والتعبير الجيني عن mRNA للـ IL-4 و IFN-γعلى مستوى العقد اللمفية النازحة، لدى الفئران BALB/C الممنعة بـ 104 من طفيليات الليشمانية المثبطة الانقسام بالميتوميسين-c (MIL) أو الممنعة بـ 104 من طفيليات الليشمانية المدارية المحتفظة بفوعتها Wild type (WT). أظهرت الفئران BALB/C الممنعة بـ WT آفات وحملاً طفيلياً في مكان الحقن وعقداً لمفية نازحة، بينما لم تبد تلك الممنعة بـ MIL أية آفات جلدية أو حمل طفيلي في موقع الحقن أو عقد لمفية نازحة. حرضت MIL و WT بشكل معتدٍ به (P=8.7x10-7) مستويات أعلى من IFN-γ بمقدار 16.7 ضعفاً و 4.3ضعفاً، على الترتيب، بالمقارنة مع المجموعة الشاهدة المحقونة بالمصل الفيزيولوجي. وإلى جانب هذا، حرضت MIL و WT بشكل معتدٍ به (P=3.9x10-6) مستويات أعلى من IL-4 بمقدار 6.2 ضعفاً و 20.5ضعفاً، على الترتيب، بالمقارنة مع المجموعة الشاهدة المحقونة بالمصل الفيزيولوجي. أظهرت دراستنا أن WT تحرض استجابة مناعية خلوية يغلب عليها النمط Th2، بينما تحرض MIL استجابة مناعية خلوية يغلب عليها النمط Th1، الذي يُعد إشارة إيجابية مشجعة لاستمرار الدراسة للوصول إلى لقاح مأمون وفعال.
|
The Syria is considered to be endemic regions in cutaneous leishmaniasis. While there are not effective and safe drugs, the prevention is very important to stop dispersing the disease.
Our study aimed to determine the capacity of mitomycin-c treated live leishmania promastigotes (MIL) to produce the immune response, which detected by studying skin lesions volume and parasite load in the lesions and draining lymph nodes and gene expression of mRNA for IFN-γ and IL-4 at the level of draining lymph nodes in BALB/C mice. BALB/C mice were immunized with 104 mitomycin-c treated live leishmania promastigotes (MIL), or immunized with 104 wild type leishmania promastigotes.
BALB/C mice immunized with WT showed lesions and parasite load in the site of injection and draining lymph nodes, while those immunized with MIL do not show any skin lesions or parasite load in the site of injection and draining lymph nodes. MIL and WT induce significantly high levels of IFN-γ 16.7 fold and 4.3 fold, compared with control group which injected with physiological serum. Beside of this, MIL and WT induce significantly high IL-4 levels 6.2 fold and 20.5 fold, compared with control group which injected with physiological serum.
Our study revealed that WT induces Th2 response, while MIL induces Th1 response, which is considered a positive signal to continue studying to reach to an effective and safe vaccine.
|
| المقدمة Introduction |
الليشمانية leishmania هي طفيليات وحيدة الخلية تنتمي إلى عائلة المثقبيات Trypanosomatidae تصيب الإنسان نتيجة لدغة ذبابة الرمل Sand Flies. تعيش هذه الطفيليات داخل خلايا الجهاز الشبكي البطاني للمضيف الفقاري، إما في خلايا الجلد مسببةً داء الليشمانيات الجلدي، أو في الأغشية المخاطية مسببةً داء الليشمانيات الجلدي المخاطي، أو في الأحشاء (الكبد، الطحال، نقي العظم) مؤديةً إلى داء الليشمانيات الحشوي (1).
يشكل داء الليشمانيات أحد المشكلات الصحية الهامة في سورية، خاصة في السنوات الأخيرة، إذ شهد القطر ازدياداً كبيراً في عدد الإصابات المسجلة في عدة محافظات مثل دمشق وريفها، حلب، إدلب، الرقة، حمص، حماة، الحسكة والساحل السوري. فلقد سجلت الإحصائيات مؤخراً إعادة ارتفاع عدد الإصابات من عام 2007 ليسجل أكبر عدد من الإصابات في عام 2011، حيث بلغ 58156 إصابة، مما يستوجب قرع جرس الإنذار، إذ أصبحت سورية في مقدمة دول إقليم شرق المتوسط في تسجيل عدد الإصابات. ونظراً لعدم وجود دواء نوعي فعّال ومأمون، تكتسب الوقاية من الإصابة بهذا الداء أهمية كبيرة ويلعب فيها إيجاد لقاح فعال، ما زال غير متوفر حتى الآن، دوراً كبيراً (2). نشرت العديد من الأبحاث حول لقاحات مختلفة تمت دراستها، لكن لم يتوصل الباحثون إلى لقاح يمتاز بفعاليته ضد أنواع طفيليات الليشمانية جميعها. وبالتالي يكتسب العمل من أجل الوصول إلى لقاح فعال أهمية كبيرة في مجال الوقاية من الإصابة بهذه الطفيليات. وتعد اللقاحات المكونة من طفيليات حية أفضل من اللقاحات المكونة من البروتينات المأشوبة أو من خلاصة الطفيلي المقتول كاملاً، لأن بقاءها في الأنسجة يؤمن ويحقق تزويداً مستمراً بالمستضد يدوم لفترة طويلة وبالتالي يحرض مناعة تستمر لفترة طويلة الأمد (3).
لهذا هدفت دراستنا إلى المساهمة في المحاولات الهادفة للوصول إلى لقاح فعال. ولقد قررنا في سبيل ذلك استقصاء إمكان استخدام طفيليات حية لكن مثبطة الانقسام. فالميتوميسين mitomycin-c يثبط تضاعف DNA مشيقات promastigotes طفيليات الليشمانية، ولقد استخدمناه لتثبيط انقسام سلالة لطفيليات الليشمانية المدارية مأخوذة من بلدنا. وتحرينا قدرة هذه الطفيليات المثبطة والمحقونة للفئران من نمط BALB/C على توليد استجابة مناعية، جرى تقييمها من خلال دراسة حجم الآفات الجلدية وحمل الطفيلي، في كل من مكان حقن الطفيلي والعقد اللمفية النازحة. والتعبير الجيني عن mRNA للـ IL-4 و IFN-γ على مستوى العقد اللمفية النازحة. وجرت مقارنة الاستجابة المناعية التي حرضتها هذه الطفيليات مع الاستجابة المناعية التي حرضتها الطفيليات المُفَوّعَة. وبينت نتائجنا أن حقن الفئران بالطفيليات الحية المُثَبَّطةِ الانقسامِ بالميتوميسين لم يؤد إلى ظهور أية آفة جلدية ووجود أي طفيليات في مكان الحقن وفي العقد اللمفية النازحة، بعد 4 أسابيع. وسمح بتوليد استجابة مناعية خلوية جيدة من النمط Th1 لدى هذه الفئران.
|
| المواد والطرق Materials and Methods |
الطفيليات المستخدمة في الدراسة: استخدمت مشيقات طفيليات الليشمانية المدارية L. tropica. وجرى تكثير مشيقاتها على وسط RPMI-1640 من شركة sigma، الذي أضيف له مصل العجل الجنيني منزوع المتممة بنسبة 10%.
تحديد جرعة الميتوميسينc- الموقفة لتضاعف المشيقات: حُضّر محلولMitomycin-c (Sigma) بتركيز 1000 مكغ/ مل. تمت معالجة 104 من المشيقات المزروعة في وسط RPMI-1640 بتراكيز متزايدة منMitomycin-c لمدة 24 ساعة بدرجة حرارة 26°C. جرى بعدها عد الطفيليات باستخدام عدادة نيوبار، مما سمح بتحديد الجرعة التي تثبط تكاثر الطفيليات خلال 24 ساعة.
الطفيليات المحقونة: جرى حقن الفئران بـ 104 من المشيقات المفوعة المأخوذة من طور الاستتباب أو بـ 104 من المشيقات المفوعة المأخوذة من طور الاستتباب والمعالجة مسبقاً مع الميتوميسسن c-بتركيز 12.7 مكغ/ مل لمدة 24 ساعة. ونبذت الطفيليات السابقة وأعيد تعليقها بـ 100 مكل من المصل الفيزيولوجي مباشرة قبل حقن الفئران.
الفئران المستخدمة: حُقنت فئران BALB/C، أعمارها 8-6 أسابيع، بالطفيليات في أسفل القدم اليمنى تحت الجلد. وقسمت هذه الفئران إلى ثلاث مجموعات تحوي كل منها ست فئران. حيث حُقنت فئران المجموعة الأولى بـ 104 من المشيقات المفوعة والمثبطة الانقسام بالميتوميسينc، وحُقنت فئران المجموعة الثانية بـ 104 من المشيقات المفوعة، وحقُنت فئران المجموعة الشاهدة Control بالمصل الفيزيولوجي.
استخلاص العقد اللمفية من الفئران: أُزيلت العقد اللمفية النازحة، القريبة من مكان الآفة في ساق الفأرة، من الفئران بعد مرور 4 أسابيع على عدوى الفئران بالطفيليات السابقة. وضعت كل عقدة على حده على مرشحة قياس 75 ميكرون. وجرى تثليم العقد بالمشرط وهرسها بمكبس سيرنغ مطاطي. وغُسلت بعدها مرتين بالدارئة الفسفاتية، فنحصل على الخلايا المناعية. أُخذت عقد ثلاث فئران لتحديد حمل الطفيلي وعقد ثلاث فئران لدراسة شدة التعبير الجيني عن الـ IL-4 وIFN-γ.
متابعة تطور الإصابة: جرت المتابعة بقياس مقدار التورم في قدم الفئران المحقونة بالطفيليات السابقة، حيث قمنا بقياس ثخانة قدمي كل فأرة، القدم المحقونة باللقاح والقدم الأخرى غير المحقونة التي اعتبرت كشاهد، بواسطة المسماك caliper، وحُسب الفرق بين ثخانتي القدم المحقونة بالطفيليات والقدم الأخرى لكل فأرة من فئران كل مجموعة. وأُخذنا متوسط هذا الفرق لـ 3 فئران.
تحديد حمل الطفيلي في الإصابات الجلدية والعقد اللمفية النازحة: اعتمدت طريقةlimiting dilution assay لتحديد حمل الطفيلي في الإصابات الجلدية والعقد اللمفية النازحة المعزولين من الفئران المحقونة بالطفيليات السابقة ((4.
استخلاص الـ RNA من العقد اللمفية النازحة: اُستخلص الرنا RNA من الخلايا المناعية المعزولة من العقد اللمفية النازحة، باستخدام عتيدة استخلاص RNA من الخلايا الحيوانية GeneJET RNA Purification من شركة Thermo Scientific. ولقد اتبعت الخطوات العامة للاستخلاص المنصوح بها من قبل الشركة المصنعة. بعدها أُجري الرحلان الكهربائي للعينات على هلامة الآغاروز 1% للتأكد من استخلاص RNA الخلايا. ثم حددنا تركيز RNA في العينات ودرجة نقاوته بقياس الكثافة الضوئية على موجتين بطول 260 nm و 280 nm في المجال فوق البنفسجي لمقياس الطيف الضوئي.
اصطناع الدنا المتممcomplementary DNA (cDNA) : جرى اصطناع cDNAمن 2 مكغ من الـ RNA، الذي استخلص من الخلايا المناعية، باستخدام عتيدة اصطناع الدنا DNA Revert Aid First Strand cDNA Synthesis، من شركة Thermo Scientific. ولقد اتِبعت الخطوات العامة لاصطناع cDNA المنصوح بها من قبل الشركة المصنعة.
تفاعل البوليميراز التسلسلي في الزمن الحقيقيReal-Time PCR : أنجزت تفاعلات Real-Time PCR لدراسة التعبير الجيني عن الـ IL-4 وIFN-γ باستخدام جهازApplied Biosystems وعتيدة Maxima Prob/ROX qPCR Master Mix من شركة Thermo Scientific. وجرى شراء مجموعة من المشرعات Primers من شركة Alpha DNA الكندية. ويبين الجدول 1 أسماء المشرعات المطلوبة لدراسة السيتوكينات وتسلسلها النوكليوتيدي (4).
حُضر حجم نهائي قدره 25µl لكل تفاعل يحوي على 12.5 مكل منMaxima® Probe/ROX Qpcr Master Mix و0.75 مكل لكل من Forward Primer وReverse Primer وProbe و8.5 مكل من الماء الخالي من النوكلياز و 2 مكل cDNA. وبُرمج الجهاز لينجز 40 دورة، بعد إجراء تمسخ أولي بدرجة حرارة Cº95 لمدة10 دقائق. تتألف كل دورة من ثلاث مراحل، مدة كل منها 30 ثانية. جرى التسخين في المرحلة الأولى إلى الدرجة Cº95 وفي الثانية إلى الدرجة Cº60 وفي الثالثة إلى الدرجةC°72 .
الدراسة الإحصائية: جرى التعبير عن القيم بالمتوسط الحسابي X والانحراف المعياري SD.
واعتمد اختبار t-test Student لتحديد في ما إذا كان الفارق بين المتوسطات ناجماً عن الحظ والمصادفة، أم أنه فارق يعتد به إحصائياً، اعتمدت P<0.05 للاعتداد الإحصائي.
|
 |
| النتائجResults |
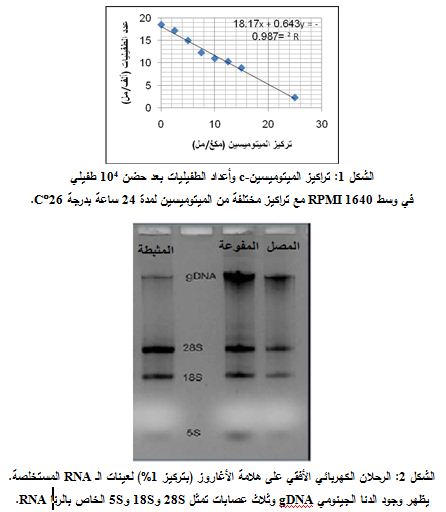
بينت نتائجنا أن الميتوميسين c-يثبط انقسام الطفيليات المدروسة. وتتناسب شدة التثبيط طرداً مع ارتفاع تراكيز الميتوميسين c-المتزايدة كما هو مبيّن في الشكل 1. وحصلنا على معادلة المنحنى البياني التالية: Y = 0.643x + 18.7، للعلاقة بين التراكيز المختلفة من الميتوميسين c- وأعداد هذه الطفيليات بعد 24 ساعة من حضنها مع التراكيز المتزايدة من الميتوميسينc-. وبحساب الجرعة المثبطة لتكاثر 104 من مشيقات الطفيلي وجدنا أنها تساوي 12.7 مكغ/ مل.
من خلال نتائج ترحيل عينات الرنا RNA المستخلص ومعايرتها، جرى التأكد من جودة RNA بالرحلان الكهربائي الأفقي على هلامة الأغاروز (بتركيز 1%)، ثم تعريض الهلامة للأشعة فوق البنفسجية، حيث تبين وجود عصابة رئيسة تمثل DNA الجينومي gDNA وثلاث عصابات تمثل 28S و18S و5S (الشكل 2).
بينت نتائج مقايسة عينات الرنا RNA، باستخدام مقياس الطيف الضوئي، أن تركيز الرنا RNA في العينات كان بحدود 10µg/ml، وتراوحت النسبة A260/A280 بين القيمتين 1.8 و2، مما يشير إلى نقاوة عالية لعينات الرنا RNA المستخلصة. جرت معالجة 2µg من الـ RNA المعزول بـ DNAase للتخلص من الدنا الجينومي الموجود في العينات. ثم استخدم الـ RNA المعالج لتحضير الـ cDNA وفقاً لخطة الشركة المصنعة.
جرى تقييم فعالية التمنيع بالطفيليات السابقة، حيث ظهرت الآفة الجلدية لدى الفئران المحقونة بالمشيقات المفوعة. وبلغ متوسط حجم الآفة 0.29 مم وترافق مع وجود 109 طفيلي في الآفة و108 في العقد اللمفية النازحة. بينما لم تظهر أية إصابة جلدية أو أي طفيلي في مكان الحقن أو في العقد اللمفية النازحة لدى الفئران الممنعة بالمشيقات المفوعة والمثبطة الانقسام بالميتوميسينc-.
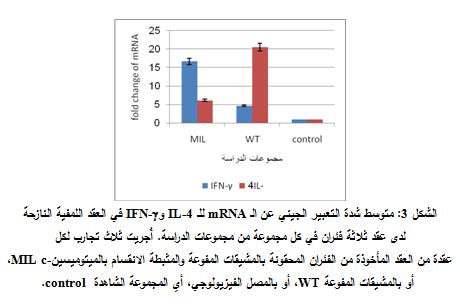
بينت نتائج دراسة شدة التعبير الجيني عن الـ IL-4 وIFN-γ في العقد اللمفية النازحة ارتفاع شدة التعبير عن مورثة IFN-γ بمقدار 4.3 ضعفاً لدى الفئران الممنعة بالمشيقات المفوعة، بالمقارنة مع المجموعة الشاهدة. وارتفاعها بمقدار 16.7 ضعفاً لدى الفئران الممنعة بالمشيقات المفوعة والمثبطة الانقسام بالميتوميسينc-، بالمقارنة مع المجموعة الشاهدة (الشكل 3). وكانت شدة التعبير عن مورثة IFN-γ لدى المجموعة الممنعة بالمشيقات المفوعة والمثبطة الانقسام بالميتوميسينc- أعلى مما هي عليه لدى مجموعة الفئران الممنعة بالمشيقات المفوعة وبشكل معتد به إحصائياً (P = 8.7x10-7 ).
كما أظهرت نتائجنا ارتفاعاً في شدة التعبير عن مورثة IL-4 بمقدار 20.5 ضعفاً لدى الفئران الممنعة بالمشيقات المفوعة، بالمقارنة مع المجموعة الشاهدة، وبمقدار 6.2 ضعفاً لدى الفئران الممنعة بالمشيقات المفوعة والمثبطة الانقسام بالميتوميسينc، بالمقارنة مع المجموعة الشاهدة (الشكل 3). وكانت شدة التعبير عن مورثة IL-4 لدى المجموعة الممنعة بالمشيقات المفوعة أعلى مما عليه لدى مجموعة الفئران الممنعة بالمشيقات المفوعة والمثبطة الانقسام بالميتوميسينc- وبفارق معتد به إحصائياً (P= 3.9x10-6).
|
 |
| المناقشة Discussion |
تلعب المناعة المتواسطة بالخلايا التائية دوراً هاماً في السيطرة على تكاثر الطفيلي كون طفيليات الليشمانية هي طفيليات داخل خلوية مجبرة. تقسم الخلايا التائية المساعدة Th إلى تحت مجموعتين وذلك بناءً على السيتوكينات المنتجة: خلاياTh1 وخلايا Th2. تفرز الخلايا Th1 مجموعة من السيتوكينات أهمها الـIFN-γ ، الذي يقوم بتحريض البلاعم على قتل الطفيلي الموجود داخلها، وذلك من خلال إنتاج مواد كيميائية سامة للطفيلي مثل أكسيد النتريك No ومستقلبات الأكسجين السامة (5). وتفرز الخلايا Th2 مجموعة من السيتوكينات أهمها IL-4 (6)، التي تثبط تشكيل NO داخل البلاعم وبالتالي تثبط قدرة البلاعم على قتل الطفيليات والتخلص منها.
ترتبط الاستجابة المناعية الفعالة تجاه طفيليات الليشمانية بتفعيل خلايا Th1، مما يؤدي إلى مناعة وقائية، بينما يؤدي تفعيل خلايا Th2 إلى ظهور الآفة والتظاهرات المرضية. وبالتالي تتطلب دراسة فعالية أي لقاح مستخدم تحديد نمط الاستجابة المناعية المُحَرَضة، هل هي من نمط Th1 أو Th2 (7). وتوافق تركيز الميتوميسين-c المثبط لانقسام الطفيليات في دراستنا مع تركيز الميتوميسين-c المستخدم لتثبيط تكاثر سلالة الليشمانية المستخدمة في دراسة العموري د. وزملائها عام 2010 (8). كما بينت نتائجنا حدوث ارتفاع بشكل يعتد به في شدة التعبير الجيني عن مورثة IL-4، مقارنة مع المجموعة الشاهدة المحقونة بالمصل الفيزيولوجي. وكذلك ارتفعت شدة التعبير الجيني عن مورثة IFN-γ، مقارنة مع المجموعة الشاهدة المحقونة بالمصل الفيزيولوجي لدى الفئران الممنعة بالمشيقات المفوعة في العقد اللمفية النازحة.
يشير ذلك إلى وجود استجابة مناعية خلوية مختلطة يغلب عليها استجابة من النمط Th2، بسبب القيم المرتفعة لشدة التعبير الجيني عن مورثة IL-4. وتتوافق هذه النتيجة مع اختيار نوع الفئران BALB/C وهي فئران حساسة للإصابة بداء الليشمانية والتي حقنت بالمشيقات المفوعة بدون أية مادة مساعدة، وبالتالي يعد ظهور استجابة مناعية من النمط Th2 أمراً طبيعياً في هذه الحالة (9). وأظهرت دراستنا ارتفاع شدة التعبير الجيني عن مورثة IFN- في العقد اللمفية النازحة لدى الفئران الممنعة بالمشيقات المفوعة والمثبطة الانقسام بالميتوميسينc- وبفارق يعتد به إحصائياً، بالمقارنة سواء مع المجموعة الشاهدة المحقونة بالمصل الفيزيولوجي أو مجموعة الفئران الممنعة بالمشيقات المفوعة. كما سجلنا ارتفاعاً في شدة التعبير الجيني عن مورثة IL-4 في العقد المفية النازحة لدى الفئران الممنعة بالمشيقات المفوعة والمثبطة الانقسام بالميتوميسينc-، بالمقارنة سواء مع المجموعة الشاهدة المحقونة بالمصل الفيزيولوجي أو مجموعة الفئران الممنعة بالمشيقات المفوعة وبفارق يعتد به إحصائياً. يشير ارتفاع شدة التعبير الجيني عن مورثة IFN-γ، والقيم المنخفضة في شدة التعبير الجيني عن مورثة IL-4، إلى وجود استجابة مناعية خلوية مختلطة يغلب عليها استجابة من النمط Th1 وهذا ما يفسر عدم ظهور الآفة الجلدية والطفيليات في مكان الإصابة والعقد لدى مجموعة الفئران الممنعة بالمشيقات المفوعة والمثبطة الانقسام بالميتوميسينc-. وتوافقت نتائجنا مع نتائج دراسة العموري د. وزملائها 2010 التي حرضت فيها المشيقات المفوعة والمثبطة الانقسام بالميتوميسينc- وبالمشاركة مع IL-12، كعامل مساعد، استجابة مناعية خلوية من نمط Th1 8)).
|
| الاستنتاج Conclusion |
| لقد حرضت الليشمانية المدارية المثبطة الانقسام استجابة مناعية خلوية يغلب عليها نمط Th1 لدى الفئران الحساسة BALB/C، مما يعطي مؤشرات إيجابية مشجعة لاستمرار العمل عليها للوصول إلى لقاح مأمون وفعال وهو هدف نقوم بدراسته حالياً. |
| المراجع References |
1-Reithinger R; Dujardin J; Louzir H. et al.
Cutaneous leishmaniasis.
Lancet Infect Dis. 2007; 7: 581-596.
2-Elsheik K. and Eltaweel A.
Epidemiology of Cutaneous leishmaniasis cases in Syria 2011.
Syrian epidemiological bulletin.
3-Clarisa B. and Sousa P.
Vaccines for leishmaniasis in the fore
coming 25 years.
Vaccine. 2008; 26: 1709-1724.
4-Hkima F; Rachinel N; Klimczak M; Doyen N. and Louis J.
TLR9-Dependent Activation of Dendritic Cells by DNA from Resolution of Lesions 1.
J. Immunol. 2009; 182: 1386-1396.
5-Alexander J. and Russell D.G.
The interaction of Leishmania species with macrophages.
Adv Parasitol. 1992; 31: 175-254.
6-Morris L; Aebischer T. and Handman E KA.
Resistance of BALB/c mice to leishmania major infection is associated with a decrease in the precursor frequency of antigen- specific CD4+ cells secreting interleukin-4.
Int Immunol. 1993; 5(7): 761-767.
7-Bogdan C. and Rollinghoff M.
The immune response to Leishmania: mechanisms of parasite control and evasion.
Int. J. Parasitol. 1998; (28): 121-134.
8-Alammoury D; Kweider M; Alokla S. and Maarouf M.
Immunization Trial by Leishmania Treated with Mitomycin-c.
SCLA. 6(2), 2011.
9-Alexander J. and Bryson K.
T helper (h)1/Th2 and Leishmania: paradox rather than paradigm.
Immunol Lett. 99(1): 17-23, 2005.
|
| |
| |
