| الملخص Abstract |
تصيب مقدمات الارتعاج Preeclampsia حوالي 3-10% من النساء الحوامل. وهي أحد الأسباب الأساسية للمراضة morbidity ومعدل الوفيات mortality عند الأم والجنين. وعلى الرغم من أن سبب مقدمات الارتعاج غير معروف، إلا أنه قد يكون ناتجاً عن تحرر عوامل كيميائية من المشيمة إلى دوران الأم، مما يسبب سوء وظيفة الخلايا البطانية، لهذا يحدث ارتفاع ضغط الدم والبيلة البروتينية (1).
هدف هذا البحث إلى تعيين المستويات البلازمية للمستقبل الذواب لعامل النمو الوعائي البطاني (sFlt-1) وعامل النمو المشيمي (PLGF) لدى نساء حوامل سوريات مصابات بمقدمات الارتعاج. ولدى مجموعة شاهدة من النساء الحوامل سويّات الضغط، كونها يمكن أن تكون أداة تشخيصية لتأكيد مقدمات الارتعاج.
شملت الدراسة 80 امرأة حاملاً سورية (40 امرأة حاملاً سوية و40 امرأة مصابة بمقدمات الارتعاج)، من المراجعات لمستشفى التوليد وأمراض النساء الجامعي في دمشق. جُمعت عينات الدم وقيست التراكيز البلازمية لعامل النمو المشيمي (PLGF) والمستقبل الذواب لعامل النمو الوعائي البطاني (sFlt-1) بعتائد kits مقايسة الممتز المناعي المرتبط بالإنزيم (ELISA) (R&D Systems, Inc., USA).
كانت مستويات المستقبل الذواب لعامل النمو الوعائي البطاني sFlt-1 لدى المصابات بمقدمات الارتعاج أعلى منها لدى النساء الحوامل السويات (p<0.001)، بينما كانت تراكيز عامل النمو المشيمي لدى الحوامل المصابات أقل منها لدى الحوامل السويات (p<0.001). وجدت كذلك علاقة ارتباط إيجابية بين تراكيز المستقبل الذواب لعامل النمو الوعائي البطاني وقيم الضغط الشرياني الانقباضي (R=0.757; p<0.05) والانبساطي (R=0.864; p<0.05). ووجدت علاقة ارتباط سلبية بين تراكيز عامل النمو المشيمي وقيم الضغط الشرياني الانقباضي ((R=-0.446; p<0.05 والانبساطي (R=-0.467; p<0.05).
وجدنا أن مستويات المستقبل الذواب لعامل النمو الوعائي البطاني أعلى لدى المصابات بمقدمات الارتعاج، بينما كانت مستويات عامل النمو المشيمي لديهن أقل مقارنة مع الحوامل السويات، مما يقترح أن هذه العوامل يمكن أن تلعب دوراً في إمراضية مقدمات الارتعاج، ويمكن أن تُستخدم كأداة لتأكيد تشخيص مقدمات الارتعاج.
|
Background: preeclampsia affect about 3-10% of pregnant women. It is one of the main causes for mortality and morbidity for mother and fetus. although the cause of preeclampsia is unknown ;but it may caused by releasing of chemical factors from placenta to the circulation of mother that lead to endothelial dysfunction; so hypertension and protein-urea happen (1).
This research aimed to determine plasma levels of soluble receptor of vascular endothelial growth factor (sFlt-1) and placental growth factor (PLGF) in Syrian pregnant women affected by preeclampsia and a control group of normotensive pregnant women. As they maybe a diagnostic tool to confirm preeclampsia.
The Study included 80 Syrian pregnant women (40 normotensive pregnant women and 40 preeclamptic women), referred University Hospital of Obstetrics and Gynecology in Damascus. Blood samples were collected and plasma concentrations of PLGF and sFlt-1 were assayed by ELISA kits (R&D Systems, Inc., USA).
In preeclamptic women, levels of sFlt-1 were higher than normotensive women (p<0.001), while PLGF levels were lower in preeclamptic women than normotesive (p<0.001). We found positive relationship between sFlt-1 and systolic blood pressure (R=0.757; p<0.05) and diastolic blood pressure (R=0.846; p<0.05); and negative relationship between PLGF levels and systolic blood pressure (R=-0.446; p<0.05) and diastolic blood pressure (R=-0.467; p<0.05).
We found that sFlt-1 levels were higher in Syrian preeclamptic women, while PLGF levels were lower, as compared with normotesive Syrian pregnant women, suggesting that these factors may play an important role in the pathogenesis of preeclampsia, and they can be used as a tool to confirm diagnosis of preeclampsia.
|
| المقدمة Introduction |
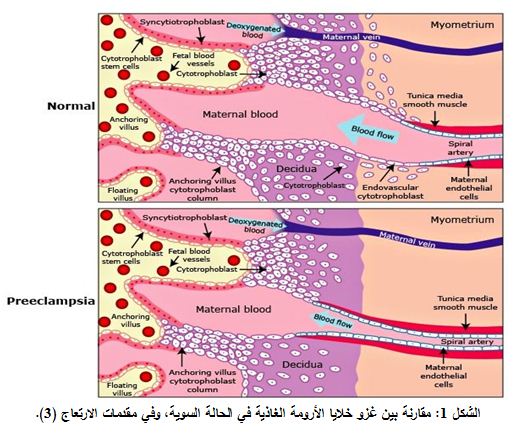
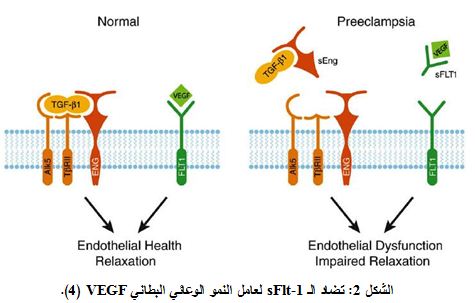
تعرف مقدمات الارتعاج Preeclampsia بأنها ارتفاع في الضغط الشرياني، أكبر أو يساوي 140/90 ملم زئبقي وبيلة بروتينية أكبر أو تساوي 300 مغ في بول 24 ساعة، أو +1 باختبار الغميسة dipstick بعد الأسبوع 20 من الحمل (1). وهي حالة مرضية للحمل تصيب حوالي 3-10% من النساء الحوامل، كما أنها إحدى الأسباب الرئيسية للمراضة morbidity ومعدل الوفيات mortality لدى الأم والجنين (2). وعلى الرغم من أن إمراضية العدوى غير محددة بدقة، إلا أن خلل وظيفة الخلايا البطانية قد يلعب دوراً مهماً في هذه الحالة، حيث أن الغزو المعيب لخلايا الأرومة الغاذية trophoblastic invasion يعد الخطوة الأولى في خلل وظيفة الخلايا البطانية في مقدمات الارتعاج؛ يتلو ذلك نقص في التروية الدموية الرحمية المشيمية نتيجة للانغراس الضحل shallow لخلايا الأرومات الغاذية، مما يؤدي إلى نقص أكسجة وتحرر مجموعة عوامل كيميائية من المشيمة إلى الجريان الدموي للأم مثل المستقبل الذواب لعامل النمو الوعائي البطاني Soluble vascular endothelial growth factor (sVEGFR) or soluble fms like tyrosine kinase (sFlt-1). كل ذلك يسبب خللاً في وظيفة الخلايا البطانية وظهور السمات السريرية لمقدمات الارتعاج وهي ارتفاع الضغط الشرياني والبيلة البروتينية (الشكلان 1 و2) (3، 4).
إن عامل النمو الوعائي البطاني (VEGF) Vascular endothelial growth factor هو بروتين سكري مثنوي Dimer مرتبط بروابط ثنائية الكبريت، يتراوح وزنه الجزيئي بين 34 و42 كيلو دالتون (5). وهو يعد مولداً قوياً للأوعية angiogenic بالإضافة إلى قدرته على زيادة نفوذيتها، كما يساعد في تكاثر وهجرة الخلايا البطانية وبقائها (6). وله دور في تخفيض الضغط الشرياني ويعمل على تشكيل وحماية حواجز الترشيح الكبيبية. بالتالي فإن عوزه يفسر المظاهر السريرية الرئيسية في مقدمات الارتعاج وهي ارتفاع الضغط الشرياني والبيلة البروتينية (7).
تضم عائلة عامل النمو الوعائي البطاني VEGF عند البشر خمسة أصناف (8) هي:
VEGF-A; VEGF-B; VEGF-C; VEGF-D; PLGF (Placenta growth factor)
و هي ترتبط بثلاثة أنواع من المستقبلات هي:
VEGFR1 أو fms-like tyrosine kinase Flt-1،
VEGFR2 أوkinase domain receptor KDR،
VEGFR3 المحفز لتولد الأوعية اللمفية.
ولمستقبل VEGFR1 نمطان: الأول عبر غشائي transmembranous والثاني ذواب. ينتج الشكل الذواب عن التضفير المتفاوت alternative splicing لجين Flt-1. وهو يضم الجزء خارج الخلوي، لكنه يفتقد الأجزاء عبر الغشائية والهيولية. إن الشكل الذواب sFlt-1 قادر على الارتباط بعامل النمو الوعائي البطاني VEGF وعامل النمو المشيمي PLGF، مما يمنعها من الارتباط بمستقبلاتها على سطح الخلايا البطانية وبالتالي إلغاء دورها الفيزيولوجي (9).
إن بنية عامل النمو المشيمي تماثل بشكل كبير بنية الـ VEGF-A، إلا أنهما يختلفان ببعض الخصائص، فعامل النمو المشيمي له أربعة أنماط وجميعها ترتبط بـ Flt-1 وليس بـ VEGFR2. كما يعتقد أنه عامل نمو قوي للأوعية وذلك من خلال تضخيم إشارة VEGF، بإزاحته عن المستقبل Flt1 وجعله يرتبط بالمستقبل VEGFR2 بدلاً عنه (10).
تعرّف مقدمات الارتعاج في الولايات المتحدة الأمريكية حسب البرنامج الوطني للتثقيف بارتفاع الضغط Pressure National High Blood Education Program (11)، بضغط انقباضي أكبر أو يساوي 140 ملم زئبقي وضغط انبساطي أكبر أو يساوي 90 ملم زئبقي وذلك في قياسين منفصلين بفارق 6 ساعات على الأقل، بالإضافة إلى بيلة بروتينية أكبر أو تساوي 0.3 غرام في بول 24 ساعة أو +1 باختبار الغميسة dipstick في قياسين منفصلين بفارق 6 ساعات على الأقل، بعد الأسبوع 20 من الحمل. أما في تعريف الجمعية العالمية لدراسة ارتفاع الضغط في الحمل International Society for the Study of Hypertension in Pregnancy فيكون الفاصل 4 ساعات (12).
هدف البحث: يهدف البحث إلى تحديد المستويات البلازمية للمستقبل الذواب لعامل النمو الوعائي البطاني sFlt-1 وعامل النمو المشيمي PLGF لدى نساء حوامل سوريات مصابات بمقدمات الارتعاج ومجموعة أخرى من النساء الحوامل سويّات الضغط.
|
 |
| المواد والطرق Materials and Methods |
شملت الدراسة 80 امرأة سورية حامل توزعت كما يلي:
1- 40 امرأة حامل مشخّصة بالإصابة بمقدمات الارتعاج (ضغط الدم أكبر أو يساوي 140/90 مم زئبقي، والبيلة البروتينية أكبر من +1 باختبار الغميسة dipstick بقياسين متتابعين بفاصل 4 ساعات على الأقل). جرى استبعاد الحوامل المصابات بارتفاع ضغط مزمن أو أمراض قلبية أو أمراض غدة درقية أو صرع أو أمراض كلوية.
2- 40 امرأة حامل سوية الضغط، أعمارهن وأعمار حمولهن قريبة من الحوامل المصابات بمقدمات الارتعاج. ويبيّن الجدول 1 سمات المشاركات في البحث.
|
| الاعتيان Sampling |
جُمعت العينات من مستشفى التوليد وأمراض النساء الجامعي في دمشق، خلال الفترة بين 28/9 /2012 و15/10 /2013، بعد قبول الحوامل المصابات بناء على تشخيص الأطباء في المستشفى (وفق تعريف البرنامج الوطني للتثقيف بارتفاع الضغط لعام 2000 (National High Blood Pressure Education Program; 2000). حيث كان معيار الضغط الانقباضي ≥ 140 مم زئبقي والضغط الانبساطي ≥ 90 مم زئبقي وبيلة بروتينية ≥ 300 مغ في بول 24 ساعة أو ≥ +1 باختبار الغميسة dipstick وذلك بعد الأسبوع 20 من الحمل. وجرى قبول الحوامل الأسوياء ذوات عمر حملي قريب من العمر الحملي للحوامل المصابات، حيث بلغ متوسط عمر الحمل لدى النساء المصابات 34.5 أسبوعاً، بينما كان 35.3 أسبوعاً لدى الحوامل الأسوياء. وجرى استبعاد الحوامل المدخنات والمصابات بالداء السكري من مجموعة الأسوياء.
بُزل الدم الوريدي ضمن أنبوب يحتوي مضاد تخثر EDTA، جرى التنبيذ لمدة 15 دقيقة بسرعة 1000Xg خلال 30 دقيقة من بزل الدم. ثم فصلت البلازما ووضعت ضمن أنابيب ايبندورف، أنبوب لكل واصم. وجمدت العينات بالدرجة -80C.
جرى تعيين تركيز كل من الواصمات sFlt-1 وPLGF باستخدام العتائد التالية:
sFlt-1: Catalog Number DVR100B; R&D Systems; Inc; Minneapolis; United States of America.
PLGF: Catalog Number DPG00; R&D Systems; Inc; Minneapolis; United States of America.
|
 |
| التحليل الإحصائي Statistical Analysis |
جرت الدراسة وفق نموذج دراسة حالة شاهد Case-Control Study. وأُجريت العمليات الإحصائية على البيانات باستخدام برنامجIBM SPSS Statistics 19 وبرنامج Excel 2007.
وجدنا بتطبيق اختبار Kolmogorov-Smirnov أن البيانات لعامل النمو المشيمي (PLGF) وللمستقبل الذواب لعامل النمو البطاني الوعائي (sFlt-1) لا تتبع التوزع الطبيعي. لذلك استخدم الاختبار اللامتثابتي (nonparametric test) Mann-Whitney U test، لتحديد ما إذا كان الاختلاف بين المجموعتين عائداً للصدفة أم أنه معتد به إحصائياً (P< 0.05). وجرى التعبير عن القيم باستخدام الوسيط Median. واستخدم معامل ارتباط بيرسون Person لمعرفة شدة الارتباط وجهته بين المتغيرات.
|
| النتائج Results |
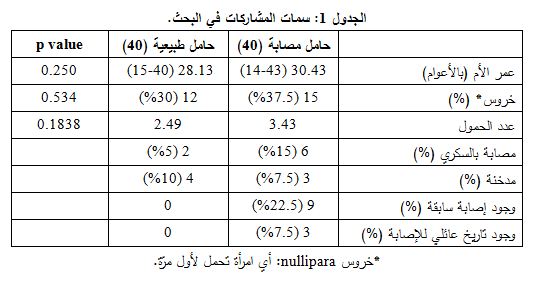
كانت مستويات المستقبل الذواب لعامل النمو الوعائي البطاني sFlt-1 لدى المصابات بمقدمات الارتعاج أعلى من تلك المشاهدة لدى النساء الحوامل السويات (p< 0.001) (الوسيط: 11992.89 و4809.778 بيكوغرام/مل، على الترتيب. ومجال القيم 393.33-30770 و-596 7800 بيكوغرام/مل، على الترتيب) (الشكل 3).
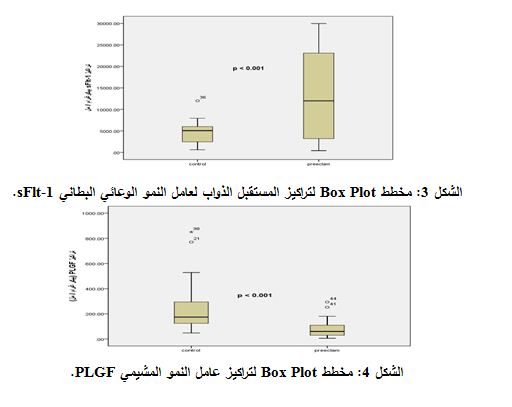
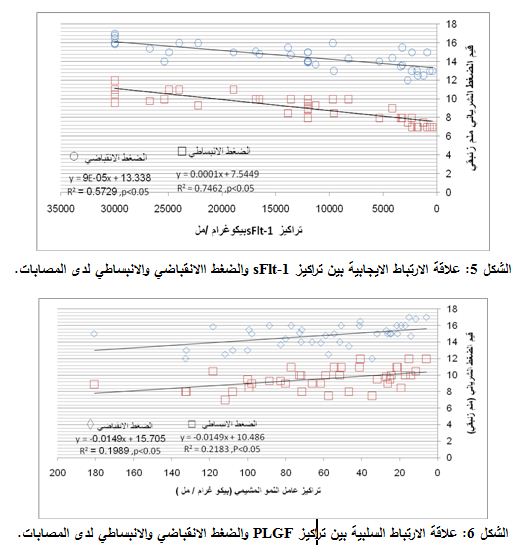
بينما كانت تراكيز عامل النمو المشيمي PLGF لدى الحوامل المصابات أقل من تلك المشاهدة لدى النساء الحوامل السويات (p < 0.001) (الوسيط: 60.14815 و174.037 بيكوغرام/مل، على الترتيب. ومجال القيم: 5.889-180 و47.74074-550.33 بيكوغرام/ مل، على الترتيب) (الشكل 4). كذلك أظهرت نتائجنا وجود علاقة ارتباط إيجابية يعتد بها إحصائياً بين مستويات الـ sFlt-1 وكل من مستويات الضغط الانقباضي (R=0.757; p<0.05) والضغط الانبساطي (R=0.864; p<0.05) لدى النساء المصابات بمقدمات الارتعاج (الشكل 5). بينما وجدنا علاقة ارتباط سلبية بين تراكيز عامل النمو المشيمي وكل من الضغط الانقباضي (R= - 0.446; p<0.05) والضغط الانبساطي (R= - 0.457; p<0.05) (الشكل 6).
|
 |
| المناقشة Discussion |
وجدنا ارتفاعاً واضحاً يعتد به احصائياً (p<0.001) في مستويات sFlt-1 عند النساء المصابات بمقدمات الارتعاج، بالمقارنة مع الحوامل سويات الضغط. يمكن أن يعود ذلك إلى نقص التروية الدموية المشيمية لدى المصابات بمقدمات الارتعاج، حيث أن الغزو المعيب لخلايا الأرومة الغاذية لدى المصابات بمقدمات الارتعاج يسبب بقاء الشرايين الحلزونية ضيقة اللمعة وبالتالي تنقص التروية المشيمية ويحدث الكرب التأكسدي oxidative stress، الذي يعتقد أنه المسؤول عن إنتاج sFlt-1 من المشيمة وبالتالي زيادة مستوياته المصلية (13). ولقد أشارت دراسة Clark وزملاؤه (14) إلى وجود Flt-1 بشكليه الذواب والغشائي بتراكيز عالية في المشيمة، وعُثر على sFlt-1 في السائل الطافي لمزارع خلايا الزغابات المشيمية. كذلك لاحظ Maynard وجود زيادة في مستويات الرنا RNA المرسال المشفّر له في خلايا مشيمية مأخوذة من نساء مصابات بمقدمات الارتعاج (15).
كما وجدنا انخفاضاً ملحوظاً يعتد به احصائياً في
مستويات عامل النمو المشيمي PLGF لدى النساء المصابات بمقدمات الارتعاج، بالمقارنة مع الحوامل سويات الضغط (p<0.001). ويفسر ذلك بأن الـ sFlt-1 يعمل كمصيدة تحتجز عامل النمو الوعائي البطاني VEGF وعامل النمو المشيمي PLGF، مما يؤدي إلى انخفاض مستوياتهما المصلية بسبب ارتفاع مستويات sFlt-1 لدى المصابات (16). كما يمكن تفسير وجود علاقة ارتباط إيجابية بين تراكيز sFlt-1 ومستويات الضغط الانقباضي والانبساطي لدى المصابات وعلاقة ارتباط سلبية بين مستويات عامل النمو المشيمي ومستويات الضغط الانقباضي والانبساطي لديهن، بأن زيادة مستويات sFlt-1، الذي يعمل كمصيدة لعامل النمو الوعائي البطاني وعامل النمو المشيمي، يؤدي إلى انخفاض مستوياتهما. وبما أن هذين العاملين ضروريان لإنتاج أكسيد الأزوت والبروستاسيكلينات الموسعة للأوعية في الخلايا البطانية، فإن انخفاض مستوياتهما يؤدي إلى ارتفاع الضغط (17). وتوافقت دراستنا مع دراسة Levine وزملائه عام 2006 (18)، ودراسة ARUGHESE وزملائه عام 2010 (19)، ودراسة Hanitaوزملائه عام 2014 (20).
|
| الاستنتاج Conclusion |
| أظهرت نتائجنا ارتفاعاً واضحاً في مستويات المستقبل الذواب لعامل النمو الوعائي البطاني وانخفاضاً في مستويات عامل النمو المشيمي لدى المصابات بمقدمات الارتعاج، مقارنة مع الحوامل السويات، مما يقترح أن هذه العوامل قد تشكل أدوات مهمة لتأكيد التشخيص كون تشخيص مقدمات الارتعاج يعتمد على عوامل قليلة النوعية (ارتفاع ضغط الدم والبيلة البروتينية). |
| المراجع References |
1-Steegers EA; von Dadelszen P; Duvvekot JJ. and Pijnenborg R.
Preeclampsia.
Lancet, 2010; 376: 631-644.
2-Dekker GA. and Sibai BM.
Etiology and pathogenesis of preeclampsia: Current concepts.
Am J Obstet Gynecol, 1998; 179: 1359-1375.
3-Lam C; Lim KH. and Karumanchi SA.
Circulating angiogenic factors in the pathogenesis and prediction of preeclampsia.
Hypertension, 2005, 46: 1077.
4-Karumanchi SA. and Epstein FH.
Placental ischemia and soluble fms-like tyrosine kinase 1: cause or consequence of preeclampsia?
Kidney Int. 2007, 71: 959-961.
5-Senger DR; Van de Water L; Brown LF; Nagy JA; Yeo KT; Yeo TK. et al.
Vascular permeability factor (VPF; VEGF) in tumor biology.
Cancer Metastasis Rev; 1993; 12: 303-324.
6-Ferrara N; Gerber HP. and Le Couter J.
The biology of VEGF and its receptors.
Nat Med; 2003; 9: 669-676.
7-Eremina V; Sood M; Haigh J; Nagy A; Lajoie G; Ferrara N. et al.
Glomerular-specific alterations of VEGF-A expression lead to distinct congenital and acquired renal diseases.
J Clin Invest; 2003; 111: 707-716.
8-Shibuya M.
Structure and function of VEGF/VEGF-receptor system involved in angiogenesis.
Cell Struct Funct. 2001; 26: 25-35.
9-Kendall RL. and Thomas KA.
Inhibition of vascular endothelial cell growth factor activity by an endogenously encoded soluble receptor.
Proc Natl Acad Sci USA, 1993; 90: 10705-10709.
10-Ahmad S. and Ahmed A.
Elevated placental soluble vascular endothelial growth factor receptor-1 inhibits angiogenesis in preeclampsia.
Circ Res. 2004, 95: 884-891.
11-Gifford R.
Working group report on high blood
pressure and pregnancy.
Washington; DC: National Institutes of Health, 2000.
12-Davey DA. and MacGillivray I.
The classification and definition of the hypertensive disorders of pregnancy.
Am J Obstet Gynecol. 1988; 158: 892-898.
13-Hubel CA.
Oxidative stress in the pathogenesis of preeclampsia.
Proc Soc Exp Biol Med. 1999; 222: 222-235.
14-Clark DE; Smith SK; He Y; Day KA; Licence DR; Corps AN; et al.
A vascular endothelial growth factor antagonist is produced by the human placenta and released into the maternal circulation.
Biol Reprod, 1998; 59: 1540-1548.
15-Maynard SE; et al.
Excess placental soluble fms-like tyrosine kinase 1 (sFlt1) may contribute to endothelial dysfunction; hypertension; and proteinuria in
preeclampsia.
J Clin Invest. 2003; 111: 649-658.
16-Karumanchi SA. and Epstein FH.
Placental ischemia and soluble fms-like tyrosine kinase 1: cause or consequence of preeclampsia?
Kidney Int. 2007; 71: 959-961.
17-He H; Venema VJ; Gu X; Venema RC; Marrero MB. and Caldwell RB.
Vascular endothelial growth factor signals endothelial cell production of nitric oxide and prostacyclin through flk-1/KDR activation of
c-Src.
J Biol Chem. 1999; 274: 25130- 25135.
18-Levine RJ; Lam C; Qian C. et al.
Soluble endoglin and other circulating antiangiogenic factors in preeclampsia.
N Engl J Med; 2006, 355: 992
19-Varughese B; Bhatlan N; Kumar R; Dwivedi S. and Dhingra R.
Circulating angiogenic factors in pregnancies complicated by pre-eclampsia.
The national medical journal of India. 23, 2, 2010.
20-Hanita O; Alia N. and Zaleha A.
Serum soluble FMS-like tyrosine kinase 1 and placental growth factor concentration as predictors of preeclampsia in high risk pregnant
women.
Malaysian J Pathol; 2014; 36(1): 19-26.
|
| |
