| المجلد 7 ,
العددان 7-8
, رمضان 1436 - تموز (يوليو) 2015 |
| |
دراسة الارتباط بين التعدد الشكلي لجين مستقبل الفيتامين د ApaI
وتخلخل العظم لدى نساء سوريات بعد سن الإياس
|
| Study of Association between Vitamin D Receptor Gene ApaI Polymorphism and Osteoporosis in Postmenopausal Women in Syria |
| د. مصطفى محمد و أ. د. شادن حداد |
| Mohammad M. and Haddad Sh. |
كلية الصيدلة، جامعة دمشق
Faculty of Pharmacy, Damascus University |
| الملخص Abstract |
يعد تخلخل العظم مرضاً متعدد العوامل، يزداد انتشاره بشكل مضطرد بالتوازي مع زيادة العمر المتوقع وخاصة عند النساء بعد سن الإياس. تشير العديد من الدراسات إلى دور العوامل الجينية في تخلخل العظم، وخاصة التعدد الشكلي لجين مستقبل الفيتامين د polymorphism VDR.
هدف هذه الدراسة هو استقصاء الارتباط بين التعدد الشكلي لجين مستقبل الفيتامين د ApaI والاستعداد الجيني للإصابة بتخلخل العظم لدى نساء سوريات بعد سن الإياس.
شملت الدراسة 93 امرأة بعد سن الإياس، 53 امرأة منهن يعانين من تخلخل العظم و40 امرأة منهن كانت قيمة T-score لديهن سوية. أجري تنميط جيني للمشتركات جميعهن من أجل تحديد النمط الجيني ApaI بإجراء تفاعل البوليميراز السلسلي وتحليل تعدد أشكال الشدف مقيدة الطول restriction fragment length polymorphism (RFLP) باستخدام إنزيم ApaI.
كان تواتر الأنماط الوراثية AA، Aa، aa لدى مجموعة المرضى 56.6%، 24.5%، 18.9%، على الترتيب. بينما كان تواترهم لدى المجموعة الشاهدة 30%، 67.5%، 2.5%، على الترتيب. وكان الاختلاف في توزع الأنماط الجينية بين مجموعة المريضات والمجموعة الشاهدة معتداً به (P<0.0001). وكان هنالك ارتباط بين النمط الجيني AA والإصابة بتخلخل العظم.
أظهرت هذه الدراسة وجود علاقة بين الكثافة العظمية وتعدد شكلي ApaI لجين الـ VDR لدى مجموعة من السيدات السوريات بعد سن الإياس.
|
Osteoporosis is a multifactorial disease, its prevalence increases steadily in parallel with the increase of life expectancy, especially in postmenopausal women. Several studies suggest the role of genetic factors in osteoporosis, especially polymorphism of the vitamin D receptor gene.
The aim of this study is to investigate association between VDR ApaI polymorphism and the genetic susceptibility to osteoporosis in Syrian postmenopausal women.
The study included 93 women after menopause, 53 of them suffer from
osteoporosis, while 40 of them were with normal T-score value. Both groups were genotyped for the ApaI single nucleotide polymorphism, by polymerase chain reaction, and restriction fragment length polymorphism analysis by using ApaI enzyme.
The frequencies of AA, Aa and aa genotypes (ApaI polymorphism) in patients were 56.6%, 24.5% and 18.9%, respectively. While, in control groups, their frequency was 30%, 67.5% and 2.5%, respectively. This difference in distribution between patients and controls was statistically significant (P>0.0001). There was association between AA genotype and osteoporosis.
This study showed a correlation between bone density and ApaI polymorphism of the VDR gene in a group of postmenopausal Syrian women.
|
| المقدمة Introduction |
إن تخلخل العظم مرض شائع يتميز بنقص في كتلة العظم مع اضطراب في البناء الدقيق للعظم مؤدياً إلى زيادة في اختطار الكسور (1). وهو يعد حالياً مشكلة صحية واجتماعية هامة ويتوقع ازدياد نسبة وقوعه في السنوات القادمة بالتوازي مع ازدياد متوسط العمر المتوقع (2).
وفقاً للجمعية العالمية لتخلخل العظم، ستتعرض امرأة من كل ثلاث نساء فوق سن الـ 50 سنة إلى كسر مرتبط بتخلخل العظم مقارنة مع نسبة أقل لدى الرجال. تصل نسبة الوفيات في كسور الورك إلى 20-24% وذلك خلال السنة الأولى من التعرض للكسر (3)، حيث أشارت الجمعية العالمية لتخلخل العظم (IOF) International Osteoporosis Foundation إلى وجود نقص في الإحصاءات الرسمية المتعلقة بإصابات تخلخل العظم في سورية، مع عدم وجود سجل وطني خاص بكسور الهشاشة في الوقت الحالي. ولكن يقدر أن حوالي 4000 كسر في الورك يحصل سنوياً في سورية وسيرتفع هذا العدد إلى 5500 في عام 2020. تقدر مدة الانقطاع عن العمل بعد الإصابة بكسر الورك بستة أشهر، حيث يستعيد 50% فقط من المرضى أسلوب حياتهم الطبيعي. كذلك يقدر أن حوالي 15000 كسر فقري يحدث سنوياً في سورية (4).
يعد تخلخل العظم مشكلة صحية أساسية لدى النساء بعد سن الإياس، حيث يلعب اختلال التوازن الهرموني الحاصل بعد سن الإياس دوراً هاماً في الإمراضية (5)، فعوز الإستروجين بعد الإياس يؤدي إلى تناقص في نشاط إنزيم 1-α hydroxylase الذي يحول 25-OH Vitamin D إلى 1, 25, (OH)2 Vitamin D (الشكل الفعال) الذي يلعب دوراً أساسياً في استتباب كالسيوم العظم (6). يلعب فيتامين د دوره من خلال التأثير على مستقبلاته VDR، التي تنتمي إلى عائلة المستقبلات الهرمونية النووية، حيث يقوم بتعديل انتساخ الجينات الهدف التي تساعد في قبط الكالسيوم وتشكل العظم (1).
على الرغم من أن تخلخل العظم مرض متعدد العوامل إلا أن العوامل الجينية تلعب دوراً هاماً في الإمراضية. تعد جين مستقبل الفيتامين د أول الجينات التي جرى دراسة ارتباطها مع تخلخل العظم وكان الاهتمام منصباً على التعددات الشكلية المتوضعة قرب 3′ flank والتي يجري تحديدها من خلال إنزيمات الاقتطاع TaqI، ApaI،BsmI (7).
يوجد تباين في نتائج الأبحاث المجراة للارتباط المحتمل بين تخلخل العظم لدى النساء بعد سن الإياس والنمط الجيني لمستقبل الفيتامين د، حيث يمكن أن يعود هذا التباين في نتائج الدراسات إلى المجموعات العرقية المختلفة والتوزعات السكانية الجغرافية المختلفة (8).
إن مجموعة العوامل السابقة بالإضافة إلى عدم وجود دراسات تدرس الارتباط بين التعدد الشكلي لجين مستقبل الفيتامين د وتخلخل العظم لدى النساء بعد سن الإياس في سورية، دفعنا لإجراء هذه الدراسة للاستقصاء عن الارتباط بين التعدد الشكلي ApaI لجين مستقبل الفيتامين د وتخلخل العظم لدى النساء بعد سن الإياس في سورية.
|
| المواد والطرق Materials and Methods |
صممت هذه الدراسة لتكون استباقية مقطعية Prospective cross sectional study. ولقد أجريت هذه الدراسة في مستشفى الأسد الجامعي بدمشق، في الفترة الممتدة بين شهر تشرين الأول من عام 2012 إلى شهرحزيران عام 2014.
شملت هذه الدراسة 93 أنثى بعد سن الإياس وكان متوسط أعمارهن ± الانحراف المعياري: 52.71±2.71 عاماً. وكان من بينهن 53 أنثى تشكو من تخلخل عظم في الفقرات وعنق الفخذ (اعتماداً على معايير منظمة الصحة العالمية WHO حيث يجب أن تكون قيمة T-score أقل من -2.5 SD) و40 أنثى لديهن BMD سوية (قيمة T-score أكبر أو يساوي -1 SD). وجرى تقديم شروح وافية عن الدراسة للمشتركات جميعهن، حيث رفضت 14 سيدة الاشتراك في الدراسة على الرغم من ملاءمتهن لمعايير الدراسة بسبب تخوفهن من عملية بزل الدم. واستبعدت 47 أنثى من الدراسة، على الرغم من أن نتائج قياس الكثافة العظمية لديهن كانت مناسبة لدراستنا، وذلك وفقاً لمعايير الاستبعاد exclusion criteria التي تضمنت الأمراض جميعها التي تؤثر على استقلاب العظم (أمراض الدرق والدريقات وأمراض الكبد والكلية المزمنة والْتِهابُ المَفاصِلِ الرُّوماتويديّ والخباثات بشكل عام، وأمراض المناعة الذاتية والسكري "نمط Ι أو نمط ΙΙ" والربو) وذلك لتأثر هذه الأمراض بالتعددات الشكلية لجين مستقبل الفيتامين د، كما جرى استبعاد النساء المعالجات بأي أدوية تؤثر على بناء العظم مثل الستيرويدات السكرية، الاستروجين، الكالسيتونين، البيسفوسفونات، مضادات الاختلاج أو أي أدوية أخرى لها تأثير على الاستقلاب العظمي.
جرى الحصول على الموافقة المستنيرة Informed Consent من قبل المشتركات في الدراسة جميعهن.
قياس الكثافة المعدنية العظمية
BMD measurements
جرى قياس الـ BMD لكل من المريضات والعينة الشاهدة بوساطةdual energy X-ray absorptiometry، لكل من الفقرات القطنية وعظم الفخذ، اعتمد في تشخيص تخلخل العظم على قيمة T-score التي تعبر عن الانحراف عن قيمة BMD لشخص سوي في عمر الشباب وتقدر قيمة الـ BMD بـ غ/ سم2.
جمع العينات Sample Collecting
بُزل 3 مل من الدم الوريدي على أنبوب يحوي مضاد تخثر EDTA من كل مشاركة في الدراسة، ثم جرت عملية استخلاص الدنا من العينات خلال يومين من تاريخ بزل الدم، باستخدام عتيدة عزل الدنا من الدم Gene JET Genomic DNA Purifcation Kit من شركة Fermentas (Lithuania).
لتنميط الوراثي Genotyping
حُفظ الدنا المعزول بدرجة حرارة -20 ْC حتى القيام بإجراء تفاعل البوليميراز السلسلي Polymerase Chain Reaction (PCR) وتقصي وجود تعددات شكلية اعتماداً على تعدد أشكال الشدف مقيدة الطولrestriction fragment length polymorphism.
أجري تفاعل الـ PCR باستخدام جهاز Thermal Cycler Biocycler TC-S لشركة Boeco (Germany). ضُخِمت منطقة محددة من جين الـ VDR باستخدام مشرعات Primers منقاة بتقنية HPLC لشركة VBC Austria))، حيث استخدم المشرعان (8):
For 5'-CAACCAAGACTACAAGTACCGCGTCAGTGA-3'
Rev 5'-CACTTCGAGCACAAGGGGCGTTAGC-3'
وعتيدة PCR Master Mix×2 لشركة Fermentas Lithuania)). اعتمد البرنامج الحراري التالي في عملية التضخيم: التمسخ البدئي بدرجة 94.5 ْC لمدة 3 د. ثم أتبعت بـ 35 دورة (94.5م لمدة 1 د و61 ْC لمدة 1 د و72 ْC لمدة 2 د) وبعدها الاستطالة النهائية بدرجة 72 ْC لمدة 7 د.
بعد التضخيم هُضمت شدف الدنا المضخمة باستخدام إنزيم ApaI لشركة Fermentas Lithuania)) بدرجة 37 ْC لمدة 3 ساعات ثم رُحلت العينات على هلامة الاغاروز 2% لمدة ساعتين باستخدام جهاز رحلان أفقي لشركة Pequlab (Germany).
حُددت الأنماط الجينية بوساطة حجرة إظهار بالأشعة فوق البنفسجية من شركة Cleaver scientific ltd (UK)، وأشير إلى عدم وجود موقع اقتطاع متماثل الزيجوت بـ AA وظهور عصابة واحدة بطول bp 2000 وإلى وجود موقع اقتطاع متغاير الزيجوت بـ Aa بظهور ثلاث عصابات بأطوال مختلفة (bp 300-1700-2000) وإلى وجود موقع اقتطاع متماثل الزيجوت بـ aa بظهور عصابتين فقط بطولين مختلفين (bp 300-1700).
الدراسة الإحصائية Statistical analysis
جرى تحليل النتائج إحصائياً باستخدام برنامجي Prism Graph Pad version 5 وMicrosoft office Excel 2007. حيث جرى تطبيق اختبار كاي مربع Chi-square لمقارنة توزع الأنماط الوراثية وتوزع الألائل للتعدد الشكلي ApaI بين مجموعة المرضى والمجموعة الشاهدة. جرى اعتماد فاصل الموثوقية Confidence Interval مساوياً لـ%95 وقيمة مستوى الدلالة أقل من 0.05 (P<0.05).
|
| النتائج Results |
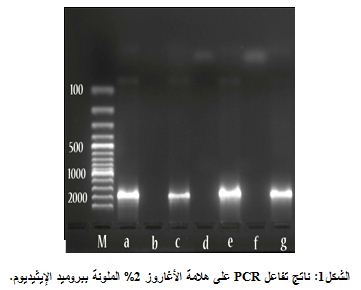
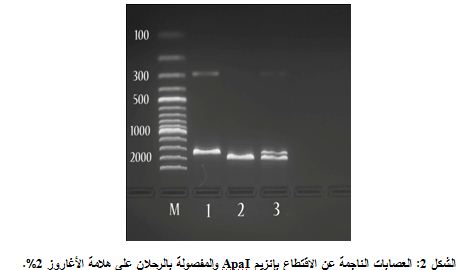
جرى استخدام إنزيم الإقتطاع ApaI في التحليل الوراثي Genotypic analysis ونتج عن ذلك ثلاثة أنماط جينية AA, Aa, aa، حيث يبين الشكلان 1 و2 نتائج تفاعل الـ PCR ونتائج الهضم بإنزيم ApaI بعد الترحيل على هلامة الأغاروز 2%، وعُرِض تواتر الأليلات والأنماط الجينية لمجموعتي الدراسة في الجدول 1.
وجد أن التعدد الشكلي ApaI يختلف بشكل ملحوظ بين مجموعة المرضى والمجموعة الشاهدة. كانت تكرارية الأنماطAA ،Aa ، aa لدى مجموعة المرضى 56.6% و24.5% و18.9%، أما بالنسبة للمجموعة الشاهدة فكانت التكرارية 30% و67.5% و2.5% على الترتيب. ولتحديد أي الأليلين (A أوa) مرتبط مع تخلخل العظم فقد جرت المقارنة بين الأليل A الكلي والأليل a الكلي بين مجموعة المرضى والمجموعة الشاهدة وكانت قيمة 0.5304 =P.
عند دراسة توزع المشتركات بالدراسة وفقاً لأنماطهم الجينية (AA مقارنة مع Aa + aa) تبين أن تخلخل العظم مرتبط مع النمط الجيني AA، حيث كانت 56.6% من السيدات اللاتي يعانين من تخلخل العظم من النمط الجيني AA مقابل 30% من المجموعة الشاهدة. وعند تطبيق اختبار كاي مربع تبين أن هذا الفارق يعتد به إحصائياً (P = 0.0125) وكانت قيمة (OR=3.04)، وفقاً لما يبينه الجدول 2.
يظهر البئر M واصماً شاهداً لقياس طول شدف الـ DNA، بينما تمثل الابار a, c, e ناتج تفاعل الـ PCR حيث كان طول القطعة المضخمة bp2000 وذلك بكميات مختلفة من المشرعات 2, 6 ,4 مكرولتر، على الترتيب. والأبار b, d, f تحتوي الشواهد السلبية أيضاً على الترتيب. يمثل البئر g شاهداً إيجابياً حيث يحتوي على 4 مكرولتر من المشرع.
|
 |
| المناقشة Discussion |
يعد تخلخل العظم من أهم المشاكل الصحية في عصرنا ، خصوصاً مع الاتجاه إلى تحسين الرعاية
الصحية. ينتج هذا المرض متعدد العوامل عن تآثر العديد من العوامل الهرمونية والجينية والبيئية،
يظهر البئر M واصماً شاهداً لقياس طول شدف الـ DNA. يمثل البئر 1 النمط الجيني aa متماثل الزيجوت، حيث تظهر عصابتان bp 1700و bp300 ويمثل البئر 2 النمط AA متماثل الزيجوت (عدم وجود موقع اقتطاع بإنزيم ApaI)، وتظهر عصابة واحدة بطول bp2000، بينما يمثل البئر 3 النمط Aa متغاير الزيجوت بظهور ثلاث عصابات bp 2000 و1700 bp و bp300.
حيث أن وجود قصة عائلية لتخلخل العظم يشير إلى وجود مؤهب وراثي لهذا المرض. وتعد جين مستقبل الفيتامين د VDR واحدة من أهم الجينات المرشحة candidate gene للتدخل في إمراضية تخلخل العظم، فجين VDR يتوضع على الموقع الصبغي 12q ويحتوي العديد من مناطق التعددات الشكلية، بما فيها ApaI التي يمكن أن تؤثر في فعالية المستقبل وبالتالي اختلاف مستويات الاستجابة للفيتامين د تبعاً للاختلافات الجينية (9).
يعود السبب الأساسي للاهتمام الكبير بجين الـ VDR إلى التأثير الواضح للفيتامين د على استتباب الكالسيوم، حيث يؤدي تناقص مستويات الفيتامين د إلى نقص مستويات كلس الدم بسبب نقص امتصاص الكالسيوم من الأمعاء، بالإضافة إلى دور واضح للفيتامين د في إعادة امتصاص الكالسيوم في الكلى وزيادة تحرر الكالسيوم من العظم من خلال تحريض التعبير عن عامل تمايز ناقضات العظم RANKL (receptor activator NF-kB ligand) في الخلايا البانية للعظم (10).
توجد العديد من الدراسات التي تبين تأثير التعدد الشكلي لجين الـ VDR على الاستجابة الفردية لـ 1,25(OH)2D3، فلقد تبين وجود ارتباط بين إنتاج الأوستيوكالسين osteocalcin والأنماط الجينية المختلفة لجين الـ VDR بالنسبة لإنزيمات الـ ApaI و TaqI و BsmI. يعد الأوستيوكالسين البروتين الأكثر وفرة في البنية خارج الخلوية للعظم وهو أحد أهم العوامل المحددة أثناء إعادة تشكيل العظم وبروتين رئيسي في تنظيم الـ BMD وتتم عملية تصنيعه فقط بوساطة بانيات العظم. لذلك فإن الكميات المتفاوتة المنتجة من الأوستيوكالسين والمحفزة بوساطة 1,25(OH)2D3 قد تؤثر على الـ BMD (11).
إن التأثيرات المتعددة للفيتامين د تقترح دوره كأحد العوامل الجينية التي تشكل عامل وقاية عند بعض المجموعات السكانية وعامل اختطار لدى مجموعات أخرى تبعاً للأنماط الجينية المختلفة لجين الـ VDR (12).
لدى دراسة التعدد الشكلي ApaI وجدنا أن النمط AA متماثل الزيجوت هو الأكثر انتشاراً لدى مجموعة المرضى، حيث كانت نسبة 56.6% من النساء المصابات بتخلخل العظم من النمط الجيني AA، بينما كان النمط الجيني Aa هو النمط السائد عند النساء السويات، حيث كانت نسبته 67.5% وهذا يتوافق مع دراسة K. Douroudis وزملائه عام 2003 التي بينت أن النمط الجيني Aa هو النمط الأكثر انتشاراً لدى النساء غير المصابات بتخلخل العظم وأن النمط الجيني aa هو الأقل تكرارية لديهن (2).
عند تقسيم مجموعتي الدراسة اعتماداً على نمطهما الجيني AA مقابل Aa+aa)) تبين أن وجود موقع اقتطاع على الجين لإنزيم ApaI سواء كان متماثل الزيجوت أومتغاير الزيجوت (aa أو (Aa يؤمن وقاية من حدوث تخلخل العظم، على عكس وجود النمط الجيني AA الذي ترافق مع حدوث تخلخل العظم لدى النساء الحاملات لهذا النمط الجيني، حيث كانت P<0.0125، وبذلك تخالفت نتائج دراستنا مع نتائج دراسة W. Horst-Sikorska وزملائه عام 2007 والتي بينت أن وجود الأليل a يترافق مع زيادة حدوث الكسور (13)، ولدى حساب قيمة معدل الأرجحية كانت قيمته OR=3.04 وهذا يدل على وجود علاقة إحصائية بين النمط الجيني وتخلخل العظم.
يمكن أن نفسر هذا الاختلاف في النتائج في ضوء الاختلافات في الخلفية العرقية وحجم العينات في الدراسات المختلفة، بالإضافة إلى التمازج والاختلاط السكاني. ويمكن أيضاً تفسير هذا الاختلاف في ضوء اختلال التوازن الارتباطي Linkage disequilibrium (LD)، حيث أن التعدد الشكلي ApaI يقع على الانترون 8 وهو بالتالي غير وظيفي إلا أنه يرتبط وبقوة مع تعددات أشكال أخرى غير وظيفية على جين VDR(14).
وبالنتيجة فقد بينت هذه الدراسة وجود ارتباط بين تخلخل العظم والتعدد الشكلي ApaI على جين VDR، حيث أظهرت أن وجود الأليل a يؤمن وقاية من الإصابة بتخلخل العظم.
|
 |
| المراجع References |
1-Mitra S; Desai M. and Khatkhatay M.I.
Vitamin D receptor gene polymorphisms and bone mineral density in postmenopausal Indian women.
Maturitas, 55: 27-35, 2006.
2-Douroudis K; Tarassi K; Ioannidis G; Giannakopoulos F; Moutsatsou P; Thalassinos N. and Papasteriades Ch.
Association of vitamin D receptor gene polymorphisms with bone mineral density in postmenopausal women of Hellenic origin.
Maturitas, 45: 191-197, 2003.
3-http://www.iofbonehealth.org/facts-statistics entered in 15/7/2014.
4-http://www.iofbonehealth.org/sites/default/files/PDFs/Audit%20Middle%20EastAfrica/IOF-MiddleEastAfricaAudit-Syria-Arabic. pdf entered in 16/7/2014.
5-Uitterlinden AG; Fang Y; van Meurs
J; van Leeuwen H. and Pols H.
Vitamin D receptor gene polymorphisms in relation to Vitamin D related disease states.
Journal of Steroid Biochemistry & Molecular Biology, (89-90): 187-193, 2004.
6-Garnero P; Munoz F; Borel O;
Sornay-Rendu E. and Delmas PD.
Vitamin D receptor gene polymorphisms are associated with the risk of fractures in postmenopausal women, independently of bone mineral density.
J Clin Endocrinol Metab, 90: 154-165, 2005.
7-Zajickova K; Zofkova I; Bahbouh R.
and Krepelova A.
Vitamin D Receptor Gene Polymorphisms, Bone Mineral Density and Bone Turnover: FokI Genotype is Related to Postmenopausal Bone Mass
Physiol. Res, 51: 501-509, 2002.
8-Grsoy S; Erdal E; Alafiehrl B;
Aydenz A. and Erdal N.
TaqI Polymorphism of the Vitamin-D Receptor Gene and Quality of Life in Postmenopausal Turkish Women.
Turk J Med Sci, 38(1): 21-26, 2008.
9-XU H; Xiong D.H; Xu F; Zhang Y;
Lei Sh. and Deng H.W.
Association between VDR ApaI Polymorphism and Hip Bone Mineral Density Can Be Modified by Body Mass Index: A Study on Postmenopausal Chinese Women.
Acta Biochimica et Biophysica Sinica. 37(1): 61-67, 2005.
10-Demissie M; Bolanowski M;
Bidzinska B; Tworowska U. And
Zatonska K.
Polymorphism of the vitamin D receptor gene, bone mineral density, and bone turnover in postmenopausal women from lower Silesia (Poland).
Taiwanese J Obstet Gynecol, 44(1): 57-61, 2005.
11-Ohtera K; Ishii S. and Matsuyama T.
Influence of the vitamin D receptor alleles on human osteoblast-like cells.
J Bone Joint Surg [Br], 83-B (1): 134-138, 2001.
12-Arabi A; Mahfoud Z; Zahed L; El-
Onsi L. and El-Hajj Fuleihan G.
Effect of age, gender and calciotropic hormones on the relationship between vitamin D receptor gene polymorphisms and bone mineral density.
European Journal of Clinical Nutrition, 64: 383–391, 2010.
13-Sikorska W.H; Kalak R;
Wawrzyniak A; Marcinkowska M;
Bajew L.C. and Slomski R.
Association analysis of the polymorphisms of the VDR gene with bone mineral density and the occurrence of fractures.
J Bone Miner Metab, 25: 310-319, 2007.
14-Smith G. D. and Ebrahim Sh.
Mendelian randomization: prospects, potentials, and limitations.
International Journal of Epidemiology, 33: 30-42, 2004.
|
| |
| |
| المجلد 7 ,
العددان 7-8
, رمضان 1436 - تموز (يوليو) 2015 |
|
|
|
