| المجلد 7 ,
العددان 7-8
, رمضان 1436 - تموز (يوليو) 2015 |
| |
| العلاقة بين وجود التعدد الشكلي CYP1A1*2A والجنس والعمر والنمط المناعي لدى أطفال سوريين مصابين بالابيضاض اللمفاوي الحاد |
| Correlation between the presence of CYP1A1*2A polymorphism and the immunophenotype, sex and age of Syrian children with acute lymphoblastic leukemia |
| روشان مبارك*، أ. د. عثمان حمدان**، و أ. د. شادن حداد* |
| Mubarak R;* Hamdan O.**and Haddad Sh.* |
*كلية الصيدلة، **كلية الطب، جامعة دمشق
*Faculty of Pharmacy, ** Faculty of medicine, Damascus University
|
| الملخص Abstract |
على الرغم من أن المظاهر السريرية والنمط المناعي وإمراضية الابيضاض اللمفاوي الحاد مدروسة بشكل جيد، فإن أسباب الابيضاض الطفولي ما زالت مشروحة بشكل غير كامل، إلا أنه كان قد ارتبط بالتعرض لعوامل بيئية وعوامل جينية متعددة أقل انتشاراً. إنزيم CYP1A1، عضو من إنزيمات السيتوكروم P450، يلعب دوراً هاماً جداً في استقلاب المسرطنات.
هدفت هذه الدراسة إلى اكتشاف تواتر التعدد الشكلي CYP1A1*2A لدى أطفال سوريين مصابين بالابيضاض اللمفاوي الحاد (ALL)، ومعرفة الدور لهذا التعدد الشكلي، إن وجد، كعامل اختطارلتطور ALL لدى الأطفال.
دُرس 70 مريضاً مصاباً بالابيضاض اللمفاوي الحاد، و45 شاهداً صحيحاً. اُستخلص DNA الجينومي وطُبق تحليل تعدد أشكال الشدف المقيدة الطول المعتمد على PCR، التالي للهضم بإنزيم MspI.
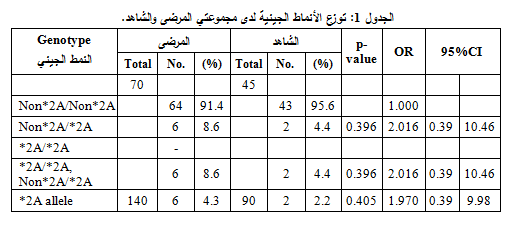
من بين 70 مريض ALL كان 8.6% منهم متغايروا الزيجوت بالنسبة للنمط الجيني CYP1A1*2A بالمقارنة مع 4.4% من الشواهد. ولقد وجد أن هذا الاختلاف بين المجموعتين لا يُعتد به إحصائياً (OR 2.016; 95% CI 0.39-10.46).
وكاستنتاج، فإن النتائج لم تظهر أي ترابط بين الأنماط الجينية CYP1A1*2A واختطار ALL لدى الأطفال السوريين.
|
Although the clinical, pathological, and immunophenotypic features of ALL are well documented. The causes of childhood leukemia continue to be incompletely explained, but have been linked to environmental exposure and multiple low penetrance genetic factors. CYP1A1, a member of the cytochrome P450 (CYP) enzymes, plays a very important role in the metabolizing of carcinogens.
This study aimed to detect the frequency of CYP1A1*2A polymorphism in Syrian children with acute lymphoblastic leukemia (ALL), and find out the role of this polymorphism, if any, as a risk factor for developing ALL in children.
70 children with acute lymphoblastic leukemia with 45 healthy controls were studied. Genomic DNA was extracted and restriction fragment length polymorphism (RFLP) based PCR was applied, followed by digestion with MspI.
Among 70 ALL patients, 8.6% were heterozygous for the CYP1A1*2A genotype, compared with 4.4% of controls. The difference between the groups were found not to be statistically significant (OR 2.016; 95% CI 0.39-10.46).
As conclusion, the results did not show any association between CYP1A1*2A genotypes and risk of ALL in Syrian children.
|
| المقدمة Introduction |
الابيضاض اللمفاوي الحاد (ALL) Acute lymphoblastic leukemia هو خباثة تصيب الأطفال والبالغين، مع وجود قمة لانتشاره في الاعمار بين 2-5 أعوام. ولقد أدى تطور العلاجات المستخدمة إلى ارتفاع معدلات الشفاء إلى أكثر من 80% لدى الأطفال (1)، ولا تزال سببيات الاصابة بـ ALL غير مفهومة بشكل جيد، إلا أنه توجد بعض عوامل الاختطار البيئية المثبتة (4–2).
تقترح بعض الدراسات السابقة حول السرطان لدى الأطفال أن الاختلافات الجينيةgenetic variants ضمن الإنزيمات المستقلبة للمواد خارجية المنشأ (XMEs) xenobiotic metabolizing enzymes تؤثر بشكل كبير على الاستعداد للإصابة بالـ ALL (8–5).
تسهم إنزيمات السيتوكروم cytochrome p450 في التنشيط الحيوي bioactivation للعديد من المواد الكيميائية المسرطنة بما في ذلك المسرطنات البيئية environmental carcinogens، حيث تقوم تلك الإنزيمات بنقل الكترونات لهذه المواد مما يؤدي إلى تشكيل وسائط عالية التفاعلية highly reactive intermediates التي تُربط عادة بالغلوتاتيون، أو مجموعة أخرى، مما ينتج مركبات ذوابة في الماء. ولكن هذه المركبات عالية التفاعل قد تتفاعل مع DNA ويؤدي ذلك إلى تشكل DNA adducts (9).
التعدد الشكلي polymorphism " m1" لإنزيم السيتوكروم CYP1A1، أحد أعضاء العائلة الجينية CYP1، هو عبارة عن تغير T6235C ضمن المنطقة غير المُرَمِّزة من الجهة 3' من الجين 3' noncoding region (كما ترمز *2A وتسمى كذلك MspI restriction fragment length polymorphism) الذي تبين أنه يؤثر في النشاط الإنزيمي (10). ويرتبط وجود الأليل m1 مع ارتفاع تحفيز induction الإنزيم CYP1A1. وبهذا التعدد الشكلي يجري تحديد ثلاثة أنماط جينية: النمط العام wt/wt (Non*2A/Non*2A)، النمط الذي لا يملك موقع القطع الخاص بالإنزيم MspI، والنمط متغاير الزيجوت wt/m1 (Non*2A/*2A) والنمط متماثل الزيجوت m1/m1 (*2A/*2A) (11 ، 12).
وجدت دراسةZhuo et al, 2012 أن التعدد الشكلي CYP1A1 MspI قد يكون عامل اختطار في الابيضاض اللمفاوي الحاد وخاصة الابيضاض اللمفاوي الحاد عند الأطفال (13).
بينما أظهرت دراسة han et al. وجود دليل متوسط على أن التعدد الشكلي CYP1A1*2A مرتبط مع ازدياد اختطار الابيضاض اللمفاوي الحاد لدى الأطفال القوقازيين. وبشكل عام أظهرت هذه الدراسة أن هنالك ارتباطاً بين وجود هذا التعدد الشكلي وزيادة اختطار الابيضاض وأن هذا الارتباط يختلف حسب الأثنية (14).
أظهرت دراسة على الأطفال الهنود أن التعدد الشكلي في الإنزيم CYP1A1 يزيد بصورة يُعتد بها الاستعداد susceptibility للإصابة بـ ALL لدى الأطفال ذوي النمط الجيني متماثل الزيجوت m1/m1 بمعدل اختطار أعلى بـ 6 مرات (15).
وفي دراستين على أطفال كنديين من أصل فرنسي، وجد الباحثون أن التعدد الشكلي في الإنزيم CYP1A1 يرتبط بكل من ازدياد الاستعداد الجيني (8) والانذار السيء (16).
إن تواتر التعدد الشكلي CYP1A1*2A polymorphism يختلف بين المجموعات الأثنية ولا توجد دراسات تحدد تواتر أو ارتباط هذا التعدد الشكلي CYP1A1*2A polymorphism مع الاستعداد للاصابة بـ ALL لدى مرضى سوريين.
الهدف من هذه الدراسة تقييم دور هذه الأنماط الجينية في تطور الابيضاض اللمفاوي الحاد لدى أطفال سوريين.
|
| المواد والطرق |
1- مجموعات الدراسة
مجموعـة المرضى مؤلفة من 70 مريضاً لديـهم
ابيضاض لمفاوي حاد يراجعون مستشفى الأطفال الجامعي في دمشق، 47 ذكراً (67.14%) و23 أنثى (32.85 %)، تتراوح أعمارهم بين 1.5 شهراً و13 عاماً (متوسط العمر 4.4 ± 2.8 عاماً) شُخصت الإصابة لديهم وحُدد النمط المناعي باستخدام تقنية العد بالجريان الخلوي، فكان توزع تحت الأنماط subtypes على الشكل التالي: 59 مريضاً B-lineage ALL (39 ذكراً و20 أنثى) و9 مرضى T-lineage ALL (7 ذكور و2 إناث) و2 مرضى غير محددين.
مجموعة الأصحاء ضمت 45 شخصاً جرى انتقاؤهم بشكل عشوائي، لا تربطهم صلة قربى وليس لديهم أي دليل للإصابة بخباثة، 26 ذكراً (57.8%) و19 أنثى (42.2%). جرى التوقيع على الموافقة المستنيرة من المشاركين في الدراسة جميعهم.
2- التنميط الجيني
اُستخلص الـ DNA الجينومي من الدم المحيطي بطريقة معيارية standard method. واستُقصيت الطفرة T6235C (m1) باستخدام طريقة PCR-RFLP التي تم تطبيقها من قبل Nan song, 2001 (17).
جرى تضخيم شدفة DNA بطول 340bp في مزيج تفاعل حجمه 50μL يحتوي 20 ng من الـ DNA الجينومي و0.1 مكرومول /ل من البوادئ
M1F (5'TAG GAG TCT TGT CTC ATG CCT3')
M1R (5'CAG TGA AGA GGT GTA GCC GCT3')
و25 مكرولتر من مزيج PCR master mix (Thermo Fisher Scientific Inc).
وجرى تطبيق تفاعل PCR على الشكل التالي:
خطوة بدئية صهر لمدة 5 دقائق بالدرجة 94 Cْ و30 دورة من: 1 دقيقة بالدرجة 94 Cْ و1 دقيقة بالدرجة 61 Cْ و1 دقيقة بالدرجة 72 Cْ ، وخطوة إطالة نهائية لمدة 10 دقائق بالدرجة 72 Cْ.
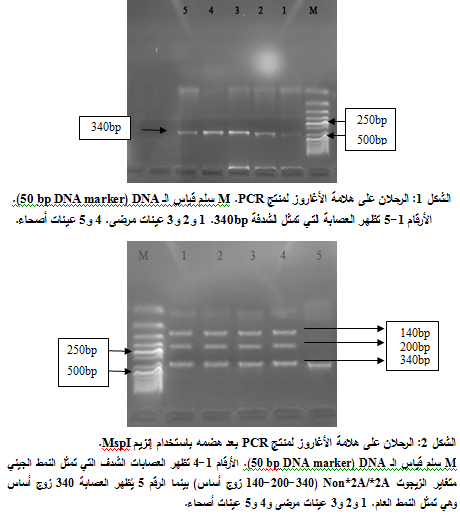
جرى هضم منتج تفاعل PCR باستخدام 3 وحدات من إنزيم MspI (vivantis) لمدة 3 ساعات بالدرجة 37 Cْ، فتتشكل شدف أصغر في حال وجود الأليل الطافر (200, 140 bp). وجرى تعيين الأنماط الجينية بترحيل منتجات القطع على هلامة الأغاروز 3% الحاوية على بروميد الايثيديوم.
|
| الدراسة الاحصائية Statistical Study |
| جرى تقييم الأهمية الإحصائية للاختلاف في تواتر الأنماط الجينية باستخدام اختبار كاي مربع، وجرى حساب odds ratios (ORs) بمجال ثقة 95% (95% confidence intervals). ودرس تأثير كل من العمر والجنس والنمط المناعي وعدد الكريات البيض البدئي على توزع الأنماط الجينية لدى مجموعة المرضى وذلك باستخدام اختبار كاي مربع والانحدار المنطقي logistic regression.
جرى إنجاز التحليل الإحصائي باستخدام برنامج SPSS الاصدار 16.0.
|
| النتائج Results |
وجد 6 مرضى من أصل 70 مريضاً، أي 8.6%، من النمط الجيني متغاير الزيجوت Non*2A/*2A، بالمقارنة مع 4.4% من المجموعة الشاهدة. ووجد أن الاختلاف بين المجموعتين المرضية والشاهدة غير معتد به إحصائياً (OR 2.016; 95% CI 0.39-10.46) ويبين الجدول 1 توزع الأنماط الجينية لدى أفراد كلا المجموعتين. ويظهر الشكلان 1 و2 عصابات DNA المفصولة لمنتج PCR لبعض عينات المرضى والأصحاء.
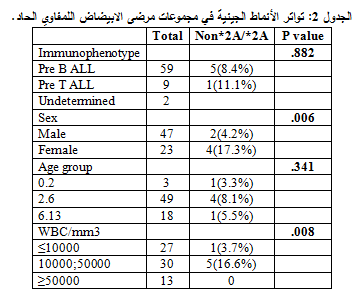
جرى تقسيم المرضى إلى مجموعات بالاعتماد على النمط المناعي والجنس والعمر وعدد الكريات البيض عند التشخيص. ويظهر الجدول 2 توزع الأنماط الجينية لكل من هذه المجموعات.
كان تواتر النمط الجيني متغاير الزيجوت 8.4% في مجموعة المرضى ذوي النمط المناعي B-cell ALL بالمقارنة مع 11.1% لدى ذوي النمط المناعيT-cell ALL .
وأظهر حساب قيمة P عدم وجود فارق معتد به احصائياً، حيث كانت P=0.882.
كان النمط الجيني المتغاير الزيجوت *2A/non*2A أكثر تواتراً لدى الاناث (17.3%) بالمقارنة مع الذكور (4.2%)، وكان
الفارق معتداً به إحصائياً (P=0.006).
كما أنه كان أكثر تواتراً لـدى المرضى ذوي عدد الكريات البيض> 10,000 WBC عند التشخيص (16.6%) بالمقارنة مع المرضى ذوي عدد الكريات البيض WBC < 10,000 (3.7%)،
وكان الفارق معتداً به إحصائياً (P=0.008).
أما عن ارتباط وجود هذه الطفرة مع عمر المريض
عند تشخيص الابيضاض اللمفاوي الحاد فقد كانت النسبة لدى المرضى الذين تتراوح أعمارهم بين 0-2 عاماً %3.3ولدى المرضى الذين تتراوح أعمارهم بين 2-6 أعوام كانت النسبة %8.1 ولدى المرضى الذين تتراوح أعمارهم بين 6-13 عاماً كانت النسبة %5.5 ولم يكن الفارق معتداً به إحصائياً بين الفئات العمرية (P=0.341).
|
|
| المناقشة Discussion |
يعد الابيضاض هو أكثر أنماط السرطان شيوعاً لدى الاطفال (3). وعلى الرغم من الفهم الجيد للمظاهر السريرية والامراضية للابيضاض اللمفاوي الحاد إلا أن تأثير الجينات على الاستعداد susceptibility للإصابة بهذا المرض غير واضح تماماً (18). إن التحول الحيوي Biotransformation للمواد خارجية المنشأ بوساطة إنزيمات الطور الأول phase I وإنزيمات الطور الثاني phase II هو عملية مهمة لبدء التأثير المسرطن للمواد الكيميائية (19)، وبما أن التعبير الجيني عن إنزيمات العائلة CYP1 يزداد في الخطوط الخلوية النقوية واللمفاوية لذا فإن إنزيمات CYP1 قد تسهم في تسرطن carcinogenesis الخلايا المولدة للدم (20).
إن تحول طلائع المسرطنات التي تدخل الخلية إلى مواد مسرطنة فعالة يجري بتوسط إنزيم CYP1A1 والاختلاف في فاعلية هذا الإنزيم يسبب تراكم معقدات الإضافة DNA adducts في الخلايا، والعديد من الطفرات تنتج عن تزايد DNA adducts، مما يحفز تسرطن الخلية. لذا فإن الأشخاص ذوي القدرة الأعلى على تنشيط طلائع المسرطنات يكون لديهم اختطار أعلى لتطور السرطان (21).
إن وجود CYP1A1*2A يؤدي إلى تشكل مستويات مرتفعة من معقدات الإضافة DNA adducts وزيادة اختطار التسرطن بسبب زيادة فاعليته (22-24).
تظهر دراسة Sinnett et al., 2007 أن CYP1A1*2A هو أحد العوامل الهامة التي تحدد اختطار ALL. وفي دراسة et al., Joseph 2004 (15) على الأطفال الهنود تبين أن النمط الجيني متماثل الزيجوت CYP1A1*2A يزيد اختطار الإصابة بالابيضاض اللمفاوي الحاد بحوالي 6 أضعاف6-fold risk.
بينما أظهرت العديد من الدراسات أن وجود الأليل CYP1A1*2A غير مرتبط بالابيضاض اللمفاوي الحاد، كما في دراسةCanalle et al. 2004 (6)، و Yamaguti et al. 2010 (25)، لدى الأطفال البرازيليين ودراستي Balta et al., 2003 (26) وAydin-Sayitoglu et al. 2006 (27)، لدى الأطفال الأتراك، ودراسة Ouerhani et al., 2013 (28)، لدى التونسيين، ودراسة Agha et al., 2014 (29)، لدى الأطفال المصريين.
أظهرت دراستنا عدم وجود ارتباط بين النمط الجيني متغاير الزيجوت*2A/non*2A واختطار الإصابة بالابيضاض اللمفاوي الحاد لدى الأطفال (OR 2.016; 95% CI 0.39-10.46) ويمكن تفسير هذا الاختلاف بين المجموعات الاثنية المختلفة بالاختلافات في الارتباط linkage أو الترابط الجيني genetic association بين الأليلات في المجموعات المختلفة. ففي حالة الجين CYP1A1 لا يظهر الأشخاص من أصل أفريقي ارتباطاً بين الأليلات m1/m2 على عكس القوقازيين والآسيويين. وإن الارتباط بين النمط الجيني m1/m1 متماثل الزيجوت وسرطان الثدي لدى الأفارقة الأمريكان وليس القوقازيين قد يكون بسبب اختلاف ارتباط الأليل m1 إلى المواقع loci الأخرى في هاتين المجموعتين. هذا الاستنتاج مبني على فكرة أنه من غير المحتمل أنm1 (التي تحدث خارج أي منطقة مرمزة أو منظمة من الجين) لديها أي تأثير مباشر على وظيفة الجين أو حدوث المرض بحد ذاتها (30).
يقوم m1 لدى القوقازيين بدور واصم marker لـm2 في الإكسون 7 من الجين، لكن في الأفارقة الأمريكان فإنه بدلاً من ذلك من المحتمل أنه يرتبط بموقع آخر مع نشاط وظيفي مختلف والذي يكون مرتبطاً بشكل ما مع سرطان الثدي. هذا الموقع المفترض قد يتضمن أياً من العدد الكبير لجينات الاستعداد للسرطان الموزعة خلال الجينوم. ومن المهم ملاحظة أن مثل هذه الجينات قد ترتبط بشكل غير متوازن disequilibrium مع التعددات الشكلية المتعددة لجينات الاستقلاب في مجموعات محددة وليس في مجموعات أخرى. من المحتمل أن المجموعات الاثنية المختلفة لديها معدلات modifiers مختلفة لوظيفة الجين، ليست بالضرورة مرتبطة بتعددات شكلية محددة. وفي هذه الحالة فإن هنالك نمط معقد نوعي اثني complex ethnic-specific pattern لوظيفة الجين والارتباط بالمرض يتضمن التأثيرات المختلفة للتعددات الشكلية.
تظهر هذه البيانات المختلفة بين المجتمعات المختلفة أن دراسة تعدد أشكال الجين gene polymorphism شيء أساسي لكل مجتمع. أظهرت دراستنا مستويات تعبير أعلى عن النمط الجيني متغاير الزيجوت لدى المرضى الإناث مقارنة مع المرضى الذكور. ربما يفسر ذلك بتأثير واقٍ مرتبط مع الجنس بالنسبة لوجود هذا التعدد الشكلي، فقد يكون منتج الجين يجري تنظيمه على مستوى الانتساخ بوساطة ستيرويدات داخلية المنشأ أو عوامل أخرى غير جينية عند الذكور والإناث. ولقد أظهرت الدراسات على حيوانات التجربة أن العوامل خارجية المنشأ exogenous agents قد تؤثر بشكل دائم permanently على طرز التعبير expression patternsعن سيتوكرومات معينة specific cytochromes P450 (30).
يظهر مثل هذا التاثير بشكل سيتوكرومات نوعية مرتبطة بالجنسsex-specific ويجري التحكم به عبر مستويات الأندروجينات والإستروجينات وهرمون النمو، كما لايمكن استبعاد إمكان أن تلعب جين مجاورة مرتبطة in linkage مع CYP1A1، بتواجدها مع الأليل CYP1A1*2A، دوراً في هذا التأثير (31). في حين لم تظهر دراستنا ارتباطا لوجود الأليل *2A مع كل من العمر والنمط المناعي.
|
| الاستنتاجات Conclusions |
أظهرت هذه الدراسة عدم ارتباط وجود التعدد الشكلي M1 مع الاستعداد للإصابة بالابيضاض اللمفاوي الحاد لدى الأطفال السوريين.
كما لم تظهر هذه الدراسـة ارتبـاط وجود التعدد الشكلي M1 مع العمر والنمط المناعي لدى الأطفاال المصابين بالابيضاض اللمفاوي الحاد.
أظهرت هذه الدراسة ارتباطاً بين وجود التعدد الشكلي M1 مع جنس المريض، حيث كان أكثر تواتراً لدى الاناث.
|
| المراجع References |
1- Pui C.H; Robison L.L. and Look A.T.
Acute lymphoblastic leukaemia.
The Lancet 371, 1030-1043, 2008.
2- Raaschou-Nielsen O. and Reynolds P.
Air pollution and childhood cancer: a review of the epidemiological literature. Int.
J. Cancer J. Int. Cancer 118, 2920-2929, 2006.
3- Belson M; Kingsley B. and Holmes A.
Risk factors for acute leukemia in children: a review.
Environ. Health Perspect. 138-145. 2007.
4- Linabery A.M. and Ross J.A.
Trends in childhood cancer incidence in the U.S; 1992-2004.
Cancer 112, 416-432. 2008.
5- Bolufer P. et al.
Influence of genetic polymorphisms on the risk of developing leukemia and on disease progression.
Leuk. Res. 30, 1471-1491. 2006.
6- Canalle R; Burim R; Tone L. and Takahashi C.
Genetic polymorphisms and susceptibility to childhood acute lymphoblastic leukemia.
Env. Mol Mutagen 43, 100-9, 2004.
7- Sinnett D; Krajinovic M. and Labuda D.
Genetic susceptibility to childhood acute lymphoblastic leukemia.
Leuk. Lymphoma 38, 447-462, 2000.
8- Krajinovic M; Labuda D; Richer C; Karimi S. and Sinnett D.
Susceptibility to childhood acute lymphoblastic leukemia: influence of CYP1A1, CYP2D6, GSTM1, and GSTT1 genetic polymorphisms.
Blood 93, 1496-1501, 1999.
9- Ingelman-Sundberg M.
Genetic susceptibility to adverse effects of drugs and environmental toxicants.
The role of the CYP family of enzymes. Mutat. Res. 482, 11-19. 2001.
10- Hayashi S; Watanabe J; Nakachi K. and Kawajiri K.
Genetic linkage of lung cancer-associated MspI polymorphisms with amino acid replacement in the heme binding region of the human cytochrome P450IA1 gene.
J. Biochem; Tokyo 110, 407-411. 1991.
11- Landi M. T. et al.
Association between CYP1A1 genotype, mRNA expression and enzymatic activity in humans.
Pharmacogenetics 4, 242-246. 1994.
12- Petersen D. D. et al.
Human CYP1A1 gene: cosegregation of the enzyme inducibility phenotype and an RFLP.
Am. J. Hum. Genet. 48, 720-725. 1991.
13- Zhuo W; Zhang L; Qiu Z; Zhu B. and Chen, Z.
Does cytochrome P450 1A1 MspI polymorphism increase acute lymphoblastic leukemia risk?
Evidence from 2013 cases and 2903 controls. Gene 510, 14-21. 2012.
14- Han F; Tan Y; Cui W; Dong L. and Li W.
Novel insights into etiologies of leukemia: a HuGE review and meta-analysis of CYP1A1 polymorphisms and leukemia risk.
Am. J. Epidemiol. 178, 493-507. 2013.
15- Joseph T; Kusumakumary P; Chacko P; Abraham A. and Radhakrishna Pillai M.
Genetic polymorphism of CYP1A1, CYP2D6, GSTM1 and GSTT1 and susceptibility to acute lymphoblastic leukaemia in Indian children.
Pediatr. Blood Cancer 43, 560-567. 2004.
16- Krajinovic M. et al.
Polymorphisms in genes encoding drugs and xenobiotic metabolizing enzymes, DNA repair enzymes, and response to treatment of childhood acute lymphoblastic leukemia.
Clin. Cancer Res. 8, 802-810. 2002.
17- Song N; Tan W; Xing D. and Lin D.
CYP 1A1 polymorphism and risk of lung cancer in relation to tobacco smoking: a case-control study in China.
Carcinogenesis 22, 11-16. 2001.
18- Krajinovic M; Labuda D. and Sinnett D.
Childhood acute lymphoblastic leukemia: genetic determinants of susceptibility and disease outcome.
Rev. Environ. Health 16, 263-279. 2001.
19- Taningher M; Malacarne D; Izzotti A; Ugolini D. and Parodi S.
Drug metabolism polymorphisms as modulators of cancer susceptibility.
Mutat. Res. 436, 227-261. 1999.
20- Nagai F; Hiyoshi Y; Sugimachi K. and Tamura H.O.
Cytochrome P450. (CYP) expression in human myeloblastic and lymphoid cell lines.
Biol. Pharm. Bull. 25, 383-385. 2002.
21- Lamba J. K; Lin Y. S; Schuetz E. G. and Thummel K. E.
Genetic contribution to variable human CYP3A-mediated metabolism.
Adv. Drug Deliv. Rev. 54, 1271-1294. 2002.
22- Rojas M. et al.
High benzo[a]pyrene diol-epoxide DNA adduct levels in lung and blood cells from individuals with combined CYP1A1 MspI/Msp-GSTM1*0/*0 genotypes.
Pharmacogenetics 8, 109-118, 1998.
23- Rojas M. et al.
Modulation of benzo[a]pyrene diolepoxide-DNA adduct levels in human white blood cells by CYP1A1, GSTM1 and GSTT1 polymorphism.
Carcinogenesis 21, 35-41. 2000.
24- Thier R. et al.
Influence of polymorphisms of the human glutathione transferases and cytochrome P450 2E1 enzyme on the metabolism and toxicity of ethylene oxide and acrylonitrile.
Mutat. Res. 482, 41-46. 2001.
25- Yamaguti G. G. et al.
Increased risk for acute lymphoblastic leukemia in children with cytochrome P450A1. (CYP1A1), and NAD (P) H: quinone oxidoreductase 1. NQO1-inherited gene variants.
Acta Haematol. 124, 182-184. 2010.
26- Balta G. et al.
Characterization of MTHFR, GSTM1, GSTT1, GSTP1, and CYP1A1 genotypes in childhood acute leukemia.
Am. J. Hematol. 73, 154-160. 2003.
27- Aydin-Sayitoglu M; Hatirnaz O; Erensoy N. and Ozbek U.
Role ofCYP2D6, CYP1A1, CYP2E1, GSTT1, andGSTM1 genes in the susceptibility to acute leukemias.
Am. J. Hematol. 81, 162-170. 2006.
28- Ouerhani S. et al.
Genetic polymorphisms of NQO1, CYP1A1 and TPMT and susceptibility to acute lymphoblastic leukemia in a Tunisian population.
Mol. Biol. Rep. 40, 1307-1314. 2013.
29- Agha A; Shabaan H; Abdel-Gawad E. and El-Ghannam D.
Polymorphism of CYP1A1 gene and susceptibility to childhood acute lymphoblastic leukemia in Egypt. Leuk.
Lymphoma 55, 618-623. 2014.
30- Fujita I; Sindhu R. K. and Kikkawa Y.
Hepatic cytochrome P450 enzyme imprinting in adult rat by neonatal benzo[a]pyrene administration.
Pediatr. Res. 37, 646-651. 1995.
31- Zaphiropoulos P. G; Mode A; Norstedt G. and Gustafsson J. A.
Regulation of sexual differentiation in drug and steroid metabolism.
Trends Pharmacol. Sci. 10, 149-153. 1989.
|
| |
| |
| المجلد 7 ,
العددان 7-8
, رمضان 1436 - تموز (يوليو) 2015 |
|
|
|
