| المجلد 8 ,
العددان 1 و 2
, رمضان 1437 - تموز (يوليو) 2016 |
| |
| دراسة دور IL-8 (CXCL-8) المصلي كواصم حيوي
لدرجة اختطار الداء الرئوي الانسدادي المزمن (COPD)
|
| Role of Serum IL-8 (CXCL8) as a Biomarker of the Severity of Chronic Obstructive Pulmonary Disease (COPD) |
| د. رامي داود و د. عمار الزين و أ. د. خليل القوتلي |
| Daud R; Al-Zain A. and Al Kwatly Kh. |
كلية الصيدلة، جامعة دمشق
Faculty of Pharmacy, Damascus University
|
| الملخص Abstract |
يعد الداء الرئوي الانسدادي المزمن COPD واحداً من الأسباب الرئيسة للوفاة عالمياً. ويتصف بالتهاب مزمن لمجرى التنفس مترافقاً مع انسداد مترقٍ لمجرى الهواء. وتُعد العدلات الخلايا الرئيسة في إمراضية COPD. ويعد الكيموكين IL-8 (CXCL8) جاذباً كيميائياً قوياً للعدلات ومشاركاً في الالتهاب المتواسط بانجذاب وارتشاح العدلات. هدف هذه الدراسة هو تقدير القيمة التشخيصية للـ IL-8 (CXCL8) كواصم التهابي لدى مرضى COPD المستقر في المراحل جميعها ولدى مرضى السورات.
شملت دراستنا 60 مريض COPD ]30 مريضاً في حالة السورة و15 مريضاً في المرحلة الخفيفة إلى المتوسطة من COPD المستقر (COPD I-II) و15 مريضاً في المرحلة الشديدة إلى الشديدة جداً من COPD المستقر (COPD III-IV)[ و28 شواهد أصحاء (11 أصحاء غير مدخنين و17 أصحاء مدخنين). قيس IL-8 بطريقة ELISA، كما جرى تعداد خلايا الدم الكلي آلياً.
أظهرت نتائجنا زيادة يُعتد بها (P<0.05) في مستويات IL-8 المصلية لدى مجموعة مرضى COPD (88.319±21.057 بكغ/ مل)، مرضى COPD المستقر (COPD I-II) (49.564±8.456 بكغ/ مل)، مرضى COPD المستقر (COPD III-IV) (60.266±10.617 بكغ/ مل)، مقارنة مع الشواهد الأصحاء المدخنين (±34.8333415.465 بكغ/ مل) والشواهد الأصحاء غير المدخنين (16.098±7.812 بكغ/ مل). ولوحظ ارتباط يُعتد به (P<0.05) بين مستويات IL-8 المصلية والنسبة المئوية للعدلات الدموية لدى مجموعات مرضى COPD.
وكاستنتاج، يمكن استخدام مستويات IL-8 المصلية المرتفعة كواصم حيوي للاستجابة الالتهابية الجهازية لدى مرضى COPD (حيث ارتبطت مستوياته بوخامة COPD). ولهذا فإن مستوى IL-8 المصلي هو واصم حيوي مساعد في تشخيص COPD والتمييز بين مراحله.
|
Chronic obstructive pulmonary disease (COPD) is one of the major causes of death in the world. It is characterized with the chronic airway inflammation associated with progressive obstruction of airflow. Neutrophils are the key cells in COPD pathology. IL-8 (CXCL-8) chemokine is a potent chemoattractant for neutrophils and is involved in inflammation-mediated neutrophil infiltration and chemotaxis.
The aim of this study is to assess the diagnostic value of interleukin IL-8 (CXCL-8) as inflammatory marker in all stages of stable COPD patients and exacerbated patients.
This study included 60 COPD patients [30 patients with COPD Exacerbations, 15 patients with stable COPD (COPD I-II), 15 patients with stable (COPD III-IV)], and 28 healthy controls (11 healthy non-smoker controls and 17 healthy smoker controls). Serum IL-8 was assessed by ELISA and automated total blood cells count was done.
Our results showed a significant increase in the serum levels of IL-8 in exacerbated COPD patients (88.319±21.075 pg\ml), stable COPD patients (I-II) 49.564±8.456 pg\ml, stable COPD patients (III-IV) 60.266±10.617 pg\ml, compared to healthy smoker controls (34.833±15.465 pg\ml) and healthy non-smoker controls (16.098±7.812 pg\ml). A significant correlation (P<0.05) was observed between the serum levels of IL-8 and the percentage of blood neutrophils in COPD patients groups.
As a conclusion, increased serum of IL-8 can be used as a biomarker of the systemic inflammatory response in COPD patients (its levels are associated with the severity of COPD). So a serum level of IL-8 is a helpful biomarker in the diagnosis of COPD and distinguishing between its stages.
|
| المقدمة Introduction |
يُعرف الداء الرئوي الانسدادي المزمن وفقاً لـ GOLD (Global initiative for chronic obstructive pulmonary disease) بأنه حالة مرضية تتصف بانسداد غير عكوس في المجرى التنفسي. ويكون انسداد المجرى التنفسي مترقياً ومترافقاً مع استجابة التهابية غير سوية للرئتين تجاه الجسيمات السامة أو الغازات، حيث تساهم السورات والاعتلالات الأخرى المرافقة في تحديد مدى اختطار مرضى الداء الرئوي الانسدادي المزمن (1).
يُشخّص COPD باستخدام مقياس التنفس Spirometer، الذي يقيس الوظائف التنفسية، واعتماداً عليه يصنف مرضى COPD إلى أربع مراحل (1) (الجدول1). ويرتبط التناقص السريع في الوظيفة التنفسية المترافق مع زيادة في أعراض الزلة التنفسية والسعال والقشع وتقيح القشع بحدوث السورات Exacerbations، التي تعرف بأنها سوء مستمر في حالة المريض من حالة الهدأة إلى أن يتجاوز التنوع (من يوم إلى يوم) والذي يكون حاداً في هجمته ويستوجب تبديلاً في العلاج المعتاد للمريض (2، 3).
تتضمن الاستجابة الالتهابية زيادة في عدد العدلات والبلاعم واللمفاويات (4)، حيث تحرر هذه الخلايا الوسائط الالتهابية والإنزيمات التي تؤدي إلى حدوث التبدلات المرضية المميزة للداء الرئوي الانسدادي المزمن، ومن أهم الوسائط الالتهابية التي تلعب دوراً في الآلية الإمراضية المناعية لـ COPD هي الكيموكينات chemokines (5).
تضم عائلة الكيموكينات حوالي 50 من عديدات الببتيد ذات الوزن الجزيئي المنخفض، كما تعد الكيموكينات فصيلة من السيتوكينات الجاذبة كيميائياً chemotactic cytokines والتي يترواح وزنها الجزيئي بين 8-12 kDa (6،7). وهي تتألف من حوالي 70 حمضاً أمينياً ويتلخص دورها بالجذب الكيميائي للكريات البيض إلى الأنسجة (8).
قسمت الكيموكينات إلى أربع مجموعات وذلك تبعاً لموقع ثمالات السيستئين المفتاحية والتي يبلغ عددها غالباً أربع ثمالات سيستئينية مصونة وهي C وCC وCXC وCX3C (9).
تعد كيموكينات المجموعتين CXC وCC الأكثر ارتباطاً بالداء الرئوي الانسدادي المزمن، هذا ويعد IL-8 (CXCL8) من أهم كيموكينات المجموعة CXC التي تلعب دوراً هاماً في إمراضية COPD (10). وهو بروتين مكون من 72 حمضاً أمينياً ووزنه الجزيئي 8.3 kDa (11).
ينتج IL-8 من البلاعم السنخية والخلايا الظهارية القصبية، والخلايا البطانية وغيرها، حيث يحفز دخان السجائر تحرر IL-8 من الخلايا الظهارية القصبية ومن البلاعم السنخية وهو يقوم بدور جاذب للعدلات التي تفرز الإنزيمات الضارة والمسببة للأذية في الطرق الهوائية، ونظراً للوظائف المتعددة للانترلوكين IL-8 في الداء الرئوي الانسدادي المزمن فهذا يوجه إلى اقتراح أن الاختلاف بين مرضى COPD والمدخنين الأصحاء يمكن أن يكون متعلقاً بكميةIL-8 المنتجة والمتحررة من الخلايا الظهارية للطرق التنفسية، وهذا ما يجعله هدفاً جيداً في علاج COPD (12).
تهدف دراستنا إلى تقييم مستويات IL-8 المصلية لدى مرضى COPD في مختلف مراحله وأثناء السورة، وذلك كواصم للاستجابة الالتهابية المترافقة مع الداء الرئوي الانسدادي المزمن، وذلك بهدف تحديد إمكان استخدام IL-8 المصلي كواصم حيوي التهابي لدرجة اختطار COPD والتمييز بين مراحله.
|
| المواد والطرق Materials and Methods |
دراستنا هذه من نمط دراسة استباقية - حالة شاهد Prospective case control study. أُجريت في مستشفى الأسد الجامعي ومستشفى المواساة الجامعي بدمشق في الفترة الممتدة بين شهر كانون الأول من العام 2013 وشهر تموز من العام 2014.
شملت الدراسة 88 فرداً تراوحت أعمارهم بين 42-84 عاماً، حيث بلغ عدد المرضى 60 مريضاً (55 ذكراً و5 إناث) من مراجعي شعبة الأمراض الداخلية الصدرية في مستشفى الأسد الجامعي ومستشفى المواساة الجامعي ومركز الدكتور نعيم شحرور للأمراض الصدرية، حيث جرى تشخيص داء COPD لديهم وتحديد مراحله من قبل اختصاصيي الصدرية في المستشفيات والمراكز سابقة الذكر، واستبعد من الدراسة كل المرضى الذين يعانون من أمراض قلبية كاحتشاء العضلة القللبية أو الذبحة، أمراض مناعية ذاتية أو تحسسية أو التهابية، المصابون بالأورام، المصابون بأمراض رئوية أخرى (ذات الرئة والسل وغيرها)، أو الذين تناولوا أدوية معدلة للمناعة، مثل الستيرويدات، خلال 14 يوماً سابقة لأخذ العينة. أما الأصحاء فكانوا ممن ليس لديهم أية أعراض تنفسية كالسعال أو إنتاج قشع وغير مصابين بأي مرض التهابي أو مناعي أو عدوائي.
قُسِّم المرضى إلى ثلاث مجموعات (الجدول 2)
|
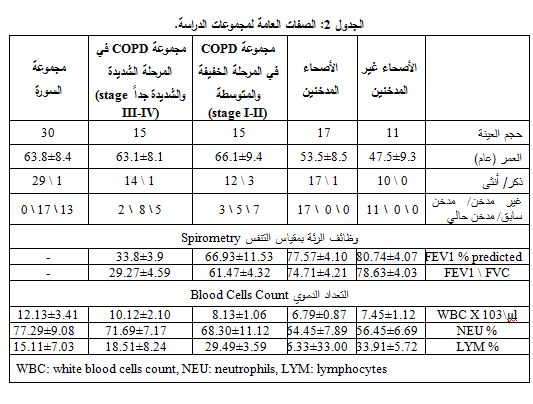 |
مجموعة مرضى COPD بحالة السورة، مجموعة مرضى COPD المستقر بالمرحلة الخفيفة أو المتوسطة Stage I-II ومجموعة مرضى COPD المستقر بالمرحلة الشديدة أو الشديدة جداً stage III-IV، أما الأصحاء فجرى تقسيمهم إلى مجموعتين: مجموعة الأصحاء غير المدخنين ومجموعة الأصحاء المدخنين.
جمع العينات Sample Collecting
جُمعت عينات الدم الورديدي للمرضى والأصحاء، وقسمت كل عينة إلى قسمين، قسم وضع على مانع التخثر EDTA، بهدف إجراء تعداد الدم الكامل عليها، والقسم الآخر وضع في أنبوب جاف نُبّذ بسرعة 3000 دورة/ الدقيقة لمدة 10 دقائق بدرجة حرارة الغرفة، ثم أخذ المصل ووضع في أنبوب إيبندورف، حفظت العينة بالدرجة 80- C°إلى حين إجراء المقايسة.
المقايسة المناعية Immunoassay
قيست مستويات IL-8 المصلية باستخدام عتيدة DIAsource IL-8-EASIA kit المصنعة من قبل شركة DIAsource Immunoassays S.A البلجيكية. وهي تعتمد طريقة المقايسة المناعية الإنزيمية مضخمة الحساسية (مبدأ الشطيرة). وجرى العمل وفقاً لتعليمات الشركة المصنعة.
تعداد الكريات الدموية
أُجري تعداد الدم الكامل في مستشفى المواساة باستخدام جهاز Coulter-AC 5differ CP hematology analyze من شركة Beckman INC الأمريكية.
الدراسة الإحصائية Statistical analysis
حُدد المتوسط الحسابي والانحراف المعياري والخطأ المعياري ومجال القيم لكل مجموعة من المجموعات، وجرى تطبيق اختبار T-student واختباري تحليل التباين أحادي الجانب ANOVA متبوعاً باختبارBonferroni لتحديد كون الفارق بين المتوسطات معتداً به إحصائياً أو ناجماً عن المصادفة، كما رُسِم منحنى ROC لتحديد حساسية ونوعية IL-8 في تشخيص COPD والتمييز بين مراحله، واستخدم معامل الارتباط Pearson لدراسة علاقة الارتباط بين مستويات IL-8 المصلية والنسبة المئوية للعدلات الدموية، واعتمدت قيمة P<0.05 كقيمة معتداً بها إحصائياً. أنجزت الدراسة الإحصائية باستخدم برنامج SPSS V:22 وبرنامج Microsoft Excel 2013.
|
| النتائج Results |
مستويات IL-8 المصلية لدى مرضى COPD ومجموعة الأصحاء
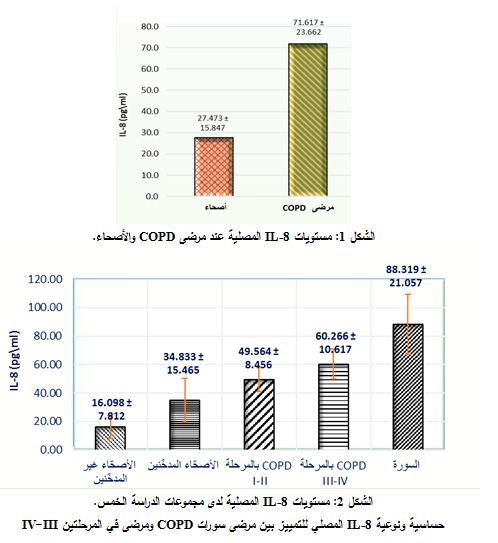
كانت مستويات IL-8 المصلية لدى مجموعة المرضى ( 23.662±71.617بكغ/ مل) أعلى منها لدى مجموعة الأصحاء (27.473±15.847 بكغ/ مل) وبفارق يعتد به إحصائياً (P<0.001) (الشكل 1).
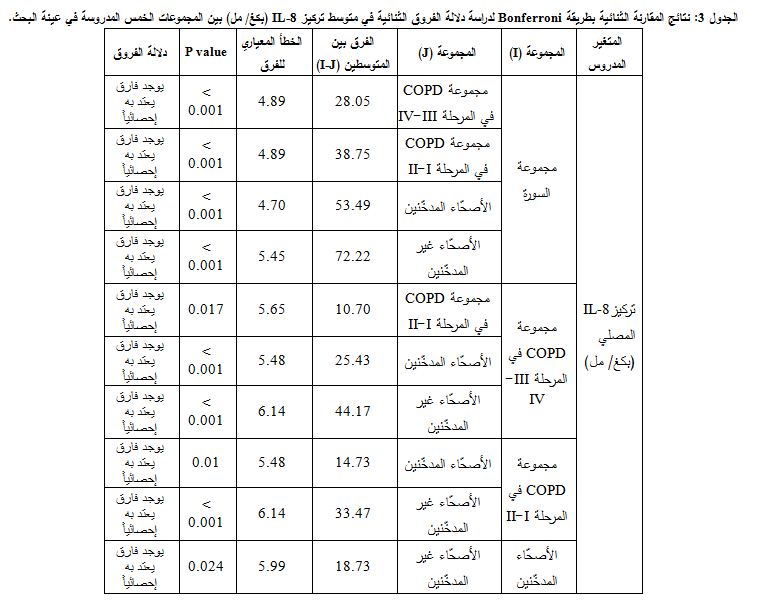
وكانت مستويات IL-8 المصلية لدى مجموعة الأصحاء غير المدخنين 16.0987.812± بكغ/ مل، ولدى مجموعة الأصحاء المدخنين 34.83315.465± بكغ/ مل، ولدى مجموعة مرضى COPD في المرحلتين I-II 49.564± 8.456 بكغ/ مل، ولدى مجموعة مرضى COPD في المرحلتين III-IV 60.266 10.617±بكغ/ مل، ولدى مجموعة السورة 88.319±21.057 بكغ/مل (الشكل 2).
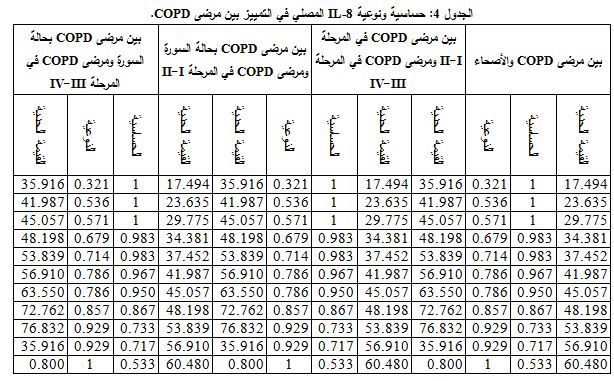
تبين وجود فارق يعتد به إحصائياً في مستويات IL-8 المصلية بين كل مجموعتين من مجموعات الدراسة على حدة (P< 0.05)، أي كانت مستويات IL-8 المصلية أعلى لدى مرضى السورات منها لدى مرضى COPD في المرحلتين III-IV، ولدى مرضى COPD في المرحلتين III-IV أعلى منها لدى مرضى COPD في المرحلتين I-II، ولدى مرضى COPD في المرحلتين I-II أعلى منها لدى الأصحاء المدخنين وغير المدخنين، كما كانت مستويات IL-8 المصلية لدى الأصحاء المدخنين أعلى منها لدى الأصحاء غير المدخنين وبفارق يعتد به إحصائياً (الجدول3).
حساسية ونوعية IL-8 المصلي في التمييز بين مرضى COPD والأصحاء
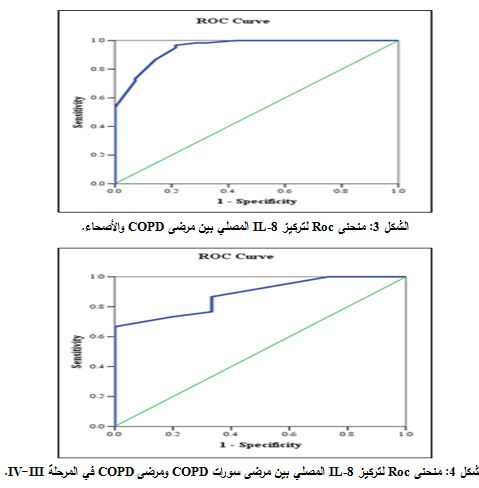
يبين الجدول 4 حساسية ونوعية IL-8 المصلي لدى بعض القيم الحدية cut-offs values، وكان أفضل تناسب بين الحساسية 96.7% والنوعية 78.6% عند القيمة الحدية 41.987 بكغ/ مل، وأعطت هذه القيمة تمييزاً جيداً بين مرضى COPD والأصحاء، حيث كانت المساحة تحت المنحنى تساوي 0.949 (الشكل3).
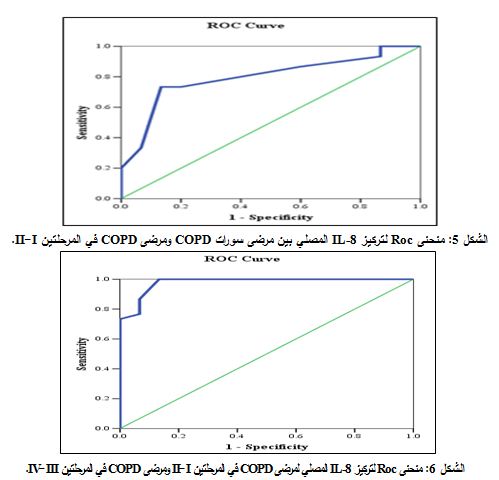
يبين الجدول 4 حساسية ونوعية IL-8 المصلي عند بعض القيم الحدية cut-offs values، وكان أفضل تناسب بين الحساسية 66.7% والنوعية 100% عند القيمة الحدية 78.903 بكغ/ مل، وأعطت هذه القيمة تمييزاً جيداً بين مرضى سورات COPD ومرضى COPD في المرحلتين III-IV، حيث كانت المساحة تحت المنحنى تساوي 0.880 (الشكل 4)، تعد هذه القيمة هي القيمة التشخيصية بين مرضى سورات COPD ومرضى COPD في المرحلتين III-IV وفق ما توصلت إليه دراستنا.
|
|
دراسة الارتباط correlation بين مستويات IL-8 المصلية والنسبة المئوية للعدلات الدموية
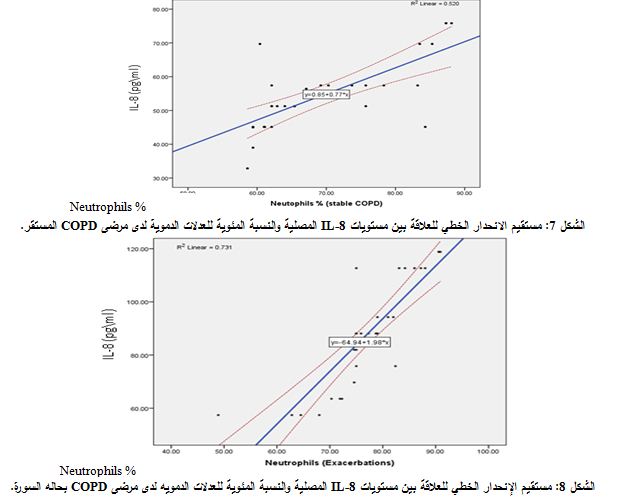
وجد ارتباط إيجابي بين النسبة المئوية للعدلات الدموية ومستويات IL-8 المصلية لدى مرضى COPD المستقر (R=0.77, P<0.01) (الشكل 7) ولدى مرضى COPD في حالة السورة (R=0.855, P<0.01) (الشكل 8).
|
| المناقشة Discussion |
ارتفاع مستويات IL-8 المصلية لدى مرضى COPD مقارنة بالأصحاء أظهرت نتائجنا ارتفاعاً واضحاً في مستويات IL-8 المصلية لدى مجموعة مرضى COPD 23.662±71.617 بكغ/ مل، مقارنة مع الأصحاء 15.847±27.473 بكغ/ مل وبفارق يعتد به إحصائياً (P<0.001).
وأظهرت النتائج أيضاً ارتفاعاً متناسباً مع شدة الداء، حيث كان هنالك ارتفاع واضح في مستوياتIL-8 المصلية لدى مجموعة السورة (±88.31921.057 بكغ/ مل)، مقارنة مع مجموعة مرضى COPD في المرحلتين III-IV (60.266±10.617 بكغ/ مل وبفارق إحصائي معتد به (P< 0.001)، وكذلك بالمقارنة مع مجموعة مرضى COPD في المرحلتين I-II (49.5648.456± بكغ/ مل وبفارق إحصائي معتد به (P<0.001).
وأظهرت نتائجنا وجود فارق يعتد به إحصائياً بين مجموعة مرضى COPD في المرحلتين III-IV ومجموعة مرضى COPD في المرحلتين I-II، حيث كانت قيمة P<0.05.
كما بينت نتائجنا وجود فارق يعتد به إحصائيا بين مجموعة مرضى COPD في المرحلتين III-IV وكل من مجموعتي الأصحاء المدخنين وغير المدخنين (P<0.001) كل على حده، كما كان هنالك فارق يعتد به إحصائياً بين مجموعة مرضى COPD في المرحلتين I-II ومجموعة الأصحاء المدخنين والأصحاء غير المدخنين (P<0.05)، وفارق يعتد به إحصائياً بين مجموعة الأصحاء المدخنين والأصحاء غير المدخنين (P=0.024)، حيث كانت أعلى لدى المدخنين.
ويمكن تفسير هذا الارتفاع الواضح في مستويات IL-8 المصلية والمتناسب مع زيادة شدة الداء الرئوي الانسدادي المزمن، بكون العدلات هي الخلايا الالتهابية الرئيسية في السبل التنفسية لمرضى COPD والتي تنتقل بسرعة إلى السبل التنفسية، حيث تحرر العديد من الوسائط الالتهابية بعد أن يتم تفعيلها مسببة بذلك الأذية المتكررة للسبل التنفسية والتي تنتهي بالانسداد المزمن، هذا ويعد IL-8 أهم الكيموكينات الجاذبة والمفعلة للعدلات، لذلك يعد IL-8 من أهم الكيموكينات الالتهابية المتورطة في الالتهاب الحاصل في COPD. ولذلك فإن زيادة شدة الداء تتناسب طرداً مع زيادة عدد العدلات المفعلة وبالتالي مع كمية IL-8 المنتج. وهذا ما يفسر ارتفاع مستوياته المصلية بشكل متناسب مع زيادة درجة الداء الرئوي الانسدادي المزمن، وهذا يؤكد أهمية استخدام IL-8 كواصم مناعي مصلي لتشخيص الداء الرئوي الانسدادي المزمن والتمييز بين مراحله المختلفة.
توافقت نتائج دراستنا مع دراسة Xie J وزملائه في الصين في العام 2010، والتي تبين وجود فارق يعتد به إحصائياً بين مجموعة السورة وكل من مجموعة الهدأة ومجموعة الأصحاء (P<0.01 بين كل منهما)، ووجود فارق يعتد به إحصائياً بين مجموعة الهدأة والأصحاء (P<0.01) (13)، وكذلك مع دراسة Wafaa S. El-Shimy وزملائها في مصر في العام 2014، حيث بينت ارتفاع مستويات IL-8 المصلية لدى مرضى COPD في المرحلة الشديدة (n=25) وبفارق يُعتد به عنها في المرحلة الخفيفة والمتوسطة (n=25) وعن الأصحاء، وكذلك ارتفاع مستويات IL-8 المصلية لدى مرضى COPD في المرحلة الخفيفة والمتوسطة بفارق يُعتد به أيضاً عنها لدى الأصحاء (14).
كذلك بينت دراسة Garcia-Rio وزملائه في أسبانيا في العام 2010 ارتفاع مستويات IL-8 المصلية لدى مرضى COPD مقارنة بالأصحاء، وكانت التراكيز المصلية للانترلوكين-8 مرتبطة بدرجة اختطار COPD (15)، كذلك دراسة Demirci وزملاؤه في تركيا في العام 2012 والتي بينت ارتفاع مستويات IL-8 المصلية بشكل يتناسب مع زيادة اختطار COPD (16).
وأكد Perng DW وزملاؤه عام 2004 وجود علاقة ارتباط قوية بين تراكيز IL-8 وعدد العدلات في القشع، وبالتالي استنتجوا أنهما مرتبطان بالتعطيل في الوظيفة الرئوية (17)، كما أثبت Fujimoto K وزملاؤه عام 2005 أن تراكيز IL-8 تزداد بشكل ملحوظ في قشع المصابين بـ COPD خلال الهدأة مقارنة بالأصحاء غير المدخنين، وأن هناك زيادة إضافية ملحوظة في تراكيز IL-8 خلال السورات الحادة (18). بينت دراستنا ارتفاع مستويات IL-8 المصلية لدى مرضى COPD (هدأة وسورة) بالمقارنة مع الأصحاء (مدخنين وغير مدخنين)، وكان ذلك الإرتفاع متناسباً مع شدة الداء، أبدى IL-8 عند أفضل تناسب بين الحساسية والنوعية قيمة تنبؤية جيدة في التفريق بين مرضى COPD بحالة السورة ومرضى COPD في المرحلتين III-IV، وقيمة تنبؤية ممتازة في التفريق بين مرضى COPD بحالة السورة ومرضى COPD بالمرحلتين I-II، وقيمة تنبؤية متوسطة في التفريق بين مرضى COPD في المرحلة III-IV ومرضى COPD بالمرحلتين I-II، وهذا يؤكد أهمية استخدام IL-8 المصلي كواصم حيوي مساعد في تشخيص COPD والتمييز بين مراحله والتنبؤ بحدوث السورات.
كما كانت مستويات IL-8 المصلية لدى الأصحاء المدخنين أعلى منها عند الأصحاء غير المدخنين، مما يشير إلى التأثير الضار لدخان السجائر في تحفيز العملية الالتهابية وتحريض إنتاج IL-8 من الظهارة التنفسية والبالعات القصبية.
|
 |
| المراجع References |
1- Global Intiative for Chronic Obstructive pulmonary disease. global strategy for the diagnosis, management, and preventation of chronic obstructive pulmoary disease In. july 2015.
2- Burge S. and Wedzicha J. A.
COPD exacerbations: definitions and classifications.
Eur Respir J Suppl 41:46s-53s, 2003.
3- Celli B. R. and Barnes P. J.
Exacerbations of chronic obstructive pulmonary disease.
Eur Respir J 29 (6): 1224-1238, 2007.
4-Barnes P; Shapiro S. and Pauwels R.
Chronic obstructive pulmonary disease: molecular and cellularmechanisms.
European Respiratory Journal 22 (4): 672-88, 2003.
5-Hogg J. C. et al.
The nature of small-airway obstruction in chronic obstructive pulmonary disease.
New England Journal of Medicine 350 (26): 2645-2653, 2004.
6- White G. E; Iqbal A. J. and Greaves D. R.
CC chemokine receptors and chronic inflammation--therapeutic opportunities and pharmacological challenges.
Pharmacol Rev 65 (1): 47-89, 2013.
7- Bestebroer J; De Haas C. J. and Van Strijp J. A.
How microorganisms avoid phagocyte attraction.
FEMS Microbiol Rev 34 (3): 395-414, 2010
8- Allen S. J; Crown S. E. and Handel T. M.
Chemokine: receptor structure, interactions, and antagonism.
Annu Rev Immunol 25: 787-820, 2007.
9- Moser B. and Willimann K.
Chemokines: role in inflammation and immune surveillance.
Ann Rheum Dis 63 Suppl 2: ii84-89, 2004.
10- Chen H; Wang D. and Wang X.
Role of airway epithelium-origin chemokines and their receptors in COPD.
Journal of Epithelial Biology & Pharmacology 3: 26-33, 2010.
11- Traves S. L. and Donnelly L. E.
Chemokines and their receptors as targets
for the treatment of COPD.
Current Respiratory Medicine Reviews 1 (1): 15-32, 2005
12- Rossi G. A.
COPD Patients or ‘Healthy Smokers’: Is IL-8 Synthesis and Release the Borderline?
Respiration 70 (5): 457-459, 2003.
13- Xie J; Yang X. Y; Shi J. D; Deng X. Q. and Long W.
A new inflammation marker of chronic obstructive pulmonary disease-adiponectin.
World J Emerg Med; 1 (3): 190-195, 2010.
14- El-Shimy W. S; El-Dib A. S; Nagy H. M. and Sabry W.
A study of IL-6, IL-8, and TNF-α as inflammatory markers in COPD patients. Egyptian
Journal of Bronchology 8 (2): 91, 2014.
15- Garcia-Rio F; Miravitlles M.; Soriano J. B; Munoz L; Duran-Tauleria E; Sanchez G; Sobradillo V. and Ancochea J.
Systemic inflammation in chronic
obstructive pulmonary disease: a population-based study.
Respir Res; 11: 63, 2010.
16-Demirci N.Y; Atila H.E; Yılmaz K.A. and Erdoğan Y.
Correlation Between High-Resolution Computed Tomography, Neutrophilic Inflammation, Air-way Obstruction and Serum Interleukin-8 Levels in Chronic Obstructive Pulmonary Disease.
J Clin Anal Med; 4 (4): 286-290,2013
17- Perng D.W; Huang H.Y; Chen H. M; Lee Y. C. and Perng R.P.
Characteristics of airway inflammation
and bronchodilator reversibility in COPD: a potential guide to treatment.
CHEST Journal 126 (2): 375-381, 2004.
18- Fujimoto K; Yasuo M; Urushibata K; Hanaoka M; Koizumi T. and Kubo K.
Airway inflammation during stable and acutely exacerbated chronic obstructive pulmonary disease.
Eur Respir J; 25 (4): 640-646, 2005.
|
| |
| المجلد 8 ,
العددان 1 و 2
, رمضان 1437 - تموز (يوليو) 2016 |
|
|
|
