| المجلد 8 ,
العددان 1 و 2
, رمضان 1437 - تموز (يوليو) 2016 |
| |
| تقصي جين هيستون H2B وH3 في الليشمانية المدارية |
| Investigation of H2B and H3 Genes in Leishmania Tropica |
| د. مروة الحبش1 وأ. د. محمد معروف1،2 |
| AL Habash M. 1 and Maarouf M. 1,2 |
1كلية الصيدلة، 2مركز الدراسات الوبائية والبيولوجية لطفيليات الليشمانية، جامعة دمشق
1Faculty of Pharmacy, 2LECEBS, Damascus University
|
| الملخص Abstract |
| يُعد داء الليشمانيات الجلدي الذي تسببه الليشمانية المدارية أحد المشاكل الصحية الهامة في سورية، التي تفاقمت بعد الأحداث الأخيرة فيها. تشكل الوقاية من داء الليشمانيات أهمية كبيرة لمنع الانتشار العالي للعدوى في سورية، وتشكل لقاحات الدنا DNA أملاً واعداً في هذا المجال. ونظراً لأهمية هيستونات اللب النووي بالنسبة لحياة الطفيليات، فقد اخترنا جينين منها، جيني H2B وH3، لتصميم لقاح دنا DNA ضد الإصابة بالليشمانية المدارية. هدفت دراستنا إلى استقصاء وجود هذين الجينين لدى سلالة سورية لليشمانية المدارية والتعبير عنهما لدى مشيقات هذه الطفيليات. قمنا بعزل الدنا DNA والرنا RNA من الطفيليات واصطناع الدنا المتمم cDNA، وقمنا بتصميم المشارع الضرورية لتضخيم هذين الجينين وأمثلة شروط تفاعل PCR. استطعنا اثبات وجود الجينين لدى مشيقات الليشمانية المدارية. بلغ حجم جيني H2B و H3336 و393 زوج أساس، على الترتيب. كما اثبتنا حدوث التعبير عن هذين الجينين لدى هذه الطفيليات، من خلال إثبات وجودهما في الرنا المستخلص من مشيقات الليشمانية المدارية وتضخيم الدنا المتمم لهذين الجينين. |
| Cutaneous Leishmaniasis caused by Leishmania tropica is one of the most important health issues in Syria, which exacerbated after what is happening in Syria. Prevention from Leishmaniasis is very important to prevent the high prevalence of infection in Syria. DNA vaccine is a promising hope in this field. Nucleosomal core histones are very important for the parasites life, so we choose two of their genes, H2B and H3 genes, to design a DNA vaccine against the infection with L. tropica. Our study aimed to investigate the existence of H2B and H3 genes in a Syrian strain of L. tropica promastigotes and their expression. We isolated DNA and RNA from these parasites, synthesized cDNA, design the necessary primers for gene`s amplification, and standardization of PCR condtions. We proved existence of these genes in L. tropica promastigotes. Their sizes of H2B and H3 genes were 336 and 393 bp, respectively. Expression was also proved in these parasites, through proving their existence in the extracted RNA of Leishmania tropica promastigotes and amplification the complementary DNA of these genes. |
| المقدمة Introduction |
تعرّف أدواء الليشمانيات Leishmaniasis بأنها مجموعة من الآفات التي تصيب الجلد والأغشية المخاطية والأحشاء وتسببها طفيليات من شعبة الحيوانات الأولي protozoa من جنس الليشمانية Leishmania. تنتقل طفيليات الليشمانية إلى الإنسان بواسطة ذبابة الرمل (Noazin et al. 2008). يصيب داء الليشمانيات حوالي 1.2 مليون شخص سنوياً في العالم في المناطق المدارية وتحت المدارية (http://www.cdc.gov/parasites/leishma-niasis/epi.html).
شُخصت 80% من الإصابات بداء الليشمانيات الجلدي في عشرة دول، واحدة منها سورية، وقد ساهمت الأحداث الأخيرة في ارتفاع عدد الإصابات بشكل كبير فيها (Hayaniet al. 2015b). وتتراوح شدة الإصابة بداء الليشمانيات بين آفات جلدية سليمة العواقب إلى عداوى جهازية خطرة وقاتلة. ترتبط مقاومة المضيف للعدوى باستجابة مناعية من نمط الخلايا التائية المساعدة Th1 تؤدي إلى تفعيل البلاعم وقتل الطفيليات بداخلها بآلية تعتمد على تشكيل أكسيد النتريك، بينما يرتبط تطور العدوى عادة باستجابة مناعية من نمط الخلايا التائية المساعدة Th2 تؤدي إلى تفعيل المناعة الخلطية (Mutiso 2013).
أظهر تحرٍ أجري على مصول مرضى مصابين بالليشمانية الحشوية وجود العديد من المُستمنعات كالبروتينات غير المفرزة والتي تشكل الهيستونات جزءاً منها (Soto et al. 1993) (MacFarlane (et al. 1990 (Soto et al. 1999). تسمى هذه البروتينات الداخل خلوية "ومن ضمنها الهيستونات" المصانة بشكل كبير والمحرضة لاستجابات مناعية خلطية وخلوية قوية ونوعية، بمستضدات Panantigens (Requenaet al. 2000 ) (SOTO et al. 1999) (Quijada et al. 1996).
تعد الهيستونات بروتينات بنيوية تملك دوراً هاماً في تنظيم وظيفة الدنا وتنظيم عملية النسخ وتعديلات ما بعد الترجمة. وهنالك أربعة أصناف هامة من الهيستونات H2A وH2B وH3 وH4 والتي تشكل لب الجسيم النووي. وتعد هذه البروتيات ذات الوزن الجزيئي المنخفض أكثر البروتينات صوناً ضمن الكائنات حقيقية النواة (Galanti et al. 1998). لقد جرى إثبات وجود أضداد الهيستونات في مصول الكلاب المصابة بداء الليشمانية الطفلية Leishmania infantum الحشوي ومصول المصابين بداء الليشمانية الحشوي، مما سمح باستخدامها كمعلم تشخيصي للإصابة (Soto et al. 1992). على الرغم من كون هذه الهيستونات مصانة بشكل كبير، فإن الاستجابة الخلطية تجاه هذه الهيستونات أثناء الإصابة ناجمة فقط من هيستونات الطفيلي، حيث لم يلاحظ نهائياً حدوث رد فعل مناعي تجاه هيستونات المضيف (Soto et al. 1999) (Soto et al. 1995) (SOTO et al. 1996). أظهر التمنيع بلقاح دنا يشفر لهيستونات الليشمانية الطفلية الأربعة معاً قدرة عالية على توليد استجابة خلوية نوعية من نمط Th1 تجاه الإصابة بالليشمانية الجلدية وقدرة وقائية دائمة تجاه الإصابة بالليشمانية الجلدية لدى فئران BALB\c (Carrión et al. 2008). وبين Iborraأن تمنيع الفئران ببلازميد يشفر للأربعة هيستونات لليشمانية الطفلية، حرض استجابة مناعية خلوية نوعية من نمط Th1 وأدى إلى وقايتها من الإصابة بالليشمانية الكبيرة Leishmania major (Iborra et al. 2004). وبالتالي يمكن أن يؤدي استخدام هيستونات الليشمانية المدارية قي التلقيح أملاً واعداً لتخفيض عدد الإصابات المشخصة بداء الليشمانيات الجلدي في سورية والتي ينجم معظمها من الإصابة بالليشمانية المدارية. وبالتالي فقد قررنا القيام بهذ الدراسة واخترنا جيني الهيستونين H2B وH3 كهدف لنا.
ونظراً لعدم نشر تسلسل جينوم الليشمانية المدارية بشكل كامل حتى الآن وعدم وجود أية دراسة تشير إلى وجود الجينين المختارين في دراستنا في جينوم الليشمانية المدارية، فقد قمنا بهذه الدراسة بهدف تحري وجود جين الهيستون H2B وH3 عند الليشمانية المدارية المنتشرة في سورية، وتحري التعبير الجيني عن الجين H2B والجين H3 على مستوى الدنا المتمم لطفيليات الليشمانية المدارية.
|
| المواد والطرق |
1- تصميم مشارع لتضخيم جيني H2B وH3
تمت دراسة تسلسلات الجينات لدى الأنواع الأخرى من الليشمانية باستخدام برنامجي Vector NTI Express وCLC free workbench 7، والتطبيقات التالية :
أ- http://www.ebi.ac.uk/Tools/services/web/toolresult.ebi?jobId=clustalw2-I20131227-140338-0512-30396697-oy
ب- http://www.ebi.ac.uk/Tools/psa/emboss_needle/nucleotide.html
صممت المشارع باستخدام التطبيقات التالية
أ- http://www.idtdna.com/calc/analyzer
ب- http://www.geneinfinity.org/sms/sms-
primanalysis.html
أُضيفت تسلسلات التعرف لإنزيمي القطع ECORI و XBAI لتسلسل المشارع المستخدمة لتضخيم جين H2B وتسلسلات التعرف لإنزيمي القطع XBAI وSALI لتسلسل المشارع المستخدمة لتضخيم جين H3. اختيرت الإنزيمات السابقة لأنها تسمح باتمام العمل في خطوة لاحقة وتنسيل هذه الجينات في بلازميد PCI لتصميم لقاح دنا يحوي الجين وتقييم قدرته الاستمناعية لدى فئران التجربة BALB\c. صُنعت مشارع عالية النقاوة وفقاً للتسلسلات التي قمنا باختيارها من قبل شركة VBC- Biotech، فيينا.
التسلسل النهائي للمشارع اللازمة لتضخيم جين H2B
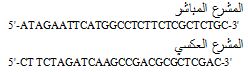 |
تسلسل التعرف لإنزيم ECORI: GAATTC, تسلسل التعرف لإنزيم XBAI: TCTAGA.
التسلسل النهائي للمشارع اللازمة لتضخيم جين H3

2- تضخيم الجينات المختارة باستخدام المشارع النوعية لكل جين على مستوى الدنا والدنا المتمم
2-1- استخلاص الدنا من طفيليات الليشمانية جرى استخدام مشيقات ذرية strain من طفيليات الليشمانية المدارية L.tropica المأخوذة من مركز الدراسات الوبائية والبيولوجية لطفيليات الليشمانية. عُزل الدنا من الطفيليات المزروعة على وسط RPMI-1640 لشركة Lonza الأميركية والمدعم بمصل العجل الجنيني منزوع المتممة لشركة Cytogen الاميركية، باستخدام عتيدة عزل الدنا من شركة Thermoscientific الأميركية.
2-2- استخلاص الرنا RNA من طفيليات الليشمانية
استُخلص الرنا من طفيليات الليشمانية باستخدام عتيدة عزل الرنا GeneJET RNA purification من شركة Thermoscientific الأميركية.
2-3- اصطناع الدنا المتممcDNA
اصطنع الدنا المتمم من الرنا المستخلص من طفيليات الليشمانية المدارية باستخدام عتيدة اصطناع الدنا المتمم Revert Aid First Strand cDNA Synthesis من شركة Thermo Scientific الأميركية.
2-4- تضخيم الدنا DNA والدنا المتمم cDNA لجيني H2B وH3 بتفاعل التضخيم التسلسلي PCR
استخدمت عتيدة PCR Mater mix من شركة Thermo scientific الأميركية، صُنّعت المشارع التي قمنا بتصميمها بنقاوة عالية، من قبل شركة VBC-Biotech في فيينا.
ضُخم الجينين H2B وH3 باستخدام المشارع الخاصة التي صممناها لكل منهما. قمنا بأمثلة بروتوكول تفاعل الـ PCR المطلوب لتضخيم كل جين من الجينين باستخدام برنامج التدرج الحراري لاختيار درجة حرارة الالتحام الملائمة. يتألف مزيج تفاعل تضخيم كلا الجينين من 25 مكل تحتوي 1 مكل من محلول المشرع الأمامي ذو التركيز 10 مكرومول، 1 مكل من محلول المشرع العكسي ذو التركيز 10 مكرومول، 2,5 مكل من المرصاف سواء دنا أو دنا متمم، 12,5 مكل PCR master mix، 8 مكل ماء PCR. وكان بروتوكول تفاعل PCR لجين H2B كما يلي: دورة واحدة من التمسخ البدئي لمدة 5 دقائق بدرجة حرارة 95ºC، 35 دورة تتالف كل منها من التمسخ لمدة 1 دقيقة بدرجة حرارة 95ºC والالتحام لمدة 45 ثانية بدرجة حرارة 61ºC والاستطالة لمدة 1 دقيقة بدرجة حرارة 72ºC، وأخيراً دورة واحدة من الاستطالة النهائية لمدة 5 دقائق بدرجة حرارة 72ºC. جرى تضخيم الجين H3 وفقاً للبروتوكول السابق مع تغيير درجة حرارة الالتحام بحيث أصبحت 58ºC.
3- الرحلان الكهربائي لنواتج تضخيم الجينين
جرى ترحيل نواتج PCR للجينين المضخمين على هلامة أغاروز تركيزها 2% ملونة ببروميد الإيثيديوم.
|
| النتائج Results |
1- تقييم جودة الدنا المستخلص من طفليليات الليشمانية المدارية
أظهر ترحيل الدنا المستخلص من الطفيليات على هلامة أغاروز بتركيز0.8% وجود عصابة واحدة، مما يشير إلى جودة استخلاص الدنا وعدم تدركه. عوير الدنا المستخلص من 100 مليون من طفيليات الليشمانية المدارية، وقيست نقاوته فكان تركيز الدنا المستخلص مساوياً 190 نانوغرام/مكل، وكانت النسبة A260/A280 تساوي 1.8، مما يشير إلى نقاوة عالية لعينة الدنا المستخلصة وخلوها بشكل شبه كامل من البروتينات (الشكل 1).
2- أمثلة شروط تفاعل التضخيم التسلسلي PCR لجيني H2B وH3
جرت أمثلة شروط تفاعل تضخيم الجينين واستطعنا تضخيمهما وفقاً للبروتوكول المذكور سابقاً في فقرة الطرق، وتمكنا من اختيار درجة الالتحام الملائمة للمشارع المصممة لكل جين، بعد إجراء تفاعل حراري متدرج واختيار درجة الالتحام المثلى لكل منهما وبلغت درجة حرارة الالتحام المثلى لجين H2B 61ºC و58ºC لجين H3.
3- نتائج تضخيم جيني H2B وH3
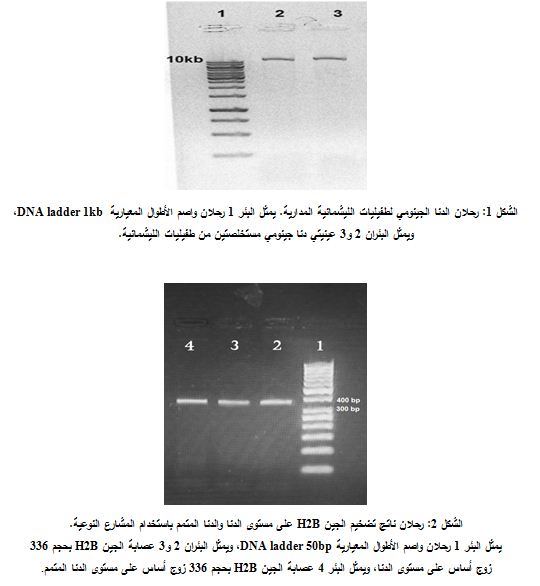
أظهرت نتائج الرحلان الكهربائي على هلامة أغاروز 2% لناتج تفاعل التضخيم التسلسلي لجين H2B، باستخدام المشرع المباشر والمشرع العكسي، وجود عصابة واحدة فقط (الشكل 2) بطول 336 bp. يعكس عدم تضخيم أي جين آخر نوعية المشارع المصممة للجين H2B. وهكذا نكون قد أثبتنا وجود جين H2B ضمن جينوم الليشمانية المدارية المستخدمة في دراستنا بطول جين H2B نفسه لدى الليشمانية الطفلية والكبيرة.
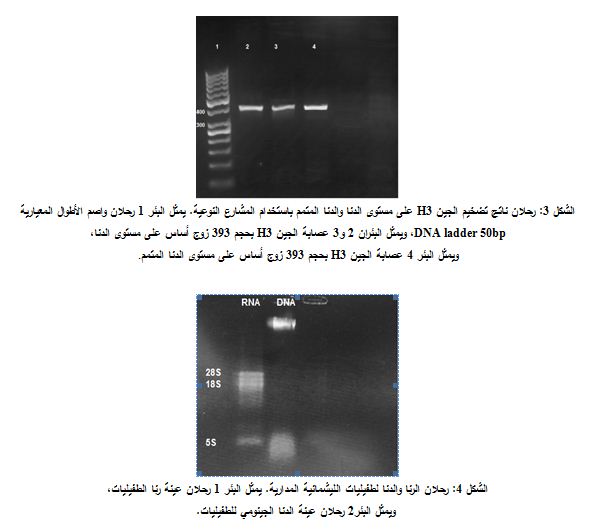
أظهرت نتائج الرحلان الكهربائي على هلامة أغاروز 2% لناتج تفاعل التضخيم التسلسلي لجين H3 باستخدام المشرع المباشر والمشرع العكسي عصابة واحدة فقط (الشكل 3) بطول 393 bp. يعكس عدم تضخيم أي جين آخر نوعية المشارع المصممة للجين H3. وهكذا نكون قد أثبتنا وجود جين H3 ضمن جينوم الليشمانية المدارية المستخدمة في دراستنا.
4- تقييم جودة الرنا RNA المستخلص من طفيليات الليشمانية المدارية
جرى التأكد من جودة الرنا المستخلص من الطفيليات، حيث قيست نقاوته بجهاز NANO DROP وبلغت 2.1 وبلغ تركيز العينة 1500 نانوغرام /مكل وبالتالي بلغ مردود الاستخلاص 52.5 مكغ. أظهر ترحيل عينة الرنا المستخلصة بوساطة الرحلان الكهربائي الأفقي على هلامة أغاروز بتركيز 0.8%، بعد تعريض الهلامة لمنبع الأشعة فوق البنفسجية، وجود عصابتي 28s و18s واضحتين وعصابة 5S، بينما لم يظهر عصابة للدنا مما يدل على عدم تلوث الرنا بالدنا الجينومي (الشكل 4).
5- تضخيم الدنا المتمم للجينين المختارين
أظهرت نتائج الرحلان الكهربائي على هلامة الأغاروز 2% لناتج التضخيم التسلسلي للبوليمراز لجين H2B باستخدام المشرع المباشر والمشرع العكسي (الشكل 2) وجود عصابة واحدة بطول 336 bp، مما يثبت حدوث التعبير عن هذا الجين.
أظهرت نتائج الرحلان الكهربائي أيضاً على هلامة الأغاروز 2% لناتج التضخيم التسلسلي للبوليمراز لجين H3 باستخدام المشرع المباشر والمشرع العكسي (الشكل 3) وجود عصابة واحدة بطول 393 bp، مما يثبت حدوث التعبير عن هذا الجين.
سمح تضخيم الدنا المتمم للجينين المختارين، باستخدام المشارع النوعية لكل منهما، بإثبات التعبير الجيني عنهما ضمن الليشمانية المدارية.
|
|
| المناقشة Discussion |
تشكل لقاحات الدنا أحد الخيارات المهمة في استراتيجية البحث عن لقاح فعال ضد داء الليشمانيات. وتمتاز هذه اللقاحات بقدرتها على تفعيل استجابة خلوية من نمط Th1 تساهم بشكل أساسي في شفاء العداوى بطفيليات الليشمانية (Carrión et al. 2008) (Carrión et al.2009) (Carneiro et al. 2012). وفي الحقيقة يُعد داء الليشمانيات وخاصة الجلدي داءً مستوطناً في سورية ومنطقة الشرق الأوسط منذ فترة طويلة وكان يسمى بحبة حلب وتسميات أخرى شملت حبة بغداد وغيرها. تعود معظم الإصابات في سورية لطفيليات الليشمانية المدارية بشكل رئيسي بينما يعود الباقي للإصابة بطفيليات الليشمانية الكبيرة. ترافقت الأزمة التي تعاني منها سورية مع تخريب في البنى التحتية، مما أدى إلى زيادة انتشار العديد من العداوى المكروبية وخاصة داء الليشمانيات (Hayani et al. 2015a). يعاني القيمون على مكافحة داء الليشمانيات من عدم وجود دواء نوعي آمن وفعال وعدم وجود لقاح فعال حتى الآن (Dumonteil 2007). وبالتالي يشكل البحث عن لقاح فعال هدفاً هاماً للباحثين بشكل عام والسوريين منهم بشكل خاص. يشكل اللقاح الجيني خياراً جيداً لكنه يتطلب توفر معلومات مفصلة عن الجينات الهامة للطفيليات المنتشرة في سورية، بشكل خاص الليشمانية المدارية، ودورها الوظيفي. يعود اختيار الجينات التي يمكن استخدامها في اللقاح الجيني إلى أهميتها وقدرتها الاستمناعية وقدرتها على تحريض وقاية طويلة الامد تجاه العدوى بطفيليات الليشمانية. في الحقيقة سمح استخدام جينات الهيستونات بالوقاية من الإصابة بالعديد من طفيليات الليشمانية كالليشمانية الكبيرة والطفلية ( Carrión et al. 2008)، مما لفت انتباهنا لهذه الجينات ولإمكان استخدامها في الوقاية من طفيليات الليشمانية المدارية. ويتطلب ما سبق توافر معلومات عن وجود هذه الجينات لدى الليشمانية المدارية ودورها الوظيفي ولكن للأسف لم يجرٍ حتى الآن نشر تسلسل جينوم الليشمانية المدارية بشكل كامل ولا توجد أية دراسة تشير إلى وجود جينات هذه الهيستونات في جينوم الليشمانية المدارية. وبالتالي كان لا بد من إجراء خطوة أولى تهدف إلى اثبات وجود هذه الجينات ضمن الجينوم لنتمكن من استخدامها لاحقاً في تصميم اللقاح المطلوب. لذلك قررنا القيام بدراسة منهجية لجينات هيستونات اللب النووي وبدأنا بالهيستونين H2B و.H3
يتطلب إثبات وجود هذين الجينين استخدام مشارع نوعية تسمح بتضخيمهما بوساطة تفاعل .PCR يتطلب تصميم المشارع مقارنة تطابق تسلسلات الجينين لدى الأنواع الأخرى من الليشمانية. لذلك أجريت دراسة حاسوبية لتسلسلات هاتين الجينين عند أنواع أخرى من الليشمانية كالليشمانية الكبيرة، والدونوفانية، والطفلية، والبرازيلية، والمكسيكية. سمحت الدراسة الحاسوبية بمعرفة مدى التطابق بين تسلسلات الجين في هذه الأنواع، ومدى التطابق بين هذه التسلسلات والجينوم البشري، وتصميم المشارع النوعية لتضخيم الجينين وبالتالي تمكنا من تصميم المشارع المناسبة لتضخيم هذين الجينين. بعد تصميم المشارع كان لا بد من اختيار الشروط المثلى لتفاعل التضخيم التسلسلي ولم نتمكن من مقارنة شروط تفاعلنا مع باقي الدراسات المتعلقة بهذين الجينين نظراً لعدم نشر شروط تفاعل PCR في هذه الدراسات. واستطعنا الحصول على تضخيم جيد للجينين، مما أثبت نوعية المشارع المصممة من قبلنا. وسمح ترحيل نواتج تفاعل PCR لتضخيم الجينين بالحكم على نوعية هذه المشارع نتيجة لوجود عصابة واحدة تمثل فقط الجين المطلوب تضخيمه، حيث بلغ حجمه 336 زوج أساس بالنسبة لجين H2B و393 زوج أساس بالنسبة لجين .H3 تطابق حجم هذين الجينين لدى الليشمانية المدارية مع نظيريهما لدى باقي أنواع الليشمانية. وبهذا نكون قد أثبتنا وجود هذين الجينين في جينوم الليشمانية المدارية.
لكن يبقى السؤال هل يجري التعبير عن الجينين السابقين أم لا؟. لتحقيق ذلك قمنا بعزل الرنا من طفيليات الليشمانية المدارية المستخدمة في دراستنا وقمنا بتحويله إلى الدنا المتمم cDNA ومن ثم إجراء تفاعل PCR باستخدام الدنا المتمم كمرصاف، باستخدام المشارع النوعية لكل جين والتي صممناها وذكرت سابقاً. وكذلك الأمر أظهر رحلان نواتج تفاعل PCR السابق وجود عصابة واحدة لكل جين يمتلك الحجم نفسه للجين التي حصلنا عليها على مستوى الدنا. تطابق حجم هذين الجينين لدى الليشمانية المدارية مع حجم هذين الجينين لدى الأنواع الاخرى من الليشمانية. وهكذا نكون قد أثبتنا حدوث الانتساخ الذي يشكل المرحلة الأولى من مراحل التعبير الجيني. وبالتالي أصبح استخدام هاتين الجينين ممكناً من الناحية التقنية والتطبيقية لتصميم لقاح دنا ضد الليشمانية المدارية وتقييم قدرته الاستمناعية وهو أمر قيد التطبيق. كما ستجري سلْسَلة هذين الجينين لمقارنة تسلسليهما مع تسلسلي هذين الجينين لدى الأنواع الأخرى من الليشمانية.
|
| الاستنتاجات Conclusion |
| تبين وجود جيني الهيستون H2B والهيستون H3 لدى سلالة ليشمانية مدارية سورية وتبين أيضاً وجودهما على مستوى الرنا لهذه الطفيليات. |
| المراجع References |
1- Carneiro M.W. Santos D.M, Fukutani K.F, Clarencio J, Miranda J .C, Brodskyn C, Barral A, Netto M.B, Soto M, Oliveira C. Vaccination with L. infantum chagasi Nucleosomal Histones Confers Protection against New World Cutaneous Leishmaniasis Caused by Leishmania braziliensis, PLoS ONE, 7(12), 2012.
2- Carrión, J;Folgueira C. & Alonso C. Development of Immunization Strategies against Leishmaniosis based on the Leishmania Histones Pathoantigens, Procedia in vaccinology, 1(1), 101–103, 2009.
3- Carrión, J;Folgueira C. & Alonso C. Transitory or long-lasting immunity to Leishmania major infection: The result of immunogenicity and multicomponent properties of histone DNA vaccines, Vaccine, 26(9), 1155–1165, 2008.
4- Dumonteil E.
DNA Vaccines against Protozoan Parasites: Advances and Challenges, Journal of biomedicine & biotechnology, 2007(6), 90520, 2007.
5- Galanti, N;Galindo M;Sabaj V;Espinoza I. and Toro GC.
Histone genes in trypanosomatids, Parasitology today (Personal ed.), 14(2), 64–70. 1998.
6- Hayani, K;Dandashli, A. & Weisshaar, E. Cutaneous Leishmaniasis in Syria: Clinical Features, Current Status and the Effects of War.
Acta Dermato-Venereologica, 95(1), 62-66, 2015.
8- Iborra S; Soto M; Carrión J; Alonso C. and Requena JM.
Vaccination with a plasmid DNA cocktail encoding the nucleosomal histones of Leishmania confers protection against murine cutaneous leishmaniosis, Vaccine, 22(29-30), pp.3865–3876, 2004.
9- MacFarlane J; Blaxter ML; Bishop RP; Miles MA. and Kelly JM.
Identification and characterisation of a
Leishmania donovani antigen belonging to the 70-kDa heat-shock protein family, European journal of biochemistry/ FEBS, 190(2), 377–84, 1990.
10- Mutiso, J.M;Macharia JC;Kiio MN;Ichagichu JM;Rikoi H;Gicheru MM. Development of Leishmania vaccines: predicting the future from past and present experience, Journal of Biomedical Research, 27(2), 85–102, 2013.
11- Noazin S;Noazin S;Modabber F;Khamesipour A;Smith PG;Moulton LH;Nasseri K;Sharifi I;Khalil EA;Bernal ID;Antunes CM;Kieny MP;Tanner M. First generation leishmaniasis vaccines: A review of field efficacy trials, Vaccine, 26(52), 6759–6767, 2008.
12- Quijada, L;Requena JM;Soto M;Alonso C. During canine viscero-cutaneous leishmaniasis the anti-Hsp70 antibodies are specifically elicited by the parasite protein, Parasitology, 112 ( Pt 3), 277–84, 1996.
13- Requena J.M; Alonso C;Soto M. Evolutionarily Conserved Proteins as Prominent Immunogens during Leishmania Infections, Parasitol Today, 16(6), 246-50, 2000.
14- SOTO M;Requena JM; Quijada L; Perez MJ;Nieto CG;Guzman F;Patarroyo ME;Alonso C;
Antigenicity of the Leishmania infantum histones H2B and H4 during canine viscerocutaneous leishmaniasis, Clinical and Experimental Immunology, 115(2), 342–349, 1999.
15- Soto, M; Requena JM; Quijada L; Gómez LC; Guzman F; Patarroyo ME; Alonso C.
Characterization of the antigenic determinants of the Leishmania infantum histone H3 recognized by antibodies elicited during canine visceral leishmaniasis.
Clinical and Experimental Immunology, 106(3), 454–461, 1996.
16- Soto M.;Requena JM;Garcia M;Gómez LC;Navarrete I;Alonso C.
Genomic organization and expression of two independent gene arrays coding for two antigenic acidic ribosomal proteins of Leishmania.
The Journal of biological chemistry, 268(29), 21835–43, 1993.
17- Soto M;Requena JM;Quijada L;García M;Guzman F;Patarroyo ME;Alonso C.
Mapping of the linear antigenic determinants from the Leishmania infantum histone H2A recognized by sera from dogs with leishmaniasis.
Immunology Letters, 48(3), 209–214, 1995.
18- Soto M;Requena JM;Gomez LC;Navarrete I;Alonso C.
Molecular characterization of a Leishmania donovani infantum antigen identified as histone H2A.
European journal of biochemistry/ FEBS, 205, 211–216, 1992.
19- http://www.cdc.gov/parasites/
leishmaniasis/epi.html. accessed on 23\3\2016.
|
| |
| المجلد 8 ,
العددان 1 و 2
, رمضان 1437 - تموز (يوليو) 2016 |
|
|
|
