| المجلد 8 , العدد 3-4 , ربيع الثاني 1438 - كانون الثاني (يناير) 2017 |
| |
| مقارنة عتيدة ELISA مع عتيدة CMIA للكشف عن HBsAg وAnti-HCV لدى مراجعي مراكز صحية في دمشق |
| Comparison of ELISA Kit with CMIA Kit for HBsAg and
Anti-HCV Detection in Individuals Referring to Health Care Centers in Damascus
|
| د. وداد يازجي1 و أ. د. فوزة منعم 1,2 |
| Widad Yazaji1, Fawza Monem1,2 |
1 كلية الصيدلة، جامعة دمشق
2 مستشفى الأسد الجامعي، جامعة دمشق
Faculty of Pharmacy, Damascus University1
Al Assad university hospital, Damascus University2
|
| الملخص Abstract |
الهدف: هدفت هذه الدراسة إلى تقييم حساسية ونوعية عتيدة ELISA مع عتيدةCMIA في الكشف عن كل من الواصمات الفيروسيةHBsAg وanti-HCV.
أجريت اختبارات الكشف عنHBsAg وanti-HCV بعتيدتيELISA (Biokit، اسبانيا) وCMIA (Abbott، الولايات المتحدة الأمريكية) على 159 عينة مصلية. قورنت نتائج المقايستين وحسبت قيمة حساسية ونوعية ELISA اعتماداً على القيم الحقيقية لمقايسةCMIA . ورُسم منحنى ROC واعتبرت P< 0.05 معتداً بها إحصائياً.
أظهرت نتائجنا أن 157/159 عينة سلبية HBsAg في كل من المقايستين، وكانت 2/159 عينة إيجابية HBsAg كل واحدة منها بإحدى المقايستين. في حين 159/139 عينة كانت سلبية anti-HCV و8/159 عينة كانت إيجابية anti-HCV في كلٍ من المقايستين، في الوقت نفسه فإن 10/159 كانت إيجابية بمقايسة ELISA فقط و2/159 عينة إيجابية بمقايسة CMIA فقط. بلغت المساحة تحت منحنى ROC 0.592 (P>0.05).
خلصت دراستنا إلى أن طريقةELISA أقل كفاءة منCMIA في تحري مأمونية الدم والتشخيص بسبب نقص حساسيتها ونوعيتها.
|
This study aimed to evaluate sensitivity and specificity of ELISA kit compared with CMIA kit for the detection of HBsAg and anti-HCV.
159 serological samples were tested for HBsAg and anti-HCV by ELISA (Biokit, Spain) and CMIA (Abbott, USA) kits. The results of two assays were compared; and ELISA sensitivity and specificity were calculated considering true values of CMIA. ROC curve was plotted. P<0.05 was considered statistically significant.
Our results revealed that 157/159 samples were negative for HBsAg in both assays, and 2/159 samples were positive for HBsAg, one in each assay. ًWhereas, 139/159 and 8/159 samples were negative and positive for anti-HCV, respectively, in both assays, meanwhile, 10/159 samples were positive by ELISA assay only and 2/159 samples were positive by CMIA assay only. AUC under ROC curve was 0.592 (P> 0.05).
Our study concluded that ELISA method was not efficient as CMIA for blood screening and diagnosis due to its low sensitivity and specificity.
|
| المقدمة Introduction |
يحمل الكشف عن الواصمات الفيروسية virological markers، سواء أثناء تحري مأمونية الدم أو تشخيص العداوى بهذه الفيروسات، أهمية كبرى من حيث حساسية ونوعية طرق الكشف المتبعة في التحري أو التشخيص، حيث يكون للحساسية الدور الأهم في حال تحري مأمونية الدم، بينما يكون للنوعية أهمية أثناء التشخيص والمعالجة (1). تعرَف الحساسية بأنها قدرة مقايسة ما على كشف الأفراد المصابين فعلاً، أما النوعية فهي قدرة مقايسة ما على استعراف صحيح للأفراد غير المصابين جميعهم دون وجود إيجابيات كاذبة (2).
يعد المستضد السطحي لفيروس التهاب الكبد البائي ((HBsAg الواصم المصلي الأول الذي يظهر بعد التعرض للعدوى بفيروس التهاب الكبد البائي B (HBV) ويستمر وجوده في المصل في حال تحول العدوى إلى الشكل المزمن (3). كما تعد أضداد فيروس التهاب الكبد (anti-HCV) C واصماً أولياً للإصابة بعدوى التهاب الكبد C (HCV) (4).
من أكثر المقايسات استخداماً لكشف هذه الواصمات
الفيروسية مقايسة الممتز المناعي المرتبط بالإنزيم (ELISA) Enzyme Linked Immuno Sorbant Assay ، والمقايسة المناعية للجسيمات المكروية اللامعة كيميائياً (CMIA) Chemiluminesecent Microparticle Immnoassay. وتعد CMIA مقايسة مصلية دقيقة وسريعة وعالية الحساسية والنوعية (5)، وتُستخدم جزيئات مولدة للضوء مثل استرات الأكريدينيوم كواسمات labels من أجل تفاعل اللمعان الكيميائي (3)، وهو ما يزيد من حساسيتها بالمقارنة مع مقايسة ELISA، التي تشابه من حيث مبدئها طريقة CMIA، لكنها تختلف عنها في قياسها لتبدل اللون الناتج عن تفاعل ركيزة substrate المقايسة مع الإنزيم الذي جرى وسم الأضداد به (6). تتميزELISA بسهولة استخدامها وآليتها automation بالإضافة إلى جدواها الاقتصادية (7). ولقد جرى تطوير أجيال متتالية من عتائد مقايسة ELISA، من خلال إضافة مستضدات جديدة لتضييق نافذة الكشف detection window (6)، مما ساعد في تحسين حساسيتها، لكن لم تتحسن نوعيتها (8)، وتعد الإيجابية المصلية الكاذبة أحد عيوب هذه المقايسة، مما يؤدي إلى الأذى النفسي للمرضى عند تشخيصهم ومتابعتهم الطبية (9).
ونظراً لوجود التباين في حساسية ونوعية عتائد ELISA المستخدمة في التشخيص فلقد هدفت دراستنا إلى مقارنة حساسية ونوعية تقنية ELISA مع تقنية CMIA في الكشف عن كل من HBsAg وanti-HCV في عيناتٍ مصلية لتقييم استخدامها في تحري مأمونية الدم وتشخيص العداوى معاً.
|
| المواد والطرقMaterials and Methods |
شملت هذه الدراسة 159 عينة مصلية جرى الحصول عليها من مراجعي مركز التلاسيمية الوطني ومستشفى الأطفال الجامعي في مدينة دمشق، بين تشرين الأول 2012 وكانون الأول 2013، بعد الحصول على الموافقات المستنيرة من المرضى جميعهم أو ذويهم. جُمع5 مل من الدم المحيطي من كل مراجع باستخدام الأنابيب الجافة المخلاة، ونُبذت العينات بسرعة 2800 xg للحصول على المصل الذي حُفظ في الدرجة -80°C إلى حين إجراء الاختبارات المصلية. وشملت الاختبارات المصلية الكشف عن المستضد السطحي لفيروس التهاب الكبد البائيHBsAg ، وأَضداد فيروس التهاب الكبد C بمقايسة الممتز المناعي المرتبط بالإنزيم ELISA باستخدام عتائد Bioelisa (شركة BioKit، اسبانيا)، وحُسبت حدود القيم الحديةcut-off طبقاً لتعليمات الشركة المصنعة بعد قراءة الامتصاص في موجة طولها 450 نانومتر باستخدام قارئ ضوئي نموذج Sunrise (شركة Tecan، سويسرا). استُخدمت قيم نسبة امتصاص العينة إلى قيمةcut-off لتفسير النتائج، حيث اعتبرت إيجابيةً عندما كانت القيمة ?1، وسلبية عندما كانت القيمة أقل من 0.9، وفي منطقة التساوي equivalence عندما تراوحت بين 0.9 و1. وأعيد الكشف عن كل من HBsAg وanti-HCV بالمقايسة المناعية بالجسيمات المكروية اللامعة كيميائياً (CMIA) باستخدام عتائد HBsAg Qualitative II وanti-HCV (شركة Abbott، الولايات المتحدة الأمريكية) حيث جرت المقايسة باستخدام جهاز Achitecht (شركة Abbott، الولايات المتحدة الأمريكية)، وجرى اعتماد قيم نسبة الإشارة إلى قيمة cut-off (S/CO) لتفسير النتائج، حيث اعتبرت القيمة ? 1 متفاعلة reactive وقيمة أٌقل من0.9 غير متفاعلة nonreactive. جرى ضبط جودة المقايسات جميعها وفقاً لتعليمات الشركتين المصنعتين. وأُجريت كافة الاختبارات المصلية باستخدام قارئ ELISA (Sunrise، شركة Tecan، سويسرا) وجهاز Architect (شركة Abbott، الولايات المتحدة الأمريكية) الموجودين في مخبر مركز نقل الدم في جامعة دمشق.
قورنت مقايسة ELISA بمقايسة CMIA وجرى تبني القيم السلبية الحقيقية true negatives والقيم الإيجابية الحقيقية true positives الناتجة عن CMIA، ثم حسبت قيمة الحساسية sensitivity والنوعيَة specificity لمقايسة ELISA اعتماداً على القيم الحقيقية لمقايسة CMIA، كما رُسم منحنى Receiver operating characteristic curve (ROC) وحسبت المساحة تحت المنحنى باستخدام IBM SPSS statistics 23, 2016، حيث اعتبرت قيمة P< 0.05 معتداً بها إحصائياً.
|
| النتائج Results |
أظهرت نتائجنا أن159/157 عينة كانت سلبية المصل للمستضد HBsAg عند مقايستها باستخدام كل من ELISA وCMIA، وأنَ 1/159عينة كانت سلبية للمستضد باستخدام ELISA وإيجابية له باستخدام.CMIA وعلى العكس كانت 1/159عينة إيجابية للمستضد باستخدام ELISA وسلبية له باستخدام CMIA. وعند مقارنة ELISA مع CMIA تبين أن ELISA عجزت عن كشف الإيجابية الحقيقية الوحيدة التي كشفتها CMIA، كما أظهرت إيجابية مصلية كاذبة واحدة (الجدول 1). لم تمكننا النتائج التي حصلنا عليها رسم منحني ROC لهذه المقايسة.
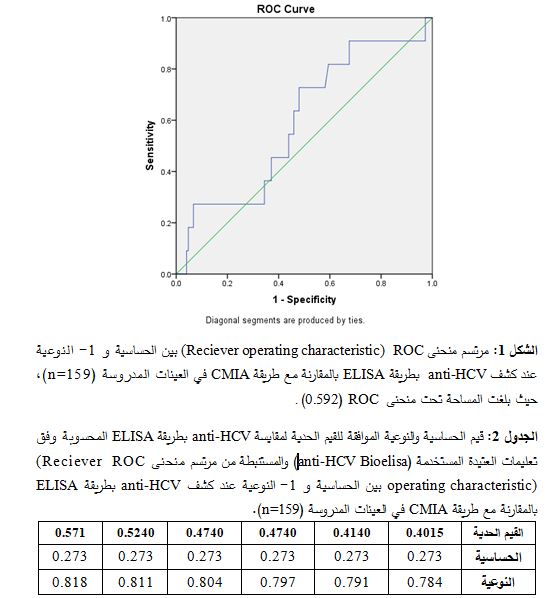
كما أظهرت نتائجنا أن159/139 عينة كانت سلبية المصل تجاه anti-HCV عند مقايستها باستخدام كل من ELISA وCMIA، وأن 8/159 عينة كانت إيجابية المصل تجاه anti-HCV في كلٍّ من الطريقتين. كما بينت نتائجنا أنَ 2/159 عينة كانت سلبية تجاه anti-HCV باستخدام ELISA وإيجابية له باستخدامCMIA ، وعلى العكس 10/159 عينة كانت إيجابية تجاه anti-HCV باستخدام ELISA وسلبية له باستخدامCMIA (الجدول 1). وبمقارنة ELISA مع مقايسة CMIA فقد بلغت المساحة تحت منحنى ROC 0.592 (95%CI: 0.423-0.761, P>0.05) (الشكل1 ). وباعتبار قيمتي Cut-off المستخدمة في مقايساتنا والتي جرى حسابها لعتيدتي anti-HCV المستخدمتين في الدراسة وفقاً لتعليمات الشركة المصنعة [0.405-0.5] فقد تبين إحصائياً أن حساسية مقايسة ELISA المستخدمة بلغت 27.3% ونوعيتها تراوحت بين 78.4% و 81.1% تبعاً لقيمةCut-off المستخدمة (الجدول 2).
|
| المناقشة Discussion |
أظهرت نتائج دراستنا وجود تباينٍ بين العينات التي أظهرت سلبية مصلية أو إيجابية مصلية لكل من المستضد HBsAg والأضداد anti-HCV عند مقايستها باستخدامELISA أو .CMIA يرجح أن هذا الاختلاف قد يرجع إلى فروق الحساسية والنوعية بين كل من الطريقتين، حيث تتفق ELISA وCMIA بمبدأ طريقة المقايسة (تفاعل ضد- مستضد) وتختلفان في مبدأ وطريقة الكشف detection، حيث يعتمد الكشف في ELISA على تفاعل لوني وفي CMIA يعتمد
الكشف على تفاعل لمعان كيميائي، مما يجعلها أكثر حساسية ونوعية (6)، على الرغم من كون عتائد مقايسةELISA المستخدمة في هذه الدراسة من الجيل الثالث.
تبلغ الحدود الدنيا للكشف minimum detection
limit عن HBsAg في مقايسة CMIA 0.05 وحدة دولية/ مل، كما ورد في دراسة Scheiblauer H وزملائه، 2006 (10)، أما في مقايسة ELISA فهي تبلغ 0.1 وحدة دولية/ مل (وفقاً لما ورد في تعليمات العتيدة المستخدمة في
الكشف)، وهذا قد يوضح السبب الكامن وراء قصور ELISA عن كشف الإيجابية الحقيقية الوحيدة التي كشفتها CMIA. كما تتميز طريقة CMIA بحساسية %100 ونوعية %99.45 (11). مما جعلنا نرشح CMIA كطريقة مرجعية لتبني نتائجها الإيجابية والسلبية كقيم إيجابية وسلبية حقيقية (true positive and negative values) لمقارنة طريقة ELISAبها. وقد يفسر وجود سلبيات مصلية كاذبة أثناء الكشف عن HBsAg وanti-HCV باستخدام ELISA بكون مستويات الواصمين المدروسين تحت حدود الكشف لهذه المقايسة (3)، كما يمكن تفسير وجود إيجابية مصلية كاذبة واحدة عند الكشف عن HBsAg ووجود 10 إيجابيات مصلية كاذبة عند الكشف عن anti-HCV بطريقة ELISA بانخفاض معدلات انتشار هذه العداوى الفيروسية في سورية (12)، حيث تزداد الإيجابيات المصلية الكاذبة في حال كانت معدلات الانتشار منخفضة (5)، ويمكن التكهن- لعدم توفر المعلومات السريرية- أن هذه الإيجابيات المصلية الكاذبة قد تكون ناتجة عن تداخلات interferences مع الغلوبولينات المناعية لأمراض أخرى كداء وحيدات النوى mononucleosis أو تداخل مع الهيموغلوبين أو البيليروبين (3، 13).
بلغت قيمة المساحة تحت منحنى ROC لمقايسة أضداد anti-HCV بطريقة ELISA المستخدمة في دراستنا 0.592 وهذه القيمة لا تحقق معايير WHO، من حيث حساسيتها ونوعيتها في تحري مأمونية الدم (14). كما تبين ضرورة اعتماد أكثر من قيمةcut-off بما يتوافق مع الغرض من المقايسة، سواء عند تحري مأمونية الدم بزيادة الحساسية مقابل النوعية أو عند التشخيص بزيادة النوعية مقابل الحساسية.
كان عدد العينات المستخدم لإجراء هذه المقارنة قليلاً بسبب محدودية الموارد المتاحة لهذا البحث وهو من معوقات هذه الدراسة.
|
 |
| الاستنتاجConclusion |
خلصت دراستنا إلى أن طريقة ELISA ليست الطريقة المثلى للكشف عن الممرضات عند القيام بتحري مأمونية الدم أو التشخيص لانخفاض حساسيتها ونوعيتها. وفي حال استخدامها هناك ضرورة لاختبار حساسية ونوعية العتائد المستخدمة عند قيم حدية cut-off متباينة لتحسين الحساسية والنوعية.
كلمة شكر: نشكر مركز نقل الدم في جامعة دمشق لإجرائه اختباري HBsAg وanti-HCV بتقنية CMIA لعينات البحث.
|
| المراجع:References |
1. Kim S; Kim J.H; Yoon S; Park Y.H. and Kim H.
Clinical Performance Evaluation of Four Automated Chemiluminescence Immunoassays for Hepatitis C Virus Antibody Detection.
J Clin Microbiol, 46 (12): 3919-3923, 2008.
2. Maity S; Nandi S; Biswas S; Sadhukhan S.K. and Saha M. K.
Performance and diagnostic usefulness ofcommercially available enzyme linked immunosorbent assay and rapid kits for detection of HIV, HBV and HCV in India.
Virol J, 9:290, 2012.
3. ?nan N; Dem?rel A; Unsur E.K; Gormu? U; Sonmez E; Tabak F. and Arisoy A.
Comparison of Chemiluminescence Microparticle Immunoassay and Electrochemiluminescence Immunoassay for Detection of HBsAg.
Viral Hepat J, 20(3): 101-105, 2014.
4. http://www.who.int/mediacentre/factsheets/fs164/en/.
Entered 15 may 2015.
5. Ilyas M. and Ahmad I.
Chemiluminescent microparticle immunoassay based detection and prevalence of HCV infection in district Peshawar Pakistan.
Virol J, 11:127, 2014.
6. Marwaha N. and Sachdev S.
Current testing strategies for hepatitis C virus infection in blood donors and the way forward.
World J Gastroenterol, 20(11): 2948-2954, 2014.
7. Swellam M; Mahmoud M.S. and Ali A. F.
Diagnosis of Hepatitis C Virus Infection by Enzyme-linked Immunosorbent Assay and Reverse Transcriptase-Nested Polymerase Chain Reaction: A Comparative
Evaluation.
IUBMB Life, 63(6): 430-434, June 2011.
8. Thakur V; Guptan R.C; Arankale V.and Sarin S.K.
Low specificity of the third generation ELISA for HCV detection in voluntary blood donors in India.
eJIFCC vol 14 no 1: http://www.ifcc.org/ejifcc/vol14no1/140103200305n.htm.
Entered 2 may 2016.
9. Kamili S; Drobeniuc J; Araujo A.C. and Hayden T. M.
Laboratory diagnostics of hepatitis C virus infection.
Downloaded from: http://cid.oxfordjournals.org/content/55/suppl_1/S43.full
Entered 2 may 2016.
10.Hadziyannis E.
Quantification of HBsAg in serum: characteristics of the assays.
OA Hepatology, 1(1):1, 2013.
11.Scheiblauer H; EL-Nageh M; Nick S; Fields H; Prince A. and Diaz S.
Evaluation of the performance of 44 assays used in countries with limited resources for the detection of antibodies to hepatitis C virus.
Transfusion, 46:708-718, 2006.
12.Karim M. and Lahham H.
Prevalence of viral hepatitis B and C in Syria.
Syrian Epidemiological Bulletin, 2, 10–11, 2008.
13.Raghuraman S; Subramaniam T. and Daniel D.
Occurrence of False Positives during Testing for Antibodies to Hepatitis C Virus among Volunteer Blood Donors in India.
J Clin Microbiol, 41(4) : 1788-1790 , 2003.
14.http://www.who.int/bloodsafety/ScreeningDonatedBloodforTransfusion. pdf; Entered 2/6/2016.
|
| |
| المجلد 8 , العدد 3-4 , ربيع الثاني 1438 - كانون الثاني (يناير) 2017 |
|
|
|
