| المجلد 8 , العدد 3-4 , ربيع الثاني 1438 - كانون الثاني (يناير) 2017 |
| |
| دور البروتين الرابط لعامل النمو الشبيه بالأنسولين 2 في مناظرة علاج أطفال سوريين مصابين بابيضاض دم لمفاوي حاد |
| The Role of Insulin-Like Growth Factor Binding Protein 2
(IGFBP-2) in Treatment Monitoring of Syrian Acute Lymphocytic Leukemia Pediatric Patients
|
| د. نبيله الصواف الشهير بالدوه جي و أ. د. جمانة الصالح |
| Beldoahji N. S. and Saleh J. |
| كلية الصيدلة، جامعة دمشق
Faculty of Pharmacy, Damascus University
|
| الملخص Abstract |
| كان قد جرى إثبات أن عوامل النمو الشبيهة بالأنسولين IGFs والبروتينات الرابطة لتلك العوامل IGFBPs، تلعب دوراً هاماً في تكاثر الورم ومقاومة العلاج. لذلك هدفت هذه الدراسة إلى استقصاء موثوقية مقايسة البروتين الرابط لعامل النمو الشبيه بالأنسولين 2 (IGFBP-2) في مصول أطفال سوريين مصابين بابيضاض دم لمفاوي حاد (ALL)، كواصم إضافي في تشخيص المرض ومتابعة تطوره. حيث عُينت تراكيز IGFBP-2 في مصول 33 طفلاً مصاباً بابيضاض لمفاوي حاد في مرحلة تشخيص المرض وبعد انتهاء طور شدة العلاج الكيميائي (IPC) الذي استمر 6 أشهر، بالإضافة إلى 21 طفلاً سليماً كمجموعة شاهد، وذلك باستخدام طريقة مقايسة الممتز المناعي المرتبط بالإنزيم (ELISA). فكانت المستويات المصلية لـ 2-IGFBP عند التشخيص مرتفعة مقارنة مع المجموعة الشاهدة، إلا أنها عادت إلى قيمها السوية بعد IPC. وكاستنتاج، فإن التبدلات في جملة الـ IGF قد تكون مفيدة لدعم تشخيص الأطفال المصابين بابيضاض دم لمفاوي حاد (ALL) ومتابعة علاجهم. |
| Insulin-like growth factors (IGFs) and IGF-binding proteins (IGFBPs) have been reported to play an important role in tumor proliferation and treatment resistant. This study aimed to investigate the validity of measuring IGFBP-2 in the serum of Syrian children with acute lymphoblastic leukemia (ALL) as additional marker in diagnosis and follow-up of the disease. IGFBP-2 was determined in the sera of 33 ALL patients at time of diagnosis and after an intensification phase of chemotherapy (IPC) that lasts about 6 months, as well as in 21 healthy children as a control group, using enzyme-linked immunosorbent assay (ELISA) technique. At time of diagnosis, serum IGFBP-2 was significantly higher than those in the control group at diagnosis, but returned to normal value after IPC. In conclusion, the changes in IGF system could be useful to support diagnosis and follow-up of children with ALL. |
| المقدمة Introduction |
| يُعد ابيضاض الدم اللمفاوي الحاد (ALL)، الشكل الأكثر شيوعاً من السرطان لدى ا?طفال، حيث يشكل حوالي 30% من مجمل خباثات الطفولة، ويكون أكثر شيوعاً بمعدل خمس مرات من ابيضاض الدم النقوي الحادAML) ) (1). يُشكّل ابيضاض الدم اللمفاوي الحاد 75% من الابيضاضات المشخصة لدى الأطفال، كما أن 60% من حالاته تُشخّص لدى الأطفال (1). |
يُعرَّف ابيضاض الدم اللمفاوي الحاد بأنه خَبَاثة دموية في الخلايا اللمفية مع استحالة في أسلاف اللمفاويات، ينتج عنها توقف التمايز مع توسع نسيلي وارْتِشاح خلايا غير ناضجة إلى الدم المحيطي. وبالمقابل يحدث نقص في تشكُّل عناصر الدم الأُخرى، مما يؤدي إلى حدوث فقر دم وفُرفُريّات بسبب نقص تشكل الكريات الحمر والصفيحات (2).
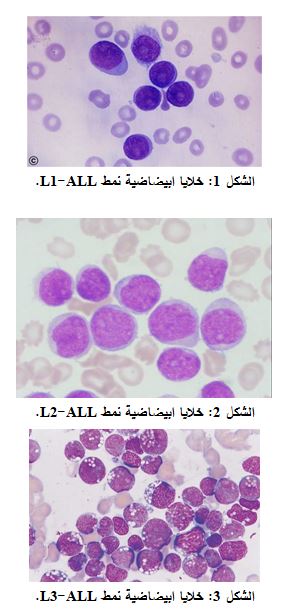
يمكن تصنيف ابيضاض الدم اللمفاوي الحاد إلى أصناف عدة تتميز عن بعضها بالصفات الشكلية للكريات البيضاء في الدم المحيطي وفي نقي العظام والتجارب الكيميائية الخلوية والخصائص المناعية، واستناداً على المظھر المجھري للخ??ا ا?ب?ضاض?ة كما تشاھد في لطاخات دموية ملونة بملون را?ت أو غ?مزا. ?حدّد ھذا التصن?ف إلى ث?ثة أنماط شكل?ة لـ ALL، مستخدماً النظام البر?طاني ا?م?ركي- الفرنسي (FAB):
• ALL-L1: خلايا ابيضاضية صغيرة موحدة مع ھ?ولى قل?لة (الشكل 1)، الكروماتين النووي مكثف، نو?ات غ?ر واضحة، ?شكل ھذا النمط 85% من حا?ت اب?ضاض الدم اللمفاوي الحاد لدى ا?طفال (3).
• ALL-L2: خلايا ابيضاضية متنوعة كبيرة وكم?ة معتدلة من الھ?ولى (الشكل 2)، كرومات?ن ناعم مبعثر، النو?ات واضحة (4، 5). ?شكل ھذا النمط 14% من حا?ت اب?ضاض الدم اللمفاوي الحاد لدى ا?طفال (5، 6).
• ALL-L3: خلايا ابيضاضية متنوعة كبيرة مع فجوات (تتميز بشكل يشبه الفقاعة) وهيـولى
قاعد?ة غز?رة، نسبياً تحتوي فجوات (الشكل 3)، الكرومات?ن خشن ومتكتل والنو?ات واضحة، ?شكل ھذا النمط 1% من حا?ت ابيضاض الدم اللمفاوي الحاد لدى الأطفال (4، 5).
|
 |
| |
| درجة اختطار المرض
جرى التصن?ف ا?ولي لحا?ت اب?ضاض الدم اللمفاوي الحاد بالتنم?ط الظاھري المناعي و?شمل الخ??ا البائ?ة الباكرة، س??ت الخ??ا التائ?ة والخ??ا البائ?ة الناضجة.
إن س?لة الخ??ا البائ?ة الباكرة ھي المجموعة الفرع?ة subgroup ا?كثر ش?وعاً، وضمن ھذة المجموعة، جرى استعراف مجموعات الاختطار الأربع التال?ة مع نتائج مختلفة بناء ً على عوامل الاختطار الب?ولوج?ة والسر?ر?ة.
- اختطار منخفض: تتراوح أعمار الأطفال بين 1-10 أعوام، مع تعداد منخفض لكر?ات الدم الب?ض وتبد?ت وراث?ة خلو?ة كفرط الص?غة الصبغ?ة، تثلث الصبغ?ات 10 ،4، و17 أو وجود ا?زفاء (12;21)t، ولد?ھم ا?نذار ا?فضل، ومعد?ت شفاء event-free survival (EFS) تقارب 90%، (10، 11).
- اختطار طب?عي (NR): تتراوح أعمار المرضى ب?ن 1-9 أعوام، تعداد الكر?ات الب?ضاء عند التشخ?ص أقل من 50.000/مم3، ولكن بدون تبد?ت وراث?ة خلو?ة ج?دة، و?بدون استجابة ج?دة للع?ج الك?م?ائي البدئي فتنخفض نسبة ا?رومات في نقي العظم إلى أقل من 5% في ال?وم الرابع عشر من الع?ج وإلى 0.01% في ال?وم الثامن والعشر?ن، أي ?بدون استجابة باكرة وسر?عة.
- اختطار عالٍ (HR): تشمل هذه المجموعة المرضى ا?كبر من 10 أعوام، أو الذ?ن لد?ھم تبد?ت وراث?ة خلو?ة س?ئة، وإصابة خارج نقو?ة تجعل من غ?ر المناسب معالجتھم كمرضى ا?ختطار المع?اري.
اختطار عالٍ جداً: مجموعة تشمل ا?طفال بتبدلات وراث?ة خلو?ة وخ?مة مثل صبغي ف??دلف?ا، نقص الص?غة الصبغ?ة، ا?زفاء (t (4;11، ذوي الاستجابة الضعيفة جداً للع?ج الك?م?ائي البدئي (10، 11).
|
| المعالجة |
تقسم إلى معالجة داعمة ومعالجة نوعية:
- المعالجة العامة الداعمة: تتضمن المعالجةَ الداعمةَّ لفشلَ نقي العظم.
- المعالجة النوعية: تتضمن المعالجة النوع?ة ?ب?ضاض الدم اللمفاوي الحاد ك? ً من المعالجة الك?م?ائ?ة والشعاع?ة.
تستخدم أطوار مختلفة من المعالجة وتتضمن عادة أربع مراحل (12).
• تحريض الهدأة Remission induction: ?ستخدم في ھذه المرحلة ث?ثة أو أربعة أدو?ة تتضمن سترو?د قشري سكري corticosteroids، فنكرست?ن Vincristine، أسبارج?ناز asparginase، و?مكن إضافة أنتراسكل?ن anthracycline لمرضى ا?ختطار العالي و?ضاف مثبط ت?روز?ن ك?ناز في حال الشذوذات الصبغ?ة الخطيرة مثل صبغي ف??دلف?ا (13، 14).
• المعالجة الوقائ?ة للجملة العصب?ة المركز?ة CNS preventive therapy: تبدأ ھذه المرحلة عادة خ?ل مرحلة التحر?ض وتستمر حتى نھا?ة نظام المعالجة الك?م?ائ?ة. تكون المعالجة النوع?ة مطلوبة لمنع أمراض الجھاز العصبي المركزي، كون بعض ا?دو?ة التي تعطى بشكل مجموعي تصل إلى السائل الدماغي النخاعي (9).
• المعالجة الداعمة Consolidation Therapy: تعد ھذه المرحلة ھي المرحلة الثان?ة من معالجة اب?ضاض الدم اللمفاوي الحاد، وتبدأ حالما ?تم تحق?ق الھدأة الكاملة وتستمر ھذه المرحلة عادة 4-6 أشھر، وتُستخدم ف?ھا جرعات عال?ة من أدو?ة متعددة لإزالة أو إنقاص الخ??ا الورم?ة إلى مستو?ات منخفضة جداً، مثل س?تراب?ن cytrabine وم?توتركسات metotrexate، انتراسكل?ن Anthracyclins، عوامل مؤلكلة. ويعتمد تحديد الجرعات ا
ك?م?ائ?ة على درجة ا?ختطار لدى المرضى (15، 16).
• الصائنة Maintenance: تعد ھذه المرحلة ھي المرحلة ا?خ?رة وا?طول وتتكون من م?توتركسات metotrexate، فنكر?ست?ن Vincristine، 6- مركابتوبور?ن Mercaptopurin -6، وس?ترو?د قشري سكري. وتستمر مدة المعالجة الكاملة لمعظم ا?طفال المصاب?ن باب?ضاض الدم اللمفاوي الحاد ب?ن 24-36 شھراً (9، 17).
من جهة أخرى تعد جملة عامل النمو الشبيه بالأنسولين IGF شبكة معقدة، تتألف من ببتيدين لعامل النمو شبيه الأنسولين (عامل النمو شبيه الأنسولين 1 (IGF-I) وعامل النمو شبيه الأنسولين 2IGF-II) ) ومستقبلين اثنين لعامل النمو شبيه الأنسولين (مستقبل عامل النمو شبيه الأنسولين 1 (IGF-IR) ومستقبل عامل النمو شبيه الأنسولين 2 (IGF-IIR) (18).
إن عامل النمو شبيه الأنسولين 1 هو ببتيد مؤلف من 70 حمض اميني، يُنتجه الكبد بشكل رئيسي استجابة لتحريض هرمون النمو (19). ولقد تبين أن الخلايا المكونة للدم والخلايا الدموية البالغة تنتج هرمون النمو GH وعامل النمو شبيه الأنسولين 1 وتحدد المستقبلات لهذه الببتيدات (20). ويمكن لهرمون النمو وعامل النمو شبيه الأنسولين 1 أن يعملا بشكل مستقل على تلك الخلايا أو بطريقة تآزريه مع السيتوكين الرئيسي المكون للدم (20)، حيث يملك الـ IGF-1 وظائف عدة منها:
زيادة حجم الخلايا Hypertrophy وزيادة عددها Hyperplasia بالإضافة إلى دوره في تثبيط الاستماتة وتحسين قدرة الأعصاب في الجسم وإصلاح الأعصاب التالفة، كما يقوم بتحسين إنتاج البروتين وخفض استقلابه في الخلايا، كما أن له دوراً مهماً في النمو في مرحلة الطفولة، لذا من الممكن أن يستعمل كعلاج لفشل النمو، ضحايا الحروق، أمراض الهزال العضلي ومكافحة الشيخوخة (21-23).
يجري تنظيم عمل عوامل النمو شبيهة الأنسولين بوساطة ستة بروتينات مرتبطة بعامل النمو شبيه الأنسولين (IGFBP-1 to IGFBP-6)، حيث تنظم تفاعلها مع مستقبلاتها، تطيل العمر النصفي لها وتمنع نمو الخلايا المفرط أو تزيد من استماتة الخلايا (15). يملك الـ IGFBP-II تحديداً مجالاً رابطاً للهيبارين Heparin-Binding Domain (HBD) يرتبط بألفة عالية مع المطرس matrix خارج الخلية، ويلعب دوراً أساسياً في فاعّلية الـ IGFBP-II المتعلقة بالارتباط بالخلايا والتكاثر الخلوي وانتشار النقائل، كما يعد مسؤولاً عن فاعلية الـ IGFBP-II المثبطة للتعبير عن الفسفتّاز الشحمي المضاهي للتنسين (PTEN (phosphatase and tensin homolog الذي يعاكس نقل الإشارة المتولدة عن ارتباط الـ IGF-I مع مستقبله وبالتالي فإن للـ IGFBP-II تأثيراً ايجابياً على سبيل نقل الإشارة PI3K/Akt (24).
لدى الـ IGFBP-II فاعّلية معتمدة على الـ IGF، IGFBP-II IGF-dependent action وفعّالية غير معتمدة على الـ IGF، IGFBP-II IGF-independent action.
|
التأثير الفيزيولوجي المعتمد على الـ IGF:
خلال الفاعّلية المعتمدة على الـ IGF يقوم الـ IGFBP-II بتنظيم التوافر الحيوي للـ IGF للارتباط بمستقبلاتها بمشاركة بروتيازات تشطر الـ IGFBP-II وتحرر الـ IGF ليرتبط بمسقبله، كما تتداخل شدف الـ IGFBP-II أو IGFBP-II الكامل مع مكونات المطرس خارج الخلية extracellular matrix (ECM) والمستقبل المتواجد على سطح الخلية التيروزين فسفتّاز (RPTP?) receptor protein tyrosine phosphatase ? ليشكل معه متماثراً يقلل ألفة ربطه للـ IGF، وفي الحالتين يتشكل مخزون من IGF بالقرب من سطح الخلية.
التأثير الفيزيولوجي غير المعتمد على IGF:
يمتلك الـ IGFBP-IIأيضاً فاعّلية داخل خلوية غير معتمدة على الـ IGF، عبر ارتباطه مع مستقبلات الانتغرين integrin receptors (?V?3; ?5?1) وبمستقبل الليبوبروتين منخفض الكثافة الرابط للبروتين LRP1 أو عبر إزفائة داخل الخلية وارتباطه مع البروتينات الرابطة p21; PAPA1 أو دخوله النواة عبر النواقل النووية importin ? and ?.
يرتبط الـ IGFBP-II بمستقبل الليبوبروتين منخفض الكثافة الرابط للبروتين Low density lipoprotein receptor-related protein 1 (LRP1)، كما يسمى بمسقبل ماكروغلوبولين 2 ألفا (A2MR)alpha-2-macroglobulin receptor أو مستقبل الأبوليبوبروتين E apolipoprotein E receptor (APOER) أو عنقود التمايز 91 (CD91) cluster of differentiation 91 يتواجد المستقبل LRP1 على الغشاء الهيولي للخلية ويعمل بطريقة الالتقام الخلوي endocytosis، يرتبط الـ IGFBP-II به عبر متمم للمجال الغني بالسيستئين cysteine-rich complement-type الموجود في الـ IGFBP-II، مما يؤدي إلى تفعيل السفينغوزين كيناز sphingosine kinase (SPHK) الذي يفسفر السفنغوزين لتشكيل السفنغوزين-1- فسفات sphingosine-1-phosphate (S1P) الذي يزداد تركيزه داخل الخلية فيؤثر على تدفق أيونات الكالسيوم Ca++ ويعمل كمرسالٍ ثانٍ لنقل الإشارة بخروجه من الخلية عبر نواقل transporters مثل الكاسيت الرابط للـ ATP نمط ABC ، ATP-binding cassette (ABC)-type transporters ثم ارتباطه بمستقبلات السفنغوزين -1- فسفات1 أو 5 (S1PR1–S1PR5) differentially expressed by immune cells، مما يُحدث تفعيلاً لمحول الإشارة ومنشط النسخ 3 (STAT3) signal transducer and activator of transcription 3 الذي ينشّط انتساخ الجين المستهدف (25، 26).
جرى مؤخراً تحديد IGFBP-II كعامل يدعم نشاط الخلايا الجذعية المكونة للدم (HSCs)، حيث تفرز الخلايا الطبيعية كمية ضئيلة من الـ IGFBP-II بينما تفرز كل من الخلايا الجذعية السرطانية Leukemia Stem Cells والخلايا المتمايزة السرطانية Differentiated Leukemia Cells نسبة مرتفعة من الـ IGFBP-II، تؤثر بمجموعها في تطور سرطان الدم عن طريق تعزيز البقيا الخلوية، وتحفيز الهجرة والارتشاح من نخاع العظام إلى الأعضاء والأنسجة الطرفية (27).
نظراً لدور IGFBP-II في تطور ابيضاض الدم اللمفاوي الحاد، وتدخله في نمو الخلايا، وتأثيره على الاستماتة وضعت عدة تقارير عن تأثير التبدلات في نظام عامل النمو شبيه الأنسولين على العديد من الأورام، متضمنة ابيضاض الدم اللمفاوي الحاد (Chen W 2009، Rinaldi S 2010، Zhao D Jr 2011) (21-23).
إن قياس مستوى IGFBP-II في مجموعة من الأطفال المصابين بابيضاض الدم اللمفاوي في نقاط مختلفة من تطور المرض غير مطروق في سورية، وبالتالي فإن دراسته غاية في الأهمية من أجل التشخيص ومتابعة العلاج.
|
| المواد والطرق Materials and Methods |
تصميم الدراسة: هي دراسة حالة- شاهد case-control study. وشملت 33 طفلاً مصاباً بابيضاض الدم اللمفاوي الحاد تراوحت أعمارهم بين 3-8 أعوام. وأُخذت عينات الدم منهم على مرحلتين الأولى: عند تشخيص المرض وقبل البدء بالعلاج الكيميائي، والثانية عند انتهاء مرحلة العلاج الكيميائي، كما ضمت الدراسة 21 طفلاً سليماً (شاهداً) للمقارنة لا يعانون من أي عدوى حادة أو مزمنة في الأشهر الثلاثة الأخيرة، وكانت قيم الـ CRP لديهم سوية.
عند قطف العينة استُبعدت العينات التالية:
- المرضى المصابين بخباثات أو أورام أخرى مرافقة لابيضاض دم لمفاوي حاد سواء كانت سابقة أو تالية للإصابة بابيضاض الدم.
- المرضى المصابين بنكس تال لإصابة سابقة بابيضاض الدم اللمفاوي الحاد.
- المرضى المصابين بالقزامة Dwarfism، العملقة Gigantism أو المعالجين بهرمون النمو.
- المرضى المعالجين بالبريدنيزولون.
جرت معايرة تراكيز IGFBP-2 في العينات جميعها بطريقة الـ (ELISA) Enzyme Linked ImmonSorbent Assay وباستخدام عتيدة لشركة BioVendor التشيكية.
تحتوي العتيدة صفيحة معايرة مكروية، جاهزة للاستخدام مؤلفة من 96 حجرة، المعياريات A-E، مجفدة حاوية على الواصمات (IGFBP-2) البشري المأشوب، دارئة العينة، مصل منظم (مراقب)، الأضداد المرتبطة الحاوية على أضداد مضادة للـ IGFBP-2 مرتبطة (بروتين – بيوتين تم ربطهما تساهمياً)، إنزيم الارتباط بالركازة حاوٍ على بيروكسيداز الفجل الحار المرتبط بالستريبتا فيدين، دارئة للشطف، الركازة، محلول الإيقاف، غطاء لإغلاق الصفيحة المكروية.
أُجريت المعايرة حسب تعليمات الشركة المصنعة. وكانت الدراسة الإحصائية على الشكل التالي:
1. أجري التحل?ل ا?حصائي باستخدام برنامج الحزمة ا?حصائ?ة SPSS (version 21, IBM SPSS ).
2. جرى تطبيق اختبار ستودنت المستقل T-test لدراسة الفروق بين مجموعتين مستقلتين واختبار ستودنت المرتبط لدراسة الفروق في المجموعة الواحدة قبل العلاج وبعده.
3. جرى تطبيق اختبار كولموغروف سميرنوف Kolmogorov Smirnov Test لتحديد طبيعة توزع واصمات الدراسة للمجموعة الشاهدة ولمجموعة المرضى قبل وبعد العلاج حسب الجنس والعمر.
4. اعتُمِدَت ق?مة P<0.05 للد?لة الهامة إحصائ?اً.
5. جرى تطبيق طريقة Spearman-rho لاختبار العلاقة بين المتغيرات العددية.
6. جرى تطبيق اختبار Mann–Whitney لدراسة العلاقة بين مجموعتين مستقلتين.
7. جرى تطبيق اختبار Wilcoxon signed ranks لدراسة العلاقة بين المجموعات قبل العلاج وبعده.
8. رُسم منحنى ROC وحسبت المساحة تحت المنحنى من أجل تحد?د الق?مة التنبؤ?ة للواصم المدروس. و?ُنشأ ھذا المنحنى عادة با?عتماد على ق?م محسوبة للحساس?ة والنوع?ة ?خت?ار الق?مة المع?ار?ة المثلى التي تحقق الحساس?ة العال?ة والنوع?ة العالية معاً.
|
| النتائج Results |
دراسة نسبة استجابة المرضى المشاركين في الدراسة للعلاج المستخدم
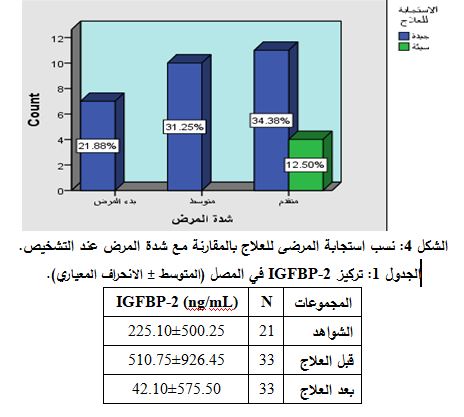
بلغت نسبة مرضى ابيضاض الدم اللمفاوي الحاد المستجيبين للعلاج المستخدم 87.5% وهي تعد نسبة استجابة عالية تدل على نجاعة العلاج، في حين بلغت نسبة غير المستجيبين للعلاج 12.5% وكانت محصورة في المرضى المشخصين بدرجة اختطار عالٍ جداً من المرض (الشكل 4).
مقارنة مستويات 2IGFBP- بين المرضى، عند تشخيص اصابتهم بابيضاض الدم اللمفاوي الحاد، مع الشواهد الأصحاء والمرضى بعد العلاج:
تشمل الملامح المستخدمة في تقييم درجة الاختطار:
- عد كر?ات الدم البيض الأولي
- العمر
- الوراثيات الخلو?ة والص?غة الصبغ?ة
- النم?ط المناعي Immunologic subtype
- سرعة ا?نقاص الخلوي cytoreduction
كلما زادت كفاءة أنظمة المعالجة، أصبح الترابط ب?ن الم?مح التال?ة والنت?جة أقل أھم?ة أو حتى أنھ ? ?عد أمراً هاماً (28).
- الجنس
- مورفولوج?ا FAB.
- ضخامة ا?عضاء Organomegaly وتضخم العقد اللمف?ة lymphadenopathy
- مستوى الھ?موغلوب?ن
- العرق
- عد الصفيحات
- تراكيز الغلوبولينات المناعية المصلية
جرت دراسة استجابة المرضى للعلاج لتقييم التبدلات المصلية للواصم IGFBP-2 المدروس وفق استجابة المريض أو عدم استجابته للعلاج.
جرى استخدام اختبار كولموغروف سميرنوف Kolmogorov-Smirnov& Shapiro-Wilk لتحديد طبيعة توزع واصمات الدراسة للمجموعة الشاهدة ولمجموعة المرضى قبل العلاج وبعده فكانت معدلات تركيز الواصمات الحيوية تخضع للتوزيع الطبيعي عند مستوى دلالة 0.05.
جرت مقارنة المستويات المصلية لـ IGFBP-2 بين المرضى عند تشخيص إصابتهم بابيضاض الدم اللمفاوي الحاد وبعد العلاج فأظهرت النتائج ارتفاع المستويات المصلية للـ IGFBP-2 عند تشخيص الإصابة مقارنة بالشواهد بنسبة 83.38% ثم انخفضت بعد العلاج لتصل إلى الحدود الطبيعية عند المرضى المستجيبين للعلاج (الجدول 1).
أما المرضى الأربعة غير المستجيبين للعلاج فلم تتبدل قيم المستويات المصلية للـ IGFBP-2 بفارق يُعتد به إحصائياً ولم تعد إلى الحدود السوية.
|
 |
| دراسة إمكان?ة التنبؤ بتشخيص ابيضاض الدم اللمفاوي الحاد اعتماداً على مقارنة ق?م IGFBP-2 ب?ن مرضى اب?ضاض الدم اللمفاوي الحاد والشواھد ا?صحاء:
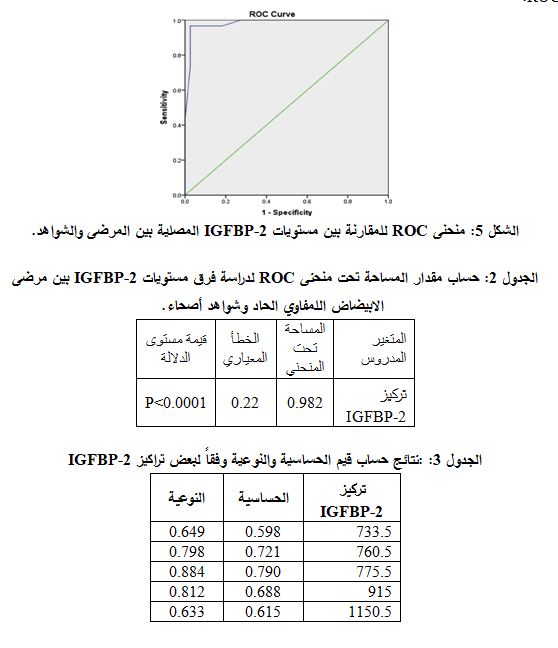
ُرسِمَ منحنى ROC لدراسة مقارنة مستو?ات IGFBP-2 المصل?ة ب?ن مرضى اب?ضاض الدم اللمفاوي والشواھد ا?صحاء، ثم حُسبت المساحة تحت منحنى ROC، وحُسبت الحساس?ة والنوع?ة لعدة ق?م من الواصم (الشكل 5). و?ب?ن الجدول 2 أن ق?مة مستوى الد?لة 0001.p<0 وبالتالي فإن ق?م تراك?ز IGFBP-2 ?مكن أن تعد حدّاً ?عتد بھ احصائ?اً. وكانت المساحة تحت منحنى ROC 0.982.
?ب?ن الجدول 3 أن أفضل تناسب ب?ن الحساس?ة والنوع?ة كان عند الق?مة 775.5 ng/ml، حيث كانت الحساسية تساوي 0.790 والنوعية 0.884 وبالتالي يمكن تحديد التركيز كقيمة معيارية للتنبؤ بالإصابة بابيضاض الدم اللمفاوي الحاد.
|
 |
| المناقشة Discussion |
وُجِد بمقارنة مستو?ات IGFBP-2 المصل?ة لدى المرضى عند تشخ?ص إصابتھم باب?ضاض الدم اللمفاوي الحاد ALL ولدى الشواهد الأصحاء مايلي: 33 مريضاً (المرضى جميعهم) ارتفعت مستويات IGFBP-2 لديهم أعلى من الحد الأعلى الطبيعي عند تشخيصهم بابيضاض الدم اللمفاوي الحاد.
يُعزى ارتفاع مستويات IGFBP-2 لدى مرضى ابيضاض الدم اللمفاوي الحاد عند تشخيصهم، إلى أنّ الخلايا السرطانية تقوم بالتعبير عن IGFBP-2 الذي يؤدي إلى زيادة تكاثر الأرومات اللمفاوية السرطانية وتطورها، مما يبرز دوره كمقياس مُبَكّر للتنبؤ بوجود حالة نكس أو عدم استجابة للعلاج لدى مرضى الـ ALL (29).
تعد زيادة انتساخ الجين المشفر للـ IGFBP-2 في وحيدات النوى mononuclear من الأسباب المؤدية إلى ارتفاع مستوى الـ IGFBP-2 المصلي (30)، بالإضافة إلى كون الـ IGFBP- 2 العامل الثاني الأهم رابط للبروتين IGF-I بعد الـ IGFBP-3، لذا فإن انخفاض IGFBP-3 خلال فترة الإصابة بـ ALL تسمح للـ IGFBP-2 بأخذ دور الـ IGFBP-3 المنخفض فيزداد التعبير عن IGFBP-2 (30).
توافقت نتائج دراستنا مع دراسة أرغولس Arguelles وزملائه عام 2000، بتريدو Petridou وزملائه عام 2001، فورورك Vorwerk وزملائه عام 2005، داوزينكي Dawczynski وزملائه عام 2003، كروزوك – ريباك Krawczuk-Rybak وزملائه عام 2005، كيدزل وكروكزوك Kitszel and Krawczuk وزملائه عام 2007، زهاو Zhao وزملائه عام 2011 (23، 28، 31-35).
وُجد عند مقارنة مستو?ات IGFBP-2 المصل?ة لدى المرضى عند تشخ?ص إصابتھم باب?ضاض الدم اللمفاوي الحاد ALL وبعد معالجتم ما يلي:
29 مريضاً عادت مستويات IGFBP-2 الدوراني إلى حدودها السوية بعد المعالجة.
4 مرضى بقيت مستويات IGFBP-2 الدوراني مرتفعة، ولم يستجب هؤلاء المرضى للعلاج وكان الإنذار سيئاً لديهم. ويمكن أن تُفسّر النتائج بأن نجاعة العلاج حدّت من تطور الخلايا السرطانية وأوقفت التكاثر العشوائي السريع للسرطان، في نقي العظم، مما أدى إلى توقف التعبير المتزايد عن IGFBP-2 وعودته إلى مستوياته السوية.
أما المرضى غير المستجيبين للمعالجة فبقيت مستويات IGFBP-2 مرتفعة لديهم، مما يبرز دور العامل IGFBP-2 في تقييم مدى استجابة المرضى للعلاج المستخدم، والتنبؤ المبكر بنجاعة العلاج ( 36، 37).
|
الاستنتاجات Conclusions
وُجِدت تبدلات جوهرية في المستويات المصلية للـ IGFBP-2 بين الأطفال المرضى وبين الشواهد الأصحاء، ثم عادت بعد المعالجة إلى حدودها السوية لدى المرضى المستجيبين للعلاج، بينما بقيت مستويات IGFBP-2 مرتفعة فوق الحد الأعلى السوي في حالة المعالجة الكيميائية غير الناجعة، مما يبرز دور IGFBP-2 كعامل تنبؤي هام وجديد لتحديد استجابة المرضى للمعالجة الكيميائية.
|
| المراجع References |
1-Bethesda
SEER Cancer Statistic Review.
National Cancer Institute. 1973, 467, 2000.
2-R. W?sch and Lübbert M.
Hematological Neoplasia, in Concise Manual of Hematology and Oncology. Berger D.P; Henb H; Mertelsmann R. Editor, Springer: Springer-Verlag, 400-529, Berlin Heidelberg 2008.
3-Corrigan JJ.
F.S; Guidelines for pediatric cancer centers.
Pediatrics. 113, 182-183, 2004.
4-Van Eys J. et al.
The French-American-British (FAB) classification of leukemia.
The Pediatric Oncology Group experience with lymphocytic leukemia.
Cancer. 57(5): 1046-51, 1986.
5- Lilleyman J.S. et al.
Cytomorphology of childhood lymphoblastic leukemia: a prospective study of 2000 patients. United Kingdom Medical Research Council's Working Party on Childhood Leukaemia.
Br J Haematol. 81: 52-57, 1992.
6-T.S.
Molecular characterization of a novel serine protease involved in activation of the complement system by mannose-binding protein, 50: 510-511,1994.
7-Rogalsky RJ. and Reed MH.
Orthopaedic manifestations of leukemia in children.
J Bone Joint Surg Am; 86: 494, 1986.
8-Sinigaglia R. et al.
Musculoskeletal manifestations in pediatric acute leukemia.
J Pediatr Orthop, 28 (3): 19-20, 2008.
9- Brunning RD, Borowitz M. et al.
In: Jaffe ES, Precursor B lymphoblastic leukemia/ lymphoblastic lymphoma (Precursor B-cell acute lymphoblastic leukemia), in World Health Organization Classification of Tumors- Pathology and Genetics of Tumors of Haematopoietic and Lymphoid Tissues, S.H. Harris NL, Vardiman JW, Editor. IARC Press, Lyon. 111, 2001.
10-Schultz KR. et al.
Risk and response-based classification of childhood B. precursor acute lymphoblastic leukemia: a combined analysis of prognostic markers from the Pediatric Oncology Group (POG) and Children's Cancer Group (CCG).
Blood, 109(3): 926-35, 2007.
11-Moorman A.V. et al.
Outcome heterogeneity in childhood high-hyperdiploid acute lymphoblastic leukemia Blood, 102(8): 2756-62, 2003.
12-Hoffbrand P.A.M. and J.E. Pettit.
Acute leukaemias, in Essential Haematology A.V. Hoffbrand, Editor. Blackwell. 157-173, 2006.
13-Schultz K.R. et al.
Improved early event-free survival with imatinib in Philadelphia chromosome-positive acute lymphoblastic leukemia: a children's oncology group study.
J Clin Oncol, 27(31): 5175-5181 2009.
14-Ribera J.M. et al.
Concurrent intensive chemotherapy and imatinib before and after stem cell transplantation in newly diagnosed Philadelphia chromosome-positive acute lymphoblastic leukemia- Final results of the CSTIBES02 trial.
Haematologica, 95(1): 87-95, 2010.
15-Lauer S.J. et al.
A comparison of early intensive
methotrexate/mercaptopurine with early intensive alternating combination chemotherapy for high-risk B-precursor acute lymphoblastic leukemia: a Pediatric Oncology Group phase III randomized trial.
Leukemia, 15(7): 103-845 2001.
16-Moricke A. et al.
Risk-adjusted therapy of acute lymphoblastic leukemia can decrease treatment burden and improve survival: treatment results of 2169 unselected pediatric and adolescent patients enrolled in the trial ALL-BFM 95.
Blood journal, 113(18): 4477-4489, 2008.
17-Vora A. et al.
Toxicity and efficacy of 6-thioguanine versus 6-mercaptopurine in childhood lymphoblastic leukaemia: a randomised trial. Lancet, 368(9544): 1339-48 2006.
18-LeRoith D. and Goberts CT.
The insulin like growth factor system and cancer.
Cancer Lett 13, 195-127, 2003.
19-Olivecrona H. et al.
Acute and short term effects of growth hormone on insulin-like growth factors and their binding proteins: serum levels and hepatic messenger ribonucleic acid responses in humans.
J Clin Endocrinol Metab, 84, 553-560, 1999.
20-Merchav S.
The haematopoietic effects of growth hormone and insulin like growth factor-I.
J Pediatr Endocrinol, 11, 677-685, 1998.
21-Chen W. et al.
Phenotypes and genotypes of insulin-like growth factor 1, IGF-binding protein-3 and cancer risk, evidence from 96 studies.
Eur J Hum Genet, 17, 1668-1675, 2009.
22-Rinaldi S; Cleveland R; Norat T. et al.
Serum levels of IGFI, IGFBP.3and colorectal cancer risk: results from the EPIC cohort, plus a meta-analysis of
prospective studies.
Int Cancer, 126, 1702-1715, 2010.
23-Zhao D Jr; Zhang W-L. and Shi T-X
Serum levels of insulin-like growth factor-1 and growth binding protein-3 in children with acute lymphoblastic leukemia. Zhongguo Dang Dai 13,101-102, 2011.
24-Masanobu Kawai, Anne C. Breggia, and Victoria E. DeMambro.
The Heparin-binding Domain of IGFBP-2 Has Insulin-like Growth Factor Binding. independent Biologic Activity in the Growing Skeleton.
The Journal of Biological Chemistry. 286(16): 14670-14680, 2011.
25-Xinchun Shen et al.
Coordinate Cellular Response to Insulin-like Growth Factor-I (IGF-I) and Insulin-like Growth Factor-binding Protein-2 (IGFBP-2) Is Regulated through Vimentin Binding to Receptor Tyrosine Phosphatase ? (RPTP?).
The Journal of Biological Chemistry. 290, (18)11578-11590; 2015.
26-Wolf E; Lahm H. and Wu M. et al.
Effects of IGFBP-2 overexpression in vitro and in vivo.
Pediatr. Nephrol. 14 (7): 572–8; 2000.
27-Xiaoli Chen, Junke Zheng and Yizhou Zou.
IGF binding protein 2 is a cell-autonomous factor supporting survival and migration of acute leukemia cells.
Journal of Hematology & Oncology. 72(10).1186-1756; 2013.
28. Vorwerk P; Mohnike K; Wex H. et al.
Insulin-like growth factor binding protein-2 at diagnosis of childhood acute lymphoblastic leukemia and the prediction of relapse risk.
J Clin Endocrinol Metab, 90: 3022-302, 2005.
29-Firth SM. and Baxter RC.
Cellular actions of insulin growth binding proteins.
Endocr Rev; 23, 824-854, 2002.
30-Hind Medyouf, Samuel Gusscott.
High-level IGF1R expression is required for leukemia-initiating cell activity in T-ALL and is supported by Notch signaling.
The Journal of Experimental Medicine, 208, 179-180, 2011.
31-Petridou E. et al.
Insulin-like growth factor binding protein-3 predicts survival from acute childhood leukemia.
Oncology 60: 252-257, 2001.
32-Arguelles B; Barrios V. and Buno M.
Anthropometric parameters and their relationship to serum growth hormone binding protein and leptin level in children with acute lymphoblastic leukemia: a prospective study.
Eur J Endocrinol 143:243-250, 2000.
33-Dawczynski K, Kauf E. and Zintl F.
Changes of serum growth factors (IGF-I, -II and IGFBP-2, -3) prior to and after stem cell transplantation in children with acute leukemia.
Bone Marrow Transplant, 32:411-415, 2003.
34-Kitszel A. and Krawczuk RM
Are elevated serum levels of IGFBP-2 after intensive chemotherapy of childhood acute lymphoblastic leukemia a risk factor of relapse?
Adv Med Sci 52:147-153, 2007.
35-Krawczuk Rybak M, Muszynska Roslan K. and Kitszel A.
Relationship between insulin like growth factors (IGF-I and IGF-II), IGF-binding proteins (IGFBP-3, IGFBP-2), leptin and anthropometric parameters (height, body mass index) during antileukemic treatment in children.
Ann Acad Med Bialostocensis, 50, 208-211, 2005.
36-Mohnike KL. et al.
Serum levels of insulin-like growth factor I and II and insulin-like growth factor binding proteins-2 and 3 in children with acute lymphoblastic leukemia.
Eur J Pediatr, 155, 81-86, 1996.
37-Bang P. et al.
Ontogeny of insulin-like growth factor-binding protein-1,-2, and 3: quantitative measurements by radioimmunoassay in human fetal serum.
Pediatr Res; 34, 528-53, 1994.
|
| |
| |
| المجلد 8 , العدد 3-4 , ربيع الثاني 1438 - كانون الثاني (يناير) 2017 |
|
|
|
