| المجلد 8 , العدد 3-4 , ربيع الثاني 1438 - كانون الثاني (يناير) 2017 |
| |
| وجود Stenotrophomonas Maltophilia في مستشفيات مدينة دمشق ومقاومتها للمضادات الحيوية شائعة الاستعمال |
| Presence of Stenotrophomonas Maltophilia in Damascus Hospital
and its Resistance against Commonly Used Antibiotics
|
| د. علا عناية و أ. د. مصطفى العموري |
| Enayeh O. and Al-Amouri M. |
| كلية الصيدلة، جامعة دمشق
Faculty of Pharmacy, Damascus University
|
| الملخص Abstract |
تعد جراثيم S. maltophilia من الجراثيم الانتهازية المسببة لعداوى داخل المستشفيات، وهي عداوى وخيمة للمرضى المضعفين مناعياً كمرضى التليف الكيسي، ومرضى السرطان، ومرضى الداء الرئوي الانسدادي المزمن، وحتى أولئك الذين يستعملون المضادات الحيوية بشكل مفرط، بالإضافة إلى مرضى وحدات العناية المركزة ICU. وتتميز هذه السلالات بمقاومتها العالية للعديد من المضادات الحيوية شائعة الاستعمال في المستشفيات، مما يجعل معالجة المرضى المصابين بالعدوى صعبة جداً، وهذا يستدعي إقامةً أطول في المستشفى وتكلفة ً أكبر للعناية بالمريض، ونظراً لأنها تمتلك معدل وفيات عالٍ فإنها غالباً ماتنتهي بوفاة المريض.
كان هدف هذه الدراسة استقصاء وجود جرثومة S. maltophilia في مستشفيات دمشق، وتقييم حساسيتها لمعظم المضادات الحيوية شائعة الاستعمال. أجرينا هذه الدراسة على 136 عينة، 99 منها جُمعت من المرضى و37 جُمعت من البيئة المحيطة بهؤلاء المرضى. عُزلت الجراثيم بالطرق المرجعية المعيارية، وقُيمت حساسيتها باستخدام طريقة الانتشار من الأقراص الورقية الموصى بها من قبل اللجنة الوطنية للمعايير المخبرية والسريرية (NCCLS). عُزلت جراثيم S. maltophilia من المرضى بنسبة 20.2%، ومن عينات البيئة المحيطة بنسبة 8.1%، وأظهر الليفوفلوكساسين فاعلية بنسبة 91.3%، إلا أن السيفترياكسون والإيمبينيم والميروبينيم لم يظهروا أي أثر مضاد للجراثيم.
|
S. maltophilia is an opportunistic bacterium that cause nosocomial infections, and are severely infectious for immunocompromised patients such as those suffering cystic fibrosis, cancer, chronic obstructive pulmonary disease, and even those with hyper use of antibiotics, as well as ICU patients. These strains are highly resistant to many broad – spectrum antibiotics commonly used in hospitals, which make treatment of infected patients very difficult, thus resulting in a longer stay in hospital and higher patient-care costs, and since it has very high mortality rate, it often ends up with death of the patient.
The goal of this study was to investigate the presence of S. maltophilia bacterium in Damascus hospitals and evaluate their sensitivity to most of the commonly used antibiotics. We ran this study over 136 samples, of which 99 were collected from patients and 37 were collected from those patients’ surrounding environments. The bacterium was isolated using documented standard reference methods , and their sensitivities were evaluated using the Disk Diffusion method which is recommended by the national committee of lab and clinical standards. patients S. maltophilia bacterium is isolated with a success rate of 20.2%, where the environment’ bacterium is isolated with a success rate of 8.1%, and levofloxacin showed an effectiveness of 91.3%. However ceftriaxone, imipenem, meropenem showed no antibacterial effect.
الكلمات المفتاحKey Words : S. maltophilia، وحدة العناية المركزة ICU، المضادات الحيوية antibiotics، مستشفيات دمشق Damascus hospitals.
|
| المقدمة Introduction |
العدوى المكتسبة من المستشفيات أو ما يُعرف بالعدوى المستشفوية nosocomial infection هي أي عدوى جرثومية يكتسبها المريض لدى إقامته في المستشفى، ولم يكن مصاباً بها ساعة القبول، خلال فترة زمنية تتراوح بين 48 ساعة من قبوله إلى 15 يوماً بعد تخرجه (20، 21). تستدعي هذه العدوى إقامة ً أطول في المستشفى وتكلفة مادية أكبر، وتُعَدُّ سبباً رئيساً للوفاة، فهي غالباً ما تنتهي بالموت (16). تعد الجراثيم سلبية غرام Gram-negative bacteria السبب الرئيسي والشائع لهذه العدوى (24، 27)، ومنها العصيات سلبية غرام غير المخمرة للاكتوز التي تُعرف بـ ( (NFGNB Non fermenting Gram negative bacilli (19)، ونذكر منها Pseudomonas aeruginosa الأكثر عزلاً من العداوى المستشفوية يليها جرثومة Acinetobacter baumannii يليها جرثومة Stenotrophomonas Maltophilia.
ظهرت أهمية جراثيم S. maltophilia خلال الأعوام القليلة الماضية بسبب زيادة عزلها من عدة مستشفيات في عدة بلدان (11)، وهي من الجراثيم الانتهازية (6)، فهي لا تملك فوعة مرتفعة لدى الأشخاص الأسوياء مناعياً (14)، لكنها تسبب عداوى مستشفوية وتعد ذات إمراضية عالية لدى المرضى المضعفين مناعياً، كمرضى التليف الكيسي ومرضى الداء الرئوي الانسدادي المزمن COPD ومرضى السرطان، بالإضافة إلى المرضى الذين يستخدمون المضادات الحيوية بشكل مفرط، ومرضى وحدات العناية المركزة ICU (12، 25، 28). كما تسبب معدلاً مرتفعاً من الوفيات (يتراوح بين 21%-69%) (9).
تمثل هذه الجراثيم مشكلة حقيقية في الوسط الطبي بسبب انتشارها في البيئات السريرية في المستشفيات لقدرتها العالية على الالتصاق بالسطوح الرطبة وتشكيلها الطبقة الحيوية التي يساعدها على بناء المستعمرات على الأدوات والأجهزة الطبية (22، 25، 29)، حيث جرى عزلها من مصادر مختلفة منها: أنابيب الرشف (مص المفرزات) في المستشفى suction tubing، والوصلات الموجودة في المنفسة ventilator، والحساسات الالكترونية المؤقتة للمنفسة Electronic ventilator temp sensors (4)، والقثاطر الوريدية المركزية Central venous catheter، والمناظير Endoscopes (29)، والرذاذات Nebulizers، وحتى المطهرات الملوثة Contaminated disinfectants (18). وتتميز الذراري المعزولة من العينات السريرية بمقاومة عالية للمضادات الحيوية والمطهرات (30)، فقد جرى تصنيف جرثومة S. maltophilia من قبل منظمة الصحة العالميةWHO ضمن مجموعة (MDR) Multiple-drug-resistant المسببة للعدوى المستشفوية (5، 7)، أي الجراثيم متعددة المقاومة للمضادات الحيوية، وهي تبدي مقاومة لثلاثة مضادات حيوية أو أكثر من ثلاث زمر مضادات حيوية مختلفة (24)، حيث تعد جراثيم S. maltophilia مقاومة لزمر مختلفة من المضادات الحيوية مثل الأمينوغليكوزيدات والكاربينيم والجيل الثالث من السيفالوسبورينات (1، 9، 10 ،25). ترتبط إمراضية S. maltophilia بشكل رئيسي بعداوى السبيل التنفسي، فهو مكان العزل الأشيع لهذا الجرثومة (14)، حيث تعد العامل الممرض السادس الأكثر شيوعاً المسبب لـ Respiratory Tract Infections (RTI) (7). كما ترتبط إمراضيتها بعداوى أخرى كعدوى السبيل البولي وعدوى الدم وغيرها (25).
|
| المواد والطرق Materials and Methods |
شملت دراستنا 136 عينة، 99 عينة جُمعت من 99 مريضاً تراوحت أعمارهم مابين 25–85 عاماً، كانت مدة إقامتهم في المستشفى أكثر من 48 ساعة، وظهرت عليهم أعراض إنتانات صدرية من سعال منتج للقشع وحرارة مرتفعة لم تكن موجودة ساعة قبولهم في المستشفى، و37 عينة جُمعت من البيئة المحيطة بالمريض. جُمعت 36 عينة قشع و34 عينة غسالة قصبية و29 عينة بول، بحيث جرى أخذ عينة واحدة من كل مريض و21 عينة من أسرة المرضى و16 عينة من المنافس، في الفترة الزمنية ما بين شباط 2014 وتموز 2015، من قسم العناية المركزة وأقسام أخرى (صدرية – الدم )، من خمسة مستشفيات في دمشق (مستشفى المواساة، ومستشفى المجتهد، ومستشفى الأسد الجامعي، ومستشفى ابن النفيس، ومركز الباسل لجراحة القلب). وجرى استبعاد المرضى الذين تأكدت إصابتهم بعدوى عصيات كوخ أو عدوى فيروسية أو المرضى المقبولين في المستشفى بسبب الحرارة المرتفعة. واستخدمت الأوساط الجرثومية ال?زمة لزرع وعزل الجراثيم (الآغار المغذي، ماكونكي، المرق المغذي) صنع شركة Abtek (المملكة المتحدة)، كما استخدم وسط Stewart الذي جرى تحضيره بإضافة المواد التالية: مشعر أحمر الكريزول، مشعر أزرق بروموتيمول، حثيرات المرق المغذي، أرجنين L/ Hcl، الغلكوز، الآغار، صنع شركة Abtek (المملكة المتحدة). استخدمت أقراص المضادات الحيوية التالية لإجراء اختبار التحسس صنع شركة Abtek (المملكة المتحدة): الأميكاسين (AMK, 30 µg )، والجنتامايسين (GEN, 10 µg)، والسيفتازيديم (CAZ, 30 µg)، والسيفترياكسون (CTR, 30µg)، والسيفيبيم (CFP,30 µg)، والإمبينيم (IMP, µg 10)، والميروبينيم (MER,10 µg)، والتوبرامايسين (TOB , 10 µg)، والتيكارسيللين حمض كلافونيك (TIC-CL, 75/ 10 µg)، والكوليستين (COL,10 µg)، والبوليمكسين B (POL, 300 µg)، والسيبروفوكساسين (CPR,5 µg)، والليفوفلوكساسين (LEV, 5 µg)، والدوكيسيكلين (DOX, 30 µg)، والأوفلوكساسين (OFX, 25 µg)، والنورفلوكساسين (NOR, 10 µg)، والكلاريثرومايسين ( CLM,15 µg).
جُمعت العينات في أنبوب يحوي 5 مل مرق مغذٍ، ووضعت في الحاضنة بدرجة حرارة 37°C مدة 24 ساعة، وأُجري استفراد الجراثيم الموجودة في العينات على وسط الآغار المغذي، ثم زرعت المستعمرات المتشكلة المختلفة على وسط ماكونكي للتمييز بين الجراثيم المخمرة للاكتوز وغير المخمرة، حيث زُرعت المستعمرات غير المخمرة على وسط Stewart الذي يعتمد على حدوث تبدلات لونية، ومقارنتها بجدول يميز بين العصيات سلبية غرام من خلال اللون الذي يظهر على السطح وفي العمق حسب استقلابها للغلكوز والأرجينين، فينتج عنه منتجات قلوية أو حمضية تؤدي إلى تبدل لون المشعر في الوسط تبعاً لتبدلات درجة الباهاء pH، وتٌقرأ النتائج بعد حضن الوسط في الحاضنة بدرجة حرارة 37°C مدة 24 ساعة، حيث تبدو S. maltophilia بلون أزرق على السطح ولون أخضر في العمق، بينما تظهر aeruginosa P. بلون أصفر على السطح ولون بنفسجي في العمق وتعطي Burkholderia cepacia لوناً أصفر على السطح ولوناً أخضر في العمق. وجرى تأكيد التشخيص من خلال الاختبارات الكيميائية الحيوية كاختبار الكاتالاز، والأكسيداز، وإنتاج الدناز، واختبار الحركة، وتلوين غرام. أُجري اختبار التحسس على المضادات الحيوية بطريقة الانتشار من الأقراص الورقية التي تعرف بطريقة Kirby-baeur على وسط مولر هلَنتون، حيث حُضر المعلق الجرثومي وأُجريت عليه تمديدات عشرية للحصول على معلق جرثومي بتركيز 104-105 مستعمرة/ مل، أي ما يقابل العكر المعياري (McFarland 0.5)، ثم أُضيف هذا المعلق على وسط مولر هنتون، بحيث جرى غمر الوسط ثم رمي الطافي منه، ووضعت عليه أقراص المضادات الحيوية المختلفة، وحُضن الوسط في الحاضنة بدرجة حرارة 37°C مدة 24 ساعة، ثم قرئت النتائج وقورنت مع الجداول المرجعية لتلك المضادات الحيوية.
|
| النتائج Results |
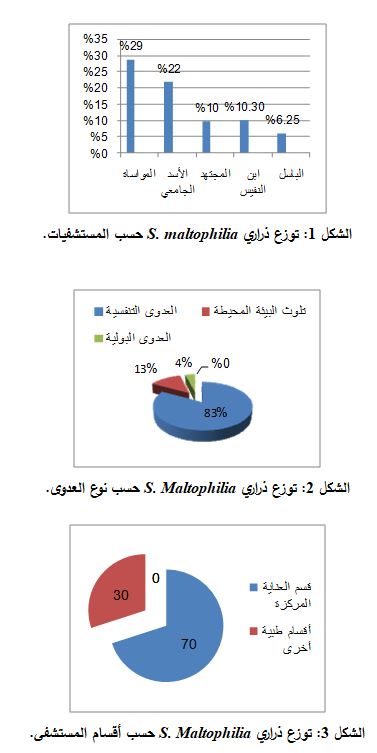
عُزلت 23 ذرية جرثومة S. maltophilia من 136 عينة، أي بنسبة 16.9%، حيث عُزلت 20 ذرية من 99 عينة جُمعت من 99 مريضاً فكانت نسبة عزل جرثومة S. maltophiliaلدى المرضى20.2 %، في حين جرى عزل 3 ذرارٍ من 37 عينة جُمعت من المنافس وأسرة المرضى فكانت نسبة عزل جرثومة S. maltophilia من البيئة المحيطة 8.1%. توزعت الـ 23 ذرية جرثومية بين 10 ذرارٍ عُزلت من مستشفى المواساة من أصل 34 عينة (29%)، و6 ذرارٍ من مستشفى الأسد الجامعي من أصل 27 عينة (22%)، و3 ذرارٍ من مستشفى المجتهد من أصل 30 عينة (10%)، و3 ذرارٍ من مستشفى ابن النفيس من أصل 29 عينة (10.3%)، وذرية واحدة من مركز الباسل من أصل 16 عينة (6.25%) (الشكل 1).
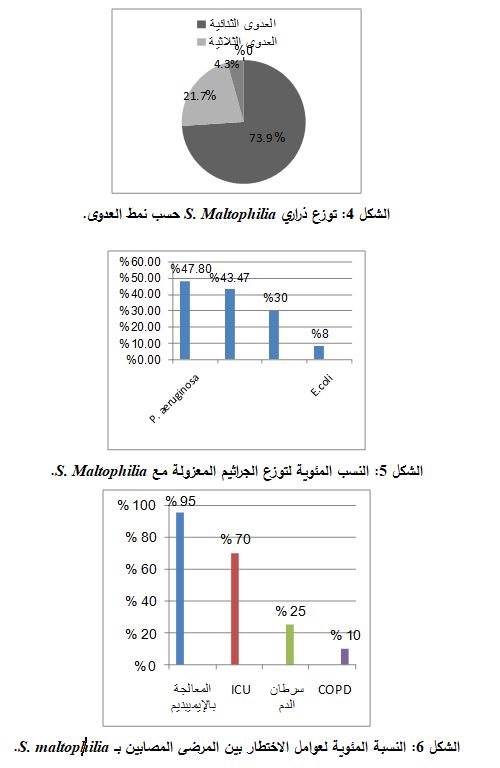
لوحظ أن تواتر وجود ذراري جرثومةS. maltophilia المعزولة في العدوى التنفسية كان 82.6%، حيث توزعت 23 ذرية S. maltophilia على 19 عينة من عينات القشع والغسالة القصبية، وذرية واحدة من عينة البول فكان تواتر وجود الجرثومة في العدوى البولية 4%، و3 ذراري من عينات المنافس والأسرة فكان تواتر وجود الجرثومة في البيئة المحيطة 13% (الشكل 2).
توزعت الذراري الجرثومية المعزولة من المرضى حسب أقسام المستشفى، حيث عُزلت 14 ذرية من وحدات العناية المركزة ICU في المستشفيات المختلفة (14/20) فكانت النسبة 70%، وعُزل من بقية الأقسام الطبية في المستشفيات المختلفة 6 ذرارٍ (6/20 ) فكانت النسبة 30% (الشكل 3).
|
 |
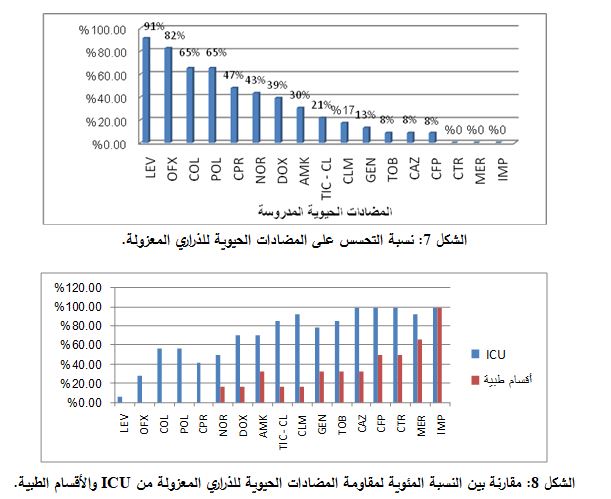
لوحظ في الـ 23 ذرية من ذراري S. Maltophilia المعزولة، أنه لم تُعزل هذه الجرثومة بمفردها في أيٍ منها، حيث كانت العدوى المفردة معدومة، بينما كانت جميع الذراري المعزولة من نمط العدوى المشاركة إما بنوعين جرثوميين (عدوى ثنائية)، أو بثلاثة أنواع جرثومية (عدوى ثلاثية)، أو بوجود أربعة أنواع جرثومية، وكان توزعها كما يلي: عُزلت 17 ذرية في العدوى الثنائية أي بنسبة 73.9%، و5 ذراري في العدوى الثلاثية أي بنسبة 21.7%، وذرية واحدة في العدوى الرباعية أي بنسبة 4.3% (الشكل 4).
وتبين أن الجرثومة الأكثر عزلاً مع ذراري S. Maltophilia هي P. aeruginosa، حيث عُزلت 11 ذرية منها أي بنسبة 47.8%، يليها Klebsiella pneumonia حيث عُزلت 10 ذرارٍ منها أي بنسبة 43.47%، يليها A. baumannii، حيث عُزلت 7 ذرارٍ منها أي بنسبة 30%، يليها Escherichia coli حيث عُزلت منها ذريتان أي بنسبة 8.6% (الشكل 5).
تبين من خلال جمع البيانات السريرية للمرضى الذين جُمعت منهم العينات عدة عوامل اختطار مشتركة كالمعالجة السابقة بالمضاد الحيوي الإيميبنيم، والقبول في قسم ICU، ووجود أمراض مرافقة كسرطانات الدم ومرضى COPD. توزعت هذه العوامل بين الـ 20 ذرية المعزولة من المرضى كالتالي: وجد أن عدد المرضى المعالجين بالإيميبنيم 19 أي بنسبة 95%، وعدد المرضى المقبولين في ICU 14 أي بنسبة 70%، و5 مرضى يعانون من سرطان الدم أي بنسبة 25%، بالإضافة إلى مريضين يعانيان من COPD أي بنسبة 10% (الشكل 6).
|
 |
نتائج تحسس الجراثيم على المضادات الحيوية لدى ترتيب حساسية الذراري المعزولة للمضادات الحيوية المدروسة وجد أن الليفوفلوكساسين جاء في المرتبة الأولى، حيث أبدت 91.3% من الذراري حساسية له أي 21 ذرية من أصل 23، يليه الأوفلوكساسين فكانت 82.6% من الذراري حساسة له (19/23)، ثم الكوليستين والبوليمكسين B فكانت 65.2% من الذراري حساسة لهما (15/23)، ثم السيبروفلوكساسين حيث أظهرت 47.8% من الذراري حساسية له (11/23)، ثم النورفلوكساسين 43.4% (10/23)، ثم الدوكيسيكلين 39.1% (9/23)، ثم الأميكاسين 30.4% (7/23)، أما باقي المضادات الحيوية فأظهرت الذراري المعزولة حساسية منخفضة لها، حيث كانت حساسيتها للتيكارسيللين – حمض كلافونيك 21.7% (5/23)، والكلاريثرومايسين 17.3% (4/23)، والجنتامايسين 13% (3/23)، والتوبرامايسين والسيفتازيديم والسيفيبيم 8.6% (2/23)، وكانت جميع الذراري المعزولة مقاومة للسيفترياكسون والإيمبينيم والميروبينيم (الشكل 7).
توزع نتائج تحسس الذراري المعزولة حسب أقسام المستشفى
جرى توزيع الذراري الجرثومية المقاومة للمضادات الحيوية المدروسة تبعاً لقسم المستشفى الذي عُزلت منها، فوجد أن الذراري المعزولة من ICU والبالغ عددها 14 ذرية كانت أكثر مقاومة من الذراري المعزولة من بقية الأقسام الطبية الأخرى الذي بلغت 6 ذراري (الشكل 8).
|
 |
| المناقشة Discussion |
يعزى ارتفاع معدل الوفيات إلى العلاج بطيف واسع من المضادات الحيوية بشكل عام والعلاج بزمرة الكاربابينيم بشكل خاص والذي يُعد أكبر وأهم عامل اختطار، بالإضافة إلى القبول في قسم ICU، وحدوث العدوى لدى المرضى المضعفين مناعياً كمرضى السرطان ومرضى COPD. وأظهرت الدراسة أن 25% من المرضى كانوا يعانون من سرطان الدم، حيث أن العلاج الكيميائي يُسبب قلة عدلات لدى هؤلاء المرضى (23)، بينما كان مرضى COPD بنسبة 10% وهذا ما يُفسر الاستخدام المتواتر للمضادات الحيوية لدى هؤلاء المرضى (9، 19) والذي يُعد أكبر وأهم عامل اختطار (2، 21، 23). وهذا ما أكدت عليه الدراسات جميعها بأن العلاج بطيف واسع من المضادات الحيوية يعد من أهم عوامل الاختطار التي تزيد من احتمال الإصابة بعدوى S. Maltophilia، حيث ذكرت دراسة أماني وزملائها في مصر عام 2014، ودراسة Saad وزملائه في فرنسا عام 2006 وجود علاقة يُعتد بها إحصائياً بين العدوى بـ S. Maltophilia والعلاج بالمضادات الحيوية (19، 25). ويُفسر ذلك بأن جرثومة S. Maltophilia لديها مقاومة لطيف واسع من المضادات الحيوية كزمرة الكاربابينيم، والجيل الثالث والرابع للسيفالوسبورينات، التي تعد من أكثر الأدوية شائعة الاستعمال في المجال الطبي لعلاج العدوى المستشفوية، حيث أكدت دراسة John على أن عدوى S. Maltophilia تتطور بعد المعالجة بالايميبنيم بشكل خاص وتزداد عند زيادة فترة الاستعمال لهذا المضاد الحيوي، فالعلاج بزمرة الكاربابينيم يُسهل لحدوث عدوى أشد (18، 23). وهذا ما أظهرته الدراسة بأن نسبة المرضى المعالجين بالايميبنيم 95%، كما بلغت نسبة المرضى المقبولين في قسم ICU في الدراسة 70%، ويُعزى ذلك إلى وجود المنافس في قسم ICU وبالتالي زيادة تواتر هذه العدوى لدى المرضى الذين يحتاجون التهوية الصناعية (17)، بينت الدراسة أن نسبة عزل S. Maltophilia من مرضى مستشفيات دمشق بلغت 20%، وتوافقت هذه النتائج مع دراسة أحمد وزملائه في السعودية عام 2013، حيث جرى عزل هذه الجرثومة بنسبة 20.8 % وكان حجم عينته قريباً من دراستنا (3)، وتباينت نتائج دراستنا مع نتائج دراسة أماني وزملائها في مصر عام 2014، حيث بلغت نسبة العزل 9.6 %، ويُفسر ذلك باختلاف حجم العينة حيث كان عدد العينات 690 عينة (25)، كما اختلفت نتائجنا مع نتائج دراسة Gulmez في تركيا عام 2005، حيث بلغت نسبة العزل في دراسته 9.7%، على الرغم من تقارب حجم عينة تلك الدراسة من عدد العينات في دراستنا، إلا أنه اعتمد في التشخيص طريقة PCR وهي طريقة أدق وذات مصداقية عالية (10).
اختلفت نتائج دراستنا مع نتائج دراسة Samonis في اليونان عام 2012 حيث بلغت نسبة العزل 10%، ويفسر ذلك بسبب كبر حجم العينة فقد استمرت تلك الدراسة مدة 6 أعوام، كما أن عدد العينات التي جُمعت من قسم ICU كانت قليلة مقارنةً مع عدد العينات التي جرى جمعها من بقية الأقسام الطبية (22، 25).
لوحظ من خلال نتائج دراستنا أنه لم تُعزل هذه الجرثومة بمفردها في أيٍ من العينات المدروسة وتوافقت هذه النتيجة مع نتيجة دراسة أُجريت في مصر، حيث جرى عزل الذراري جميعها من وسط متعدد المكروبات microbes، كما ذكرت نتائج تلك الدراسة أن العدوى المشاركة ذات إنذار سيء (25)، ويورد تفسير ذلك من خلال دراسة أجريت في اليابان أكدت على أن جرثومة S. Maltophilia تمتلك آلية إمراضية غير مباشرة بسبب امتلاكها إنزيمات ? لاكتاماز التي تبدي مقاومة للمضادات الحيوية من زمرة ? لاكتام وبالتالي يسمح هذا بنمو الجراثيم الأخرى الحساسة لهذه الزمرة من المضادات الحيوية الموجودة معه في الوسط حتى في حالة استخدام تراكيز عالية من المضادات الحيوية (15).
يلاحظ أن الليفوفلوكساسين هو الخيار العلاجي الأول، حيث بلغت النسبة المئوية للذراري الحساسة له 91.3%، وتوافقت نتائج هذه الدراسة مع معظم الدراسات التي تؤكد على فاعليته، حيث أكدت دراسة اُجريت في تايوان على أنه الدواء الأكثر فعالية (26)، وذكرت دراسة في المكسيك نُشرت عام 2014 أن نسبة الحساسية له هي 95.8% (8). وفي دراسة أُجريت في الفلبين عام 2014 بلغت نسبة الحساسية له 84.8% (14). أظهرت النتائج أن الذراري المعزولة جميعها مقاومة للسيفترياكسون والإيمبينيم والميروبينيم، وتوافقت نتائجنا في ذلك مع نتائج الدراسات جميعها، حيث بلغت النسبة المئوية لمقاومة هذه الجرثومة للإيمبينيم في دراسة Gulmez في تركيا 98% (10)، وكانت 100% في دراسة أُجريت في المكسيك (8)، وكانت نسبة مقاومة هذا الجرثومة للميروبينيم في دراسة Gulmez في تركيا 98% (10)، وبلغت النسبة المئوية لهذه المقاومة 92.4% في الدراسة التي أُجريت في المكسيك (8)، أما بالنسبة للسيفترياكسون فلقد توافقت نتائج دراستنا مع نتائج الدراسة التي أُجريت في تايوان والتي أكدت عدم فاعليته (26)، ومع نتائج دراسة أمينة في مصر التي ذكرت أن نسبة مقاومة الجرثومة له 86.4% (13).
|
| الاستناج Conclusion |
|
أثبتت الدراسة وجود جرثومة S. Maltophilia في مستشفيات دمشق ومقاومتها للمضادات الحيوية شائعة الاستخدام في المستشفيات كالإيمبينيم والميروبينيم وخاصة لدى مرضى ICU، لذا يجب الحذر عند استعمال هذه المضادات الحيوية لدى هؤلاء المرضى والاعتماد في المعالجة بشكل أساسي على نتيجة اختبار التحسس لكل مريض.
|
| المراجع References |
1-Al-Anazi K. and Al-Jasser A.
Infections caused by Stenotrophomonas maltophilia in recipients of hematopoietic stem cell transplantation.
Front Oncol; 4: 232, 2014
2-Armand-Lefèvre L. et al.
Emergence of Imipenem-Resistant Gram-Negative Bacilli in Intestinal Flora of Intensive Care Patients.
Antimicrobial Agents and Chemotherapy; 57(3): 1488-1495, 2013.
3-Asaad AM; Al-Ayed MS. and Qureshi MA.
Emergence of unusual nonfermenting Gram-negative nosocomial pathogens in a Saudi hospital.
Jpn J Infect Di; 66(6):507-511, 2013.
4-Brooke JS.
Stenotrophomonas maltophilia: an emerging global opportunistic pathogen.
Clin Microbiol Rev; 25(1): 2-41, 2012.
5-Brooke J.S.
New strategies against Stenotrophomonas maltophilia: a serious worldwide intrinsically drug-resistant opportunistic pathogen. Expert. Rev.
Anti. Infect. Ther; 12: 1-4, 2014.
6-Carmody LA; Spilker T. and LiPuma JJ.
Reassessment of Stenotrophomonas maltophilia phenotype.
J Clin Microbiol; 49(3): 1101-3, 2011.
7-Chang Y.T; Lin C.Y; Chen Y.H. and Hsueh P.R.
Update on infections caused by Stenotrophomonas maltophilia with particular attention to resistance mechanisms and therapeutic options.
Frontiers in Microbiology; 6: 1-20, 2015.
8-Flores-Trevi?o S. et al.
Stenotrophomonas maltophilia in Mexico: antimicrobial resistance, biofilm formation and clonal diversity.
J Med Microbiol.;63(Pt 11): 1524-30, 2014.
9-Gokhan Gozel M; Celik C. and Elaldi N.
Stenotrophomonas maltophilia Infections in Adults: Primary Bacteremia and Pneumonia. Jundishapur.
J Microbiol; 8(8): e23569, 2015
10-Gülmez D. and Hasçelik G.
Stenotrophomonas maltophilia: antimicrobial resistance and molecular typing of an emerging pathogen in a Turkish university hospital.
Clin Microbiol Infect; 11(11): 880- 886, 2005.
11-Isaiarasi G. and Bajaj R.
Stenotrophomonas maltophilia bacteremia in end-stage renal disease patients receiving maintenance hemodialysis.
Dialysis and Transplantation;38: 30 -32, 2009.
12-Jumaa P; Sonnevend A; Pàl T; El Hag M; Amith A. and Trad O.
The molecular epidemiology of Stenotrophomonas maltophilia bacteraemia in a tertiary referral hospital in the United Arab Emirates 2000-2004.
Ann Clin Microbiol Antimicrob; 5: 32, 2006.
13-Kandeel A; Mesbah M; El Ageery S. and El Etreby S.
An epidemiological Analysis of Stenotrophomonas Maltophilia Strains in Mansoura University Hospitals (MUHs.).
ejmm; 18(2), 2009.
14-Karen Estelle C; De Lunas M.D; John S; Delgado M.D; Maria Rhona G. and Bergantin, M.D.
Clinical Profile and Outcome of Stenotrophomonas maltophilia Infections Among Adult Patients Admitted at the University of Santo Tomas Hospital: A Seven-Year Retrospective Study.
Phil. Journal of Internal Medicine; 52 (2), 2014.
15-Kataoka D; Fujiwara H; Kawakami T; Tanaka Y; Tanimoto A; Ikawa S. and Tanaka Y.
The indirect pathogenicity of Stenotrophomonas maltophilia.
Int J Antimicrob Agents; 22(6): 601-6, 2003.
16-Kelly K.N. and Monson J.R.T.
Hospital-Acquired Infections.
Surgery (Oxford); 30: 640-644, 2012.
17-Lipuma JJ.
The changing microbial epidemiology in cystic fibrosis.
Clin Microbiol Rev; 23(2): 299-323, 2010.
18-Looney J; Narita M; and Mühlemann K.
Stenotrophomonas maltophilia: an emerging opportunist human pathogen.
Lancet Infect Dis; 9: 312-323, 2009.
19-Nseir S. et al.
Intensive care unit-acquired Stenotrophomonas maltophilia: incidence, risk factors, and outcome.
Crit Care; 10(5): R143. 2006.
20-Pathmanathan A. and Waterer GW.
Significance of positive Steno trophomonas maltophilia culture in acute respiratory tract infection.
Eur Respir J. 25(5): 911-914, 2005.
21-Sattler CA; Mason EO Jr. and Kaplan SL.
Nonrespiratory Stenotrophomonas maltophilia infection at a children's hospital.
Clin Infect Dis.; 31(6): 1321-1330, 2000.
22-Samonis G1. et al.
Stenotrophomonas maltophilia infections in a general hospital: patient characteristics, antimicrobial susceptibility, and treatment outcome.
Plos One; 7(5): e37375. 2012.
23-Safdar A. and Rolston KV.
Stenotrophomonas maltophilia: changing spectrum of a serious bacterial pathogen in patients with cancer.
Clin Infect Dis; 45(12): 1602-1609, 2007.
24-Sydnor E.R.M. and Perl T.M.
Hospital Epidemiology and Infection Control in Acute-Care Settings.
Clin Microbiol Rev; 24(1): 141-173, 2011.
25-Thabit A; Deaf E; Elsherbiny N. and Wageah E.
Prevalence of Nosocomial Stenotro-phomonas Maltophilia Infections in Assiut University Hospitals.
Bull. Pharm. Sc; 37 (1): 27-32, 2014.
26-Tseng CC. et al.
Risk factors for mortality in patients with nosocomial Stenotrophomonas maltophilia pneumonia.
Infect Control Hosp Epidemiol; 30(12): 1193-202, 2009.
27-Xu Z.Q; Flavin M.T. and Flavin J.
Combating Multidrug-Resistant Gram-Negative Bacterial Infections. Expert Opinion on Investigational Drugs; 23: 163-182.2014.
28-Yang Z. et al.
Prevalence and detection of Stenotrophomonas maltophilia carrying metallo-?-lactamase blaL1 in Beijing, China.
Front Microbiol; 5: 692, 2014.
29-Zhao Y. et al.
Identification and Characterization of a Serious Multidrug Resistant Stenotrophomonas maltophilia Strain in China.
Bio Med Research International; 2015: 1-10, 2014.
30-Zhang L; Li XZ. and Poole K.
Multiple antibiotic resistance in Stenotrophomonas maltophilia: involvement of a multidrug efflux system. Antimicrob Agents Chemother; 44(2): 287-93, 2000.
|
| |
| المجلد 8 , العدد 3-4 , ربيع الثاني 1438 - كانون الثاني (يناير) 2017 |
|
|
|
