| الملخص Abstract |
يترافق ابيضاض الدم اللمفاوي الحاد مع الكثير من المضاعفات التي تزيد من اختطار المرض وترفع معدل الوفيات. يمثل خلل الوظيفة البطانية الوخيم (الشديد) أهم هذه المضاعفات ويشكل المرحلة البدئية الهامة لتطور أمراض قلبية وعائية لاحقة. يعد العامل فون فيليبراند بروتيناً سكرياً ذي علاقة بالإرقاء. حيث تزداد مستوياته البلازمية في الأمراض الورمية وتنشأ من التبدلات الضائرة في البطانة الوعائية.
هدفت الدراسة إلى تحديد المستويات البلازمية للعامل vWF:Ag لدى الأطفال المصابين بالابيضاض اللمفاوي الحاد وأثر المعالجة الكيميائية على تلك الستويات.
شملت الدراسة 50 طفلاً: 30طفلاً مصاباً بابيضاض الدم اللمفاوي الحاد و20 من الشواهد الأصحاء، جُمعت العينات البلازمية من المرضى عند التشخيص وفي اليوم 35 من المعالجة الكيميائية. جرى تعيين مستويات vWF:Ag البلازمية بطريقة مقايسة الممتز المناعي المرتبط بالإنزيم (ELISA).
أظهرت نتائجنا زيادة يعتد بها P<0.05)) في مستويات vWF:Ag لدى الأطفال المصابين بالابيضاض اللمفاوي الحاد عند التشخيص (35.17±92.03 ng/ml)، مقارنة مع الشواهد الأصحاء (9.76±40.7 ng/ml). كما وجدنا أن متوسط المستويات البلازمية للعامل vWF:Ag كان أعلى بعد المعالجة الكيميائية (54.8±130.45 ng/ml)، من متوسط مستوياته البلازمية قبل المعالجة (35.17±92.03 ng/ml).
وكاستنتاج، فإنه يحدث خلل وظيفي بطاني شديد لدى مرضى ابيضاض الدم اللمفاوي الحاد بسبب المرض بحد ذاته أو ناجم عن أثر المعالجة الكيميائية. ويمكن أن تمثل مستويات العامل vWF واصماً هاماً لهذا الخلل ومن الممكن إضافتها كمشعر تنبؤي إضافي للأطفال المصابين الابيضاض الدم اللمفاوي الحاد.
|
Acute lymphoblastic leukemia is associated with a lot of complications that increase the risk of disease and rise mortality. The severe endothelial dysfunction represents the most important complication and constitutes the initial stage of the development of later cardiovascular disease. Von Willebrand factor is a blood glycoprotein involved in homeostasis. Its plasma level increases in neoplastic diseases and arises from adverse changes in the endothelium.
The study aimed to determine plasma levels of vWF:Ag in children with acute lymphoblastic leukemia and the effect of chemical treatment at its levels.
The study included 50 children: 30 diagnosed with acute lymphoblastic leukemia (ALL) and 20 healthy controls. Plasma samples were collected from patients at diagnosis and at day 35 of chemotherapy. Plasma levels of vWF:Ag were determined by enzyme-linked immuno-sorbent assay (ELISA).
Our results showed a significant increase in vWF:Ag levels in children with ALL at diagnosis (92.03±35.17ng/ml), compared to healthy controls (40.7±9.76 ng/ml). We also found that mean plasma levels of vWF:Ag was higher after chemotherapy (130.45±54.8 ng/ml) than mean plasma levels before therapy (92.03±35.17 ng/ml).
As conclusion, a severe endothelium dysfunction in patients with acute lymphocytic leukemia is caused by the disease itself or the effect of chemotherapy. Von Willebrand factor levels might represent an important marker to this disorder and can be added as additional prognostic indicator in children with acute lymphocytic leukemia.
|
| المقدمة Introduction |
يُعرّف ابيضاض الدم اللمفاوي الحاد بأنه تكاثر نسيلي خبيث في سلائف الخلايا اللمفاوية، خاصة سلالة الخلية البائية، مما ينتج عنه تكاثر غير منتظم وتوقف في تمايز هذه الخلايا، وسلالة الخلايا الناتجة لها الأفضلية بالنمو على العناصر الخلوية الطبيعية بسبب ارتفاع معدل انقسامها وانخفاض معدل موتها الخلوي المبرمج وبالنتيجة تتخرب الوظيفة الطبيعية لنقي العظم ويحدث قصور نقوي (1). ويعد هذا الابيضاض من أكثر الخباثات شيوعاً لدى الأطفال، حيث يشكل 30% من الخباثات المشخصة بعمر دون 15 عاماً (2)، حيث تحسن معدل البقيا survival rate لدى الأطفال المصابين بالابيضاض اللمفاوي الحاد بحوالي 90% في الأعوام الأخيرة وخاصة لدى الأطفال ذوي الإنذار الجيد (3)، ويعزى ذلك إلى تطور العلاجات الداعمة (1). وعلى الرغم من ذلك يبقى الابيضاض اللمفاوي الحاد المسبب الرئيسي للوفيات لديهم (3)، حيث تحدث مشكلة هامة تترافق مع هذا النوع من الابيضاض وهي خلل الوظيفة البطانية الشديد (ED) sever Endothelial Dysfunction (4). وينجم هذا الخلل في الوظيفة البطانية لدى الأطفال عن المرض بحد ذاته (5)، حيث أكدت إحدى الدراسات أن ED هو جزء من ابيضاض الدم اللمفاوي الحاد (6)، أو قد ينجم عن المعالجة الكيميائية بمثل الانتراسيكلينات، الميتوتريكسات، أو عن بعض العوامل المؤهبة مثل الالتهابات الجهازية، الشدة التأكسدية (5، 7). وهنالك القليل من الدراسات التي أظهرت أهمية الوظيفة البطانية لدى الأطفال المصابين بابيضاض الدم اللمفاوي الحاد (4). وتعد هذه الأذية الوعائية أهم العوامل المؤدية إلى تطور أمراض قلبية وعائية فيما بعد، منها التصلب العصيدي atherosclerosis، وارتفاع ضغط الدم hypertension، العديد من الأمراض الشريانية التاجية coronary artery diseases (5).
جرى الكشف عن بروتين سكري كبير يتواجد في البلازما وهو العامل vWF)) von Willebrand factor ويصنع هذا العامل في الخلايا البطانية وتلعب النّوّاء megakaryocyte دوراً أساسياً في عملية الإرقاء Hemostasis وتشكل الخثرة إذ يشكل جسراً هاماً في مواقع الأذية الوعائية وبالتالي يدعم تكدس الصفيحات (8)، وذلك من خلال ارتباطه مع معقد بروتيني مكون من بروتينات سكرية هي Ib, X, V)) موجودة على سطح الصفيحات، وهذا الارتباط يسهل عملية تفعيل وتكدس الصفيحات، وارتباطها إلى بعضها البعض، وإلى مكونات أساسية أخرى أيضاً مثل الكولاجين الموجود في بطانة الأوعية المتضررة. هذه البنى جميعها ضرورية لعملية تشكل الخثرة الدموية ووقف النزف (9). تكمن الوظيفة الثانية للعامل vWF في كونه مركباً حاملاً للعامل الثامن FVIII، لذا فهو يحميه من التصفية السريعة ويزيد من نصف عمره في البلازما (8). يتسبب عوز العامل vWF في الأهبة للنزف وحدوث ما يعرف بمرض von Willebrand disease، الذي يعد من أكثر الاضطرابات الوراثية النزفية المعروفة وهو ينجم عن عيوب كيفية (وظيفية) أو كمية في مستويات العامل vWF (10). وبالمقابل فإن زيادة مستوياته البلازمية تعد عاملاً هاماً وتنبؤياً لحدوث الخثار، فعند وجود عوز مكتسب أو وراثي في (ADAMTAS13) a disintegrin and metalloprotease with trombospondin type 1 repeat، المسؤول عن شطر العامل إلى جزيئات أكثر فعالية إرقائياً، فإنه يحدث تراكم UV-vWF البلازمي وينجم عن ذلك تراص وتكدس الصفيحات العفوي. ويقود هذا إلى ظاهرة فرفرية بنقص الصفيحات الخثارية (TTP) thrombotic thrombocytopenic purpura ، وتعد هذه الأخيرة مرضاً مهدداً للحياة نتيجة تشكل خثرات في الشرينات والشعيرات الدقيقة (11). حيث أكدت الدراسات الحديثة أن تزايد المستويات البلازمية للعامل vWF لوحظ في العديد من الأورام، بما فيها سرطان الثدي، سرطان البروستات، سرطان الحنجرة (12). وجرت دراستنا هذه على مجموعة من الأطفال المشخصين حديثاً بالابيضاض اللمفاوي الحاد للتنبؤ بقيمة ذلك العامل vWF الإنذارية لدى الأطفال الذين ستتطور لديهم أمراض قلبية متأخرة ناجمة عن خلل الوظيفة البطانية لديهم، وذلك من خلال مقايسة مستوياته في البلازما، حيث يدل ارتفاعها على تبدلات ضائرة في البطانة الوعائية، لكونه بروتيناً ثابتاً نوعياً للخلايا البطانية، بالإضافة إلى سهولة مقايسته (9). يعد هذا العامل مشعراً index هاماً لخلل الوظيفة البطانية الذي يلاحظ لدى هؤلاء الأطفال (8). وبما أنه لم تجرِ مقايسة العامل vWF:Ag في مجموعة من الأطفال المصابين بابيضاض الدم اللمفاوي الحاد في سورية، لذلك فإن دراسة هذا الواصم توفر معلومات إنذارية prognostic تسهم في الاستعراف المبكر عند الأطفال الذين حدث لديهم خلل في البطانة، وتشكل هدفاً واعداً في ظهور نتائج من الممكن استثمارها لديهم بهدف تخفيف نسبة المراضة morbidity والوفيات mortality وذلك عن طريق تعديل بعض العوامل العلاجية التي تسبب مشكلة للبطانة لديهم وإضافة عوامل وقائية هامة تقي من حدوث خثار.
|
| المواد والطرق Materials and Methods |
دراستنا هذه من نمط دراسة استباقية - حالة شاهد Prospective case control study.
جرت المصادقة على البحث من قبل لجنة أخلاقيات البحث العلمي في جامعة دمشق كما جرى ملء الموافقة المستنيرة من قبل أولياء أمر جميع الأطفال المشاركين في البحث.
شملت الدراسة مجموعة من الأطفال المصابين بابيضاض الدم اللمفاوي الحاد والذين قبلوا في مستشفى الأطفال الجامعي بدمشق في الفترة الواقعة بين 1/12/2015 حتى 15/8/2016 .
حيث تضمنت دراستنا 50 مريضاً بابيضاض الدم اللمفاوي الحاد جرى توزيعهم ضمن مجموعتين:
-1 مجموعة المرضى وشملت 30 طفلاً مصاباً بابيضاض الدم اللمفاوي الحاد وتراوحت أعمارهم بين 1 و 14 عاماً، جرى تصنيفهم حسب التصنيف المعتمد من قبل منظمة الصحة العالمية WHO وذلك استناداً إلى نتيجة مقياس التدفق الخلوي flowcytometry (20) Pre-B ALL / (10)) (T-ALL، وكان التنميط المناعي لديهم هو:
T-ALL (CD3, CD5, CD7), Pre-B (CD19, CD22, CD10-)
-2 المجموعة الشاهدة وشملت 20 طفلاً لا يعانون من أي عدوى وكانت قيم CRP لديهم طبيعية وتراوحت أعمارهم بين 1 و14 عاماً. تم سؤال أولياء أمر الأطفال جميعهم عن وجود تاريخ مرضي لحوادث خثارية ولم تسجل أي حالة.
جُمع 5 مل دم وريدي من المرضى المشـاركين في الدراسة ضمن أنبوب حاوٍ على سترات الصوديوم 3.8%، نُبذت العينات بسرعة 1500Xg لمدة 15 دقيقة، وحُفظت بدرجة حرارة – 20 C? إلى حين إجراء المقايسة.
جرى العمل على مرحلتين:
المرحلة الأولى: جُمعت العينة فور تشخيص الإصابة بابيضاض الدم اللمفاوي الحاد وقبل البدء بالمعالجة الكيميائية.
المرحلة الثانية: جُمعت العينة في اليوم 35 نهاية طور التحريض induction خلال مراجعة المرضى لاستكمال معالجتهم الكيميائية.
معايير الاستبعاد: استبعد المرضى المشخصون المعالجون كيميائياً، والمرضى المصابون بخباثات أخرى، كذلك استبعد المرضى في حال وجود أمراض قلبية وعائية أو داء سكري.
تضمن طور تحريض الهدأة في بروتوكول المعالجة المطبق BFM90/95 العوامل العلاجية التالية:
60 mg/m2 prednisolone (PRD) for 4 weeks, 1.5 mg/m2 Vincristine (VCR), 30mg/m2 Danurubicin (DNR) and 5.000 iu/m2 L- ASP.
جرى تعيين مستويات vWF:Ag البلازمية بطريقة المقايسة المناعية المرتبطة بالإنزيم (ELISA) Enzyme linked Immuno Sorbent Assay باستخدام عتيدة Human (vWF:Ag) ELISA لشركة Sun Red الصينية، وأُجريت المعايرة حسب تعليمات الشركة المصنعة.
المجال الطبيعي للعامل vWF:Ag هو 0.11– ng/ml 80.
|
| التحليل الإحصائي Statistical Analysis |
| أجري التحليل الإحصائي باستخدام برنامج الحزمة الإحصائية SSPS (version 21,IBM SSPS). جرى التعبير عن مستويات vWF:Ag البلازمية باستخدام المتوسط الحسابي ± الانحراف المعياري، وتَم تطبيق اختبار Mann-Whitney U للمقارنة بين المتوسطات ولمعرفة فيما إذا كان الفارق بين المجموعات جوهرياً أو ناتجاً عن الصدفة، كما اعتُمِدَت القيمة P<0.05 كقيمة إحصائية يُعتدّ بها. |
| النتائج Results |
| قيست مستويات العامل vWF:Ag البلازمية لدى مرضى ابيضاض الدم اللمفاوي الحاد المشاركين في الدراسة ومجموعة الأصحاء، حيث كانت مستويات vWF:Ag البلازمية لدى مجموعة المرضى أعلى منها لدى مجموعة الأصحاء وبفارق يعتد به إحصائياً (P= 0.025) (الجدول 2 والشكل2 ). |
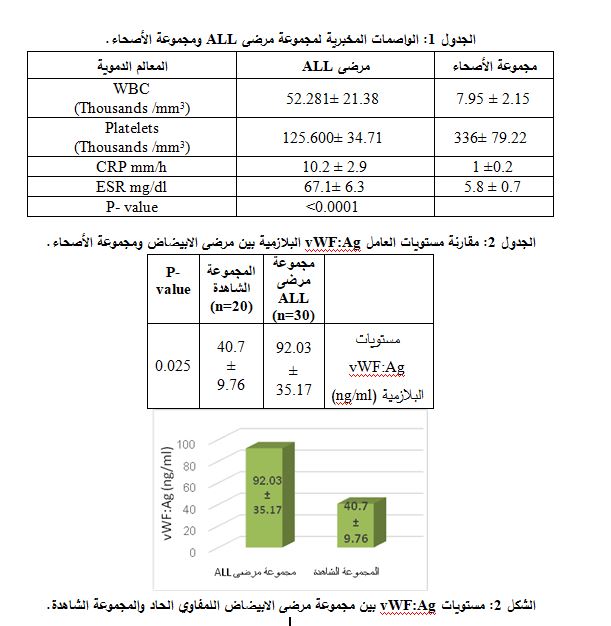 |
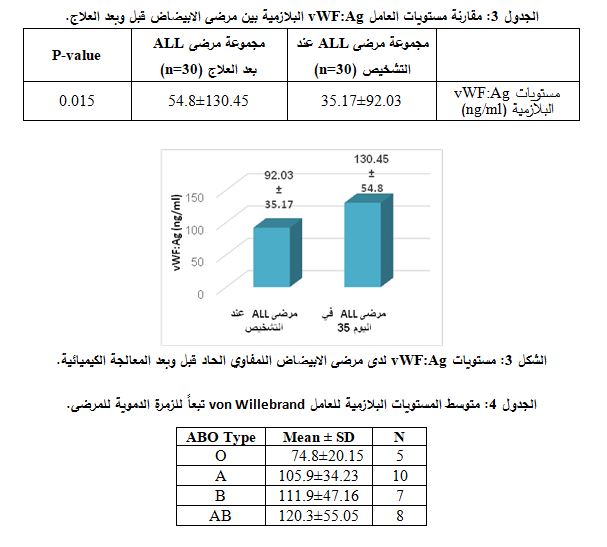
| قيست مستويات العامل vWF:Ag البلازمية لدى مرضى ابيضاض الدم اللمفاوي الحاد (ِALL) المشاركين في الدراسة قبل المعالجة الكيميائية وبعدها (اليوم 35)، حيث كان متوسط مستويات vWF:Ag البلازمية لدى المرضى بعد العلاج أعلى منه قبل العلاج وبفارق يعتد به إحصائياً (P= 0.015) ( الجدول 3 والشكل 3).
دُرست مستويات العامل von Willebrand بين مجموعات المرضى حسب الزمرة الدموية وجرى
تطبيق اختبار Kruskal-Wallis Test للمقارنة بين مجموعات المرضى من حيث الزمرة، كون هذا العامل يتأثر بالزمرة الدموية وذلك عند تشخيص إصابتهم بالابيضاض اللمفاوي الحاد، حيث كانت P=0.002، ولوحظ أن متوسط المستويات البلازمية للمرضى ذوي الزمرة O كان أقل من منه لدى المرضى ذوي الزمر A, B, AB ويوجد فارق يعتد به إحصائياً بينهما (الجدول 4).
|
 |
| المناقشة Discussion |
قيست مستويات العامل فون فيليبراند البلازمية لدى مجموعة من أطفال ابيضاض الدم اللمفاوي الحاد عند التشخيص فوجدنا ارتفاعاً واضحاً فيها مقارنة بالشواهد الأصحاء. ويمكن تفسير ذلك بعدة أسباب:
1- إن الخلايا الابيضاضية تحتوي على محفزات تخثر Procaogulants تكون موجودة إما على سطح هذه الخلايا أو ضمن الهيولى، وتتحرر هذه المحفزات إلى الدوران إثر تحطم هذه الخلايا ومن ضمنها العامل vWF (13).
2- إن الخلايا الورمية قادرة على الارتباط مع البطانة الوعائية عن طريق مجموعة من السيتوكينات الالتهابية التي يتم تصنيعها من قبل هذه الخلايا وتحريرها، حيث تعمل هذه السيتوكينات على تعزيز الحالة البادئة للخثار prothrombotic في الخلايا البطانية وتثبيط الخواص المانعة للتخثر (14) من خلال تحريض تحرر العامل vWF من الخلايا البطانية المفعلة وذلك عن طريق كبح تصنيع ADAMTAS13 الموجود في الخلايا الكبدية والبطانية، ومن هذه السيتوكينات المصنعة TNF-?, IL-4, IL-8 (15).
3- يعد العامل فون فيليبراند متفاعل طور حاد يمكن أن يتأثر بالعديد من العوامل الالتهابية ومن ضمنها CRP الذي لوحظ ارتفاعه لدى المرضى في بداية التشخيص (13).
توافقت نتائج دراستنا مع نتائج دراسة Adel AE Hagag وزملائه عام 2014 (9)، وكذلك مع دراسة Hatzipantelis وزملائه عام 2010 (5). حيث بينوا تزايد مستويات vWF:Ag البلازمية لدى مرضى الابيضاض خلال الطور الحاد من المرض وهذا يؤكد أن ارتفاع مستوياته البلازمية تشير إلى وجود خلل وظيفي بطاني ناتج عن ابيضاض الدم اللمفاوي الحاد، وتوافقت أيضاً مع دراسة Mohren وزملائه عام 2015 والتي أكدت أن ارتفاع هذا العامل يدل على أذية injury بطانية (16).
وجد ارتفاع مستويات Ag:ِvWF البلازمية لدى المرضى بعد العلاج (في اليوم 35) مقارنة بمستوياته البلازمية عند بدء التشخيص. يمكن تفسير ذلك بأن المعالجة الكيميائية، بمثل الانتراسيكلينات، تحدث تأثيرات سامة مباشرة على البطانة الوعائية مما يؤدي إلى خلل وظيفي بطاني، وبالتالي يؤدي تفعيل البطانة وتأذيها إلى ارتفاع مستويات العامل(16) vWF ، حيث تؤدي الانتراسيكلينات إلى اعتلال عضلة قلبية غير عكوس والذي يؤدي بدوره إلى إحداث سمية في البطانة الوعائية وخلل في وظيفتها وذلك من خلال نقص إنتاج NO وتزايد توليد فوق الأكاسيد (7). بالإضافة أن المعالجة الستيروئيدية تؤدي إلى ارتفاع مستويات vWF وتعد السبب الرئيسي لتطور الحالة الخثارية لدى الأطفال المصابين بالابيضاض (13). كما أن مشاركة prednisolone مع asparginase- L المستخدم في طور induction يعد سبباً هاماً لازدياد مستويات (8) vWF، حيث وجد أن المعالجة الستيروئيدية مع L asparginase تحرض فرط الخثورية hypercoagulability عن طريق تثبيط مضادات التخثر الطبيعية antithrombin, plasminogen والزيادة في مستويات معقد von Willebrand والعامل الثامن VIII /vWF (17).
توافقت نتائج دراستنا مع نتائج دراسة Schneider وزملائه عام 2009 (18) والتي بينت ارتفاع في مستويات vWF:Ag نتيجة استخدام prednisolone، وكذلك مع دراسة Thomas وزملائه عام 1993 (19)، ومع دراسة Albayrak عام 2012 (20) الذي قاس مستويات vWF:Ag في عدة مراحل ووجد تزايدها بعد تطبيق daunorubicin، vincristine في اليوم 11، وكذلك بعد تطبيقL asparginase L- في اليوم 14. ولذلك يمكن القول أن المعالجة الكيميائية أدت إلى رفع مستويات الواصم وتحرره من البطانة. ويؤكد هذا وجود تخرب بطاني ناتج عن المعالجة لدى مرضى الابيضاض اللمفاوي الحاد. ووجدنا عند دراسة تأثير الزمرة الدموية على مستويات العامل فون وليبراند البلازمية اختلافاً بين الأفراد، فكانت مستوياته لدى الأطفال ذوي الزمرة O أقل منها لدى الأطفال ذوي الزمر الأخرى ومع ذلك بقي ارتفاعها واضحاً مقارنة بالأصحاء. وتوافقت نتائجنا مع دراسة Massimo Franchini وزملائه عام 2007 (21).
|
الاستنتاج Conclusion:
إن مستويات von willebrand factor antigen تعد واصماً هاماً يمكن التنبؤ به عن وجود تأذٍّ بطاني شديد لدى الأطفال المصابين بابيضاض الدم اللمفاوي الحاد وذلك خلال الطور الحاد من المرض، وبالتالي يمكن اعتباره عاملاً إنذارياً إضافياً جديداً يوصى بمقايسته عند تشخيص الإصابة بالابيضاض اللمفاوي الحاد. |
| المراجع References |
1-Rao DG. et al.
Acute lymphoblastic leukemia in children.
Med Radiol. 2013;25(3):178-183.
2-Woo JS. et al.
Childhood B-acute lymphoblastic leukemia: a genetic update.
Experimental hematology & oncology. 2014;3(1):16.
3-Nigro LL.
Biology of childhood acute lymphoblastic leukemia.
Journal of pediatric hematology/oncology. 2013;35(4):245-252.
4-J?rvel? LS. et al.
Endothelial function in long?term survivors of childhood acute lymphoblastic leukemia: Effects of a home?based exercise program.
Pediatric blood & cancer. 2013;60(9):1546-1551.
5-Hatzipantelis ES. et al.
Thrombomodulin and von Willebrand factor: relation to endothelial dysfunction and disease outcome in children with acute lymphoblastic leukemia.
Acta haematologica. 2010;125(3):130-135.
6-Doroszko A. et al.
Elevated plasma ADMA contributes to development of endothelial dysfunction in children with acute lymphoblastic leukemia.
Postepy higieny i medycyny dos?wiadczalnej (Online). 2016;70:562.
7-Jang WJ, Choi DY. and Jeon I-S.
Vascular endothelial dysfunction after anthracyclines treatment in children with acute lymphoblastic leukemia.
Korean journal of pediatrics. 2013;56(3):130-134.
8-El Sherif NH. et al.
Von Willebrand Factor and Factor VIII Levels in Egyptian Children With Newly Diagnosed Acute Lymphoblastic Leukemia in Relation to Peripheral Blast Cells and Steroid Therapy.
Journal of pediatric hematology/oncology. 2014;36(7):518-523
9-Hagag AA. et al.
Prognostic value of plasma levels of thrombomodulin and von Willebrand factor in Egyptian children with acute lymphoblastic leukemia.
Journal of Oncology Pharmacy Practice. 2014; 20(5):356-361
10-Stockschlaeder M. et al.
Update on von Willebrand factor multimers: focus on high-molecular-weight multimers and their role in hemostasis.
Blood Coagulation & Fibrinolysis. 2014;25(3): 206-216.
11-Castaman G. and Linari S.
Human von Willebrand factor/factor VIII concentrates in the management of pediatric patients with von Willebrand disease/hemophilia A.
Therapeutics and Clinical Risk Management, 2016:12 1029–1037.
12-R?hsig LM. et al.
von Willebrand factor antigen levels in plasma of patients with malignant breast disease.
Brazilian Journal of Medical and Biological Research. 2001;34(9):1125-1129.
13-Athale U. et al.
von Willebrand factor and thrombin activation in children with newly diagnosed acute lymphoblastic leukemia: an impact of peripheral blasts.
Pediatric blood & cancer. 2010;54(7):963-969.
14-Caine GJ. et al.
The hypercoagulable state of malignancy: pathogenesis and current debate.
Neoplasia. 2002;4(6):465-473.
15-Kalambokis GN. et al.
von Willebrand factor antigen as a therapeutic target of portal hypertension in cirrhosis.
World journal of gastroenterology. 2016;22(19):4786.
16-Mohren M. et al.
High coagulation factor VIII and von Willebrand factor in patients with lymphoma and leukemia.
International journal of hematology. 2016;103(2):189-195
17-Athale UH. and Chan AK.
Thrombosis in children with acute lymphoblastic leukemia: Part II. Pathogenesis of thrombosis in children with acute lymphoblastic leukemia: effects of the disease and therapy.
Thrombosis research. 2003;111(4):199-212
18-Schneider P. et al.
Increased levels of tissue factor activity and procoagulant phospholipids during treatment of children with acute lymphoblastic leukaemia.
British journal of haematology. 2010;148(4):582-592
19-Payne JH. and Vora AJ.
Thrombosis and acute lymphoblastic leukaemia.
British journal of haematology. 2007;138(4):430-445.
20-Albayrak M. et al.
Alterations in procoagulant, anticoagulant, and fibrinolytic systems before and after start of induction chemotherapy in children with acute lymphoblastic leukemia.
Clinical and Applied Thrombosis/ Hemostasis. 2013;19(6):6.
21-Massimo Franchini. et al.
Martina Montagnana4 and Giuseppe Lippi.Relationship between ABO blood group and von Willebrand factor levels: from biology to clinical implications. Thrombosis Journal 2007, 5:14 doi:10.1186/1477-9560-5-14.
|
| |
| |
| |
