المقدمة
Introduction
الورم
السَّدويّ
المعديّ المعويّ
GIST)
Gastrointestinal stromal tumor)
ساركوما تنشأ
من الطبقة
الميزنشيمية
في الجدار
العضلي للسبيل
المعدي
المعوي،
وبالأخص في
المعدة
والأمعاء
الدقيقة [1].
حيث ينشأ من
خلايا كاجال Cajal
cells
التي تُولد
إشارات عصبية
تُسبّب في
حركته [2].
يُعدُّ من
أكثر الأورام
الميزنشيمية
انتشارا ً[3]. يتميز
هذا الورم
بالتعبير عن CD117 (c-kit)
مستقبل غشائي
ينتمي إلى عائلة
النمط الثالث
من مستقبلات
التيروزين كيناز،
وهو نتاج جين c-kit
proto-oncogene
الذي يتوضع
على الصبغي
الرابع في
الموقع 4q12
ويتكون من 21
إكسوناً [4].
جرى تأكيد الدور
الضالع لهذا
الجين في نشوء
وتطور ورم GIST، حيث أن
الطفرات التي
تنشأ في جين c-kit تكون
طفرات
مفَعِّلة/
طفرات كسب
وظيفة (activating mutations/ gain of function mutation) تُؤدي إلى تفعيل
مستمر
للمستقبل حتى
في غياب
اللَّجين Ligand وبالتالي
تفعيل سُبل
تنبيغ
الإشارة التي
تُؤدي إلى
تكاثر غير
منضبطٍ
للخلايا
ومقاومةٍ للاستماتة
[5،
6].
تظهر
الطّفرات في
جين c-kit
في الإكسون 11،
الإكسون 9
ونادراً في
الإكسون 13 و17.
تُشكّل
الطفرات
المفعِّلة في
الإكسون 11 حوالي
ثُلثي
الحالات (65%) وهي
الطفرات
الأكثر شيوعاً
وتتضمن حذف،
إدخال،
استبدال،
تضاعف أو مزيج
مما سبق [7].
يُرمِّز
الإكسون 11
للمجال
المجاور
للغشاء من
مستقبلc-kit الذي
يمتلك دوراً
هاماً في
تثبيط
المستقبل عند
غياب العامل
الرابط
المُفعّل له،
حيث يُشكل
بنية ملقط الشعر،
تتوضّع هذه
البنية بين
الفص الصغير
والفص الكبير
لمجال
الكيناز من
المستقبل،
ممّا يؤدي إلى
منعهما من
الحركة
الضرورية
لتفعيل سبييل
التّنبيغ
الخلوي [8].
وافقت
إدارة الغذاء
والدواء (FDA) على (Gleevec) Imatinib mesylate كخط أولي
لعلاج أورام GIST المنتقلة metastatic
GIST
بجرعة 400
ملغ يومياً
بصورة
مستمرة، كما
ويُعطى كعلاج
مُساعد في
أورام GIST الموضّعة Localized
GIST
بعد العمل
الجراحي
أيضاً [9]. إنَّ
الـ Imatinib mesylate جزيء
صغير، وهو
مثبط نوعي
للنمط الثالث
من مستقبلات
التيروزين
كيناز
المتضمنة لـ c-kit. تشبه
بنيته بنية ATP، حيث يعمل
كمثبط تنافسي
للمجال
الرابط لـ الأدينوزين
ثلاثي
الفسفات في
مستقبل c-kit، وما ينجم
عن ذلك من
تثبيط لسُبل
تنبيغ الإشارة
[10، 11].
تُقيَّم
الاستجابة
للعلاج
كاستجابة
كاملة Complete response (CR)
عندما يُبدي
المريض
تراجعاً
كاملاً في حجم
الآفة
الورمية، أو
استجابة
جزئية Partial response (PR)
عندما يكون
تراجع حجم
الآفة جزئياً.
وتُعرَّف عدم
الاستجابة
للعلاج بأنها
مرض مستقرّ Stable
disease (SD)عند ثبات
موجودات
التَّقارير
الشعاعية، ومرض
مُتقدّم Progressive
disease (PD) أي زيادة
في حجم الآفة،
حسب معايير RECIST (Response Evaluation Criteria
In Solid Tumor) [12،
13].
على
الرغم من أن
أكثر من نصف
مرضى GIST يُظهرون
استجابة
كاملة أو
جزئية
للعلاج، إلا
أن هنالك نسبة
من المرضى لا
يستجيبون له.
حيثُ أظهرت
العديد من
الدراسات
السابقة أنّ
المرضى الذين
يبدون طفرة
على مستوى
الإكسون 11 في جين c-kit هم أكثر
استجابة
للعلاج
مقارنةً مع
بقية المرضى [14-19].
ولما كانت
المقاربات
الحديثة
لعلاج الـ GIST بالـ Imatinib تتطلب استقصاءً
لوجود
الطفرات على
جين c-kit،
والتي تتواجد
بأكبر معدل
على الإكسون 11.
وحيث أن Imatinib الغالي
الثمن الذي
يُوفَّر
لمرضى GIST مجاناً في
سورية يُعطى
دون تقصي
طفرات جين c-kit، فقد هدفت
دراستُنا إلى
التحقق من
وجود أو غياب
هذه الطفرات
لدى
المُستجيبين
وغير المُستجيبين
للعلاج،
وبالتالي اقتراح
هذا التقصّي
لاستخدامه
عند وضع
بروتوكول
العلاج
لهؤلاء
المرضى.
المواد
والطرق
تصميم
الدراسة
صممت
الدراسة
كدراسة
مقطعية عرضية
استعادية
retrospective
cross-sectional study.
العينات
قُمنا
بمراجعة
سجلات مرضى
الورم
السّدويّ المعديّ
المعويّ في
أرشيف مستشفى البيروني
في المزة
وحرستا،
ومستشفى ابن
النفيس، حيث
يُصرف دواء imatinib لهؤلاء
المرضى،
لاختيار
السجلات
الحاوية على
بيانات الصرف
الشهري
للدواء بالإضافة
إلى نتائج
التصوير
الشعاعي
الطبقي المحوري
متعدّد
الشرائح (Multi Sliced
Computed Temography،
MSCT) المجراة
كل ثلاثة أشهر
لمتابعة
المرضى. بلغ
عدد السجلات التي
توافرت فيها
هذه البيانات
7 سجلات فقط من 47
سجلاً - لمرضى GIST تراوحت
تواريخُها من
2006-2016 - جرى البحث
فيها. وتبيّن
أن هنالك 2/7 مرضى
أظهرا
استجابة
كاملة للعلاج
(CR) و2/7 مرضى
أظهرا
استجابة
جزئية للعلاج
(PR) و3/7 مرضى غير
مستجيبن
للعلاج (SD). بحثنا في
أرشيف
التّشريح
المرضي في
كلٍّ من مستشفى
الأسد
والمواساة
الجامعيَين
عن العينات
النسيجية
للمرضى ذوي
السّجلات
السّبع. وبعد
الحصول على
موافقتهم
المستنيرة، جرى
الحصول على
عيناتهم
النسيجية
المحفوظة (7
عينات). وجرى
العمل عليها
في مخابر
التشريح
المرضي
والبيولوجيا
الجُزيئية في
مستشفى الأسد
الجامعي بدمشق.
الإعتيان
من العينات
النّسيجيّة
اقتُطع
مقطع نسيجي من
عينة
البارافين
ولُوِّن
بالهيماتوكسيلين-أيوزين
لتحديد الجزء
الورميّ من
العينة من قبل
أخصائي
التشريح
المرضي
باستخدام المجهر
الضوئي. تمَّ
الاسترشاد
بمكان الجزء
الورميّ في
المقطع
الملوّن
لاقتطاع
الجزء الورمي
من عينة
البارافين. جرى
حل البارافين
من العينات
بحضنها
بالإكزيلين
لمدة نصف
ساعة، ثم
بحضنها بمدروج من
الإيثانول
(المطلق، 80%، 60%، 40%)
ثم غسلها بالماء
ثنائي
التقطير. حُضن
النسيج بـ 40
مكل من Proteinase K و 200 مكل من درائة
الحل Lysis buffer طوال
الليل بدرجة
حرارة 55 درجة
سيليسيوس ((C°.
استخلاص
الدنا
الجينومي
استُخلص
الدنا
الجينومي من
الحلالة
باستخدام
عتيدة Dual Genomic DNA Isolation Kit-Tissue صنع شركة (GeneDireX،Taiwan )
وفقاً
لتعليمات
الشركة
الصانعة ولكن
بتخطّي مرحلة
الاستخلاص
بالطور
العضوي
(الكلوروفورم)
والاكتفاء
بمرحلة
الاستشراب
على الأعمدة.
جرى التحقق من
جودة عينات
الدنا بقياس
الامتصاصية
بطول موجة 260
و280 نانومتر
باستخدام
جهاز NanoDrop (صنع شركة NanoDrop
Technologies, Inc.،
USA).
تفاعل
البوليميراز
التسلسلي
التقليدي
جرى
تضخيم
الإكسون 11
الذي يمتدُّ
من نوكليوتيد
74422 إلى
نوكليوتيد 74548 من جين c-kit ذي التسلسل
المرجعي (NCBI
Reference Sequence: NG_007456.1).
استخدمنا
مشارع primers ذات
تسلسلات
منشورة (الجدول
1) [20]. تم
التأكد من
تراصف Alignment هذه
المشارع مع
المنطقة
المراد
تضخيمها باستخدام
أداة BLAST (https://blast.ncbi.nlm.nih.gov/Blast.cgi وقد جرى
تصنيع
المشارع في
شركة (Eurofins Genomics، Germany).
أُجري
تفاعل PCR باستخدام
محلول المزيج
الجاهز HotStar PCR
SuperMix
صنع شركة (GeneDireX، Taiwan ).
كان الحجم
النهائي
للتفاعل 50
مكل وتضمن:
محلول المزيج
الجاهز master mix
25 مكل، المشرع
المتقدم 1مكل
(بتركيز 10 مكرومول)،
المشرع
العكسي 1مكل
(بتركيز 10 مكرومول)،
عينة الدنا
المُستخلصة 5
مكل (بتركيز 30
مكغ/ مل) وأُكمل
الحجم إلى 50
مكل بالماء
ثنائي
التقطير.
أُجري
التفاعل
باستخدام
جهاز MasterCycler pro S (Eppendorf،
Germany). اعتمدنا
البرنامج
الحراري
التالي: دورة
واحدة من
التمسخ
البدئي بدرجة C°94 لمدة 2 د،
تليها 45 دورة (94 C°لمدة 30 ثا، 54 C°لمدة
30 ثا، 72 C°لمدة 1 د)
ودورة واحدة
من الاستطالة
النهائية بالدرجة
72 C° لمدة 7
دقائق.
أُجريَ
الرحلان
الكهربائي
على هلامة
الأغاروز ذات
التركيز .52%
الحاوية على
بروميد
الإيثيديوم
للتحقّق من
وجود نواتج
التّضخيم (281bp) (الشكل 1). تمّ
توثيق
الهلامة
باستخدام
جهاز توثيق
الهلام G:BOX gel
documentation system
صنع شركة (Syngene، UK).
تفاعل
السّلسلة Sequencing
بعد
تنقية نواتج
التّضخيم
باستخدام
عتيدة High pure PCR product purification
kit (Roche، Germany)
حسب تعليمات
الشركة
المصنعة، أُجريَ
تفاعل
السّلسلة
باستخدام
عتيدة Big dye terminator v3.1 cycle sequencing
kit (صنع
شركةApplied Biosystems، USA).
أُجري تفاعلي
سَلسلة
-أحدهما
باستخدام
المشرع
المتقدّم،
والآخر
باستخدام
المشرع العكسي-
لكل عينة
باستخدام
المشارع
المستخدمة في تفاعل
PCR. جرى ترحيل
نواتج
السَّلسلة
باستخدام
جهاز السّلسلة
المؤتمت ABI PRISM®
3100- AvantTM Genetic Analyzer
(صنع شركة Applied
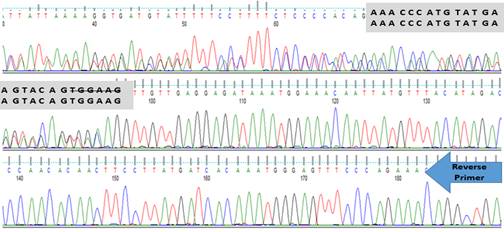
Biosystems، .(USA أُجريَ
تحليل
الكروماتوغرام
الناتج
وقراءة التسلسلات
ومقارنتها
بالتسلسل
المرجعي
المسجل في
قاعدة
البيانات NCBI (NCBI Reference Sequence: NG-007456.1) لاستكشاف
الطفرات
الناتجة.

الشكل 1:
نواتج تضخيم
الإكسون 11 (281bp ) لعينات GIST المفحوصة
بعد ترحيلها على
هلامة أغاروز
2.5%.
M: واصم
لقياس شدف
الدنا (-1001000bp).
1-7: عينات
لـ 7 مرضى.
المناقشة
Discussion
أظهرت
دراسَتُنا
وجود أربعة
أنماط من
طفرات الإكسون
11 لجين c-Kit، لدى
المرضى الذين
أثبتت
سجلاتهم
استجابة لـ imatinib، وغياب
الطفرات لدى
المرضى الذين
أظهرت سجلاتهم
عدم الاستجابة
له. وعلى الرغم
من قلّة عدد
مرضى GIST
المدروسين
سواء كانوا
مستجيبين أو
غير مستجيبين
للعلاج فقد
تماشى ما
وجدناه مع
الدراسات
السابقة التي
أثبتت أن
المرضى
الطافرون في الإكسون
11 هم الأكثر
استجابةً لـ imatinib ]14-19[. حيث وجد Debiec-Rychter
2004 أن
مرضى GIST الذين
يبدون طفرات
في الإكسون 11
هم الأكثر حظاً
لتحقيق
استجابة
جزئية للعلاج
(PR، 83%)،
مقارنةً مع
المرضى الذين
لم يبدوا طفرات
في هذا الإكسون
(23%) [19]. ويمكن
تفسير
استجابة
المرضى الذين
يُبدون طفرات
في الإكسون 11
للعلاج بالـ Imatinib، بدوره في
تثبيط مستقبل Kit الذي
يتفعًّل
بوجود هذه
الطفرات.
كما
أوضحت
نتائجنا
تغايراً بين
أنواع الطفرات
الناّتجة من
حذف Deletion،
أو استبدال Subtitution، أو حذف
وإدخال Indel. وَجدنا
هذه الطفرات
مُسجّلة في
قاعدة
البيانات للطفرات
الجسمية COSMIC، حيث جرى
اكتشافها
وتسجيلها من
قبل دراسات
أُخرى [21].
إنّ هذه
الطفرات التي
تظهر في
الإكسون 11 هي
طفرات مفعّلة
للمستقبل (activating
mutation) -
طفرات كسب
وظيفة Gain of function mutations - وذلك
لأنها تُخرّب
البنية
التثبيطية
للمجال
المجاور
للغشاء مما
يؤدي إلى
تفعيل مستمر للمستقبل
[6،
22].
بيّنت
دراستنا وجود
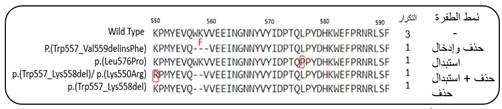
طفرة استبدال p.(Leu576Pro) لدى مريض
تلقّى العلاج
بـ imatinib
لمدة عامين
فقط وتماثل
لشفاء كامل (CR) بعد ستة
أشهر من بدء
العلاج، ولم
يُبدِ أي نكس
حتى تاريخه.
هذا وقد ذكرJoensuu
et al. في
دراسته التي
نشرت عام 2017
والتي قارن
فيها بين مرضى
يُبدون طفرات
استبدال،
تلقّت مجموعة
منهم العلاج
بـ imatinib
كعلاج مُساعد
لمدة عام
والمجموعة
الأخرى لمدة
ثلاثة أعوام،
حيث لم تجد الدراسة
أي فارق
يُعتدُّ به
إحصائياً
بمعدل
البُقيا بدون
نكس (Relapse free survival
RFS,) بين المجموعتين
[23]. ظهرت
طفرة حذف p.(Trp557-Val558delinsPhe) لدى مريض
في دراستنا
أوضحت سجلاته
أنه عانى نكساً
بعد 17 شهراً من
انقضاء العمل
الجراحي والعلاج
بـ Imatinib.
هذا وقد أثبتت
دراسة Wozniak et al. أن أورام GIST المُوضّعة
التي أبدت
طفرة حذف
متضمّنةً الكودون
557 والكودون 558
تُمثل مؤشراً
خطراً للنكس
حيث ترافقت مع
معدلات أعلى
للنكس، وهذا
ما يتوافق مع
ما وجدناه [24]. على
الرُّغم من أن
الطفرات التي
وُجِدت
بأنواعها
المختلفة في
دراستنا كانت
معدودة بسبب
ندرة سجلّات
المرضى التي
توفّرت فيها
بيانات كاملة
لمتابعة
العلاج، فقد
حقّقت الغرض
من إجراءنا
لهذا البحث.
الاستنتاجات
خَلُصَت
دراستنا إلى
ضرورة التحري
عن وجود أو
غياب
الطّفرات لدى
مرضى GIST قبل وضع منهج
العلاج بـ imatinib.
المراجع
References
1.Corless C.L.
Gastrointestinal stromal tumors: what do we know now?
Modern pathology, 27 Suppl 1: S1-16, 2014.
2.Kwon J.G; Hwang S.J; Hennig G.W; Bayguinov Y; McCann C;
Chen H; Rossi F; Besmer P; Sanders K.M. and Ward S.M.
Changes in the structure and function of ICC networks in ICC hyperplasia
and gastrointestinal stromal tumors.
Gastroenterology, 136 (2): 630-639, 2009.
3.Ducimetière F; Lurkin A; Ranchère-Vince D; Decouvelaere
AV; Péoc'h M; Istier L; Chalabreysse P; Muller C; Alberti L; Bringuier PP;
Scoazec JY; Schott AM; Bergeron C; Cellier D; Blay Y. and Ray-Coquard I.
Incidence of Sarcoma Histotypes and Molecular Subtypes in a Prospective
Epidemiological Study with Central Pathology Review and Molecular Testing.
PLoS One, 6 (8): e20294, 2011.
4.Abbaspour Babaei M; Kamalidehghan B; Saleem M; Huri H.Z.and
Ahmadipour F.
Receptor tyrosine kinase (c-Kit) inhibitors: a potential therapeutic
target in cancer cells.
Drug Des Devel Ther, 10: 2443-2459,
2016.
5.Heinrich Michael C; Rubin Brian P; Longley B.Jack and
Fletcher Jonathan A.
Biology and genetic aspects of gastrointestinal stromal tumors: KIT
activation and cytogenetic alterations.
Hum Pathol, 33 (5):
484-495, 2002.
6.Hirota S; Isozaki K; Moriyama Y; Hashimoto K; Nishida T;
Ishiguro S; Kawano K; Hanada M; Kurata A; Takeda M; Muhammad Tunio G; Matsuzawa
Y; Kanakura Y; Shinomura Y.and Kitamura Y.
Gain‑of‑function mutations of c‑kit in human
gastrointestinal stromal tumors.
Science, 279 (5350): 577‑580, 1998.
7.Barnett C.M; Corless C.L.and Heinrich M.C.
Gastrointestinal stromal tumors: molecular markers and genetic subtypes.
Hematol Oncol Clin North Am, 27 (5):
871-888, 2013.
8.Mol C.D; Dougan D.R; Schneider T.R; Skene R.J; Kraus M.L;
Scheibe D.N; Snell G.P; Zou H; Sang B.C.and Wilson K.P.
Structural basis for the autoinhibition and STI-571 inhibition of c-Kit
tyrosine kinase.
J Biol Chem, 279 (30): 31655-31663, 2004.
9.Gheorghe M; Predescu D; Iosif C; Ardeleanu
C; Băcanu F. and Constantinoiu S.
Clinical and therapeutic considerations of GIST.
J Med Life, 7(2): 139-149, 2014.
10.Buchdunger E; Cioffi C.L; Law N; Stover D; Ohno-Jones
S; Druker B.J. and Lydon N.B.
Abl Protein-Tyrosine Kinase Inhibitor STI571 Inhibits In Vitro Signal
Transduction Mediated by c-Kit and Platelet-Derived Growth Factor
Receptors.
J Pharmacol Exp Ther, 295 (1): 139-145, 2000.
11.Eisenberg B.L. and Judson I.
Surgery and imatinib in the management of GIST: emerging approaches to adjuvant
and neoadjuvant therapy.
Ann. Surg. Oncol, 11 (5):
465-475, 2004.
12.Therasse P; Arbuck S.G; Eisenhauer E.A; Wanders J;
Kaplan R.S; Rubinstein L; Verweij J; Glabbeke M.V; Oosterom A.T; Christian M.C.
and Gwyther S.G.
New Guidelines to Evaluate the Response to Treatment in Solid Tumors.
J Natl Cancer Inst, 92 (3): 205–216, 2000.
13.Guidance for Industry/Clinical Trial Endpoints for the
Approval of Cancer Drugs and Biologics.
https://www.fda.gov/downloads/Drugs/Guidances/ucm071590.pdf
14.Kang H.J; Ryu M.H; Kim K.M; Park Y.S; Choi J; Ryoo B.Y;
Kim W.H; Im S.A; Bang Y.J; Park S.H; Lee J.H; Chung I.J; Bae H.I; Kim J.G; Lee
K.H; Song H.S; Kwon H.C; Baek J.H; Shin D.B; Lee K.E. and Kang Y.K.
Imatinib efficacy by tumor genotype in Korean patients with advanced gastrointestinal
stromal tumors (GIST): The Korean GIST Study Group (KGSG) study.
Acta Oncol, 51 (4): 528-536, 2012.
15.Heinrich M.C; Owzar K; Corless C.L; Hollis D; Borden E.C;
Fletcher C.D; Ryan C.W; Mehren M; Blanke C.D; Rankin C; Benjamin R.S; Bramwell
V.H; Demetri G.D; Bertagnolli M.M. and Fletcher J.A.
Correlation of kinase genotype and clinical outcome in the North
American Intergroup Phase III Trial of imatinib mesylate for treatment of
advanced gastrointestinal stromal tumor: CALGB 150105 Study by Cancer and
Leukemia Group B and Southwest Oncology Group.
J Clin Oncol, 26 (33): 5360-5367, 2008.
16.Heinrich M.C; Corless C.L; Demetri G.D; Blanke C.D;
Mehren M; Joensuu H; McGreevey L.S; Chen C.J; Van den Abbeele A.D; Druker B.J;
Kiese B; Eisenberg B; Roberts P.J; Singer S; Fletcher C.D; Silberman S;
Dimitrijevic S. and Fletcher J.A.
Kinase mutations and imatinib response in patients with metastatic
gastrointestinal stromal tumor.
J Clin Oncol, 21 (23): 4342-4349, 2003.
17.Gao J; Dang Y; Sun N; Li J. and Shen L.
C-KIT mutations were closely associated with the response to Imatinib in
Chinese advanced gastrointestinal stromal tumor patients.
Med Oncol, 29 (5): 3039-3045, 2012.
18.Debiec-Rychter M; Sciot R; Le Cesne A; Schlemmer M;
Hohenberger P; Van Oosterom A.T; Blay J.Y; Leyvraz S; Stul M; Casali P.G;
Zalcberg J; Verweij J; Van Glabbeke M; Hagemeijer A. and Judson I. Tissue Eortc
Soft, Bone Sarcoma Group, Italian Sarcoma Group and Australasian
GastroIntestinal Trials Group. KIT mutations and dose selection for imatinib in
patients with advanced gastrointestinal stromal tumours.
Eur J Cancer, 42 (8): 1093-1103, 2006.
19.Debiec-Rychter M; Dumez H; Judson I; Wasag B; Verweij
J; Brown M; Dimitrijevic S; Sciot R; Stul M; Vranck H; Scurr M; Hagemeijer A;
Van Glabbeke M; Van Oosterom A.T.
Tissue Eortc Soft and Bone Sarcoma Group.
Use of c-KIT/PDGFRA mutational analysis to predict the clinical response
to imatinib in patients with advanced gastrointestinal stromal tumours entered on
phase I and II studies of the EORTC Soft Tissue and Bone Sarcoma Group.
Eur J Cancer, 40 (5): 689-695, 2004.
20.Calibasi G; Baskin Y; Alyuruk H; Cavas L; Oztop I;
Sagol O; Atila K; Ellidokuz H. and Yilmaz U.
Molecular analysis of the KIT gene in gastrointestinal stromal tumors
with novel mutations.
Appl Immunohistochem Mol Morphol, 22 (1): 37-45, 2014.
21.Forbes S.A; Bindal N; Bamford S; Cole C; Kok C.Y;
Beare D; Jia M; Shepherd R; Leung K; Menzies A; Teague J.W; Campbell P.J; Stratton
M.R. and Futreal P.A.
COSMIC: mining complete cancer genomes in the Catalogue of Somatic Mutations
in Cancer.
Nucleic Acids Res, 39 (Database issue):
D945-950, 2011.
22.Rubin B.P; Singer S; Tsao C; Duensing A; Lux M.L; Ruiz
R; Hibbard M.K; Chen C.J; Xiao S; Tuveson D.A; Demetri G.D; Fletcher C.D. and
Fletcher J.A.
KIT Activation Is a Ubiquitous Feature of Gastrointestinal Stromal
Tumors.
Cancer Res, 61 (22): 139-145, 2001.
23.Joensuu H; Wardelmann E; Sihto H; Eriksson M; Sund by
Hall K; Reichardt A; Hartmann JT; Pink D; Cameron S; Hohenberger P; Al-Batran SE;
Schlemmer M; Bauer S; Nilsson B; Kallio R., Junnila J; Vehtari A. and Reichardt
P.
Effect of KIT and PDGFRA Mutations on Survival in Patients With Gastrointestinal Stromal Tumors Treated
With Adjuvant Imatinib: An Exploratory Analysis of a Randomized Clinical Trial.
JAMA Oncol, 3(5): 602-609, 2017.
24.Wozniak A;
Rutkowski P; Schöffski P; Ray-Coquard I; Hostein I; Schildhaus HU; Le Cesne A;
Bylina E; Limon J; Blay JY; Siedlecki JA; Wardelmann E; Sciot R; Coindre JM. and
Debiec-Rychter M.
Tumor genotype is an independent prognostic factor in primary
gastrointestinal stromal tumors of gastric origin: a european
multicenter analysis based
on Contica GIST.
Clin Cancer Res, 20 (23): 6105-6116, 2014.