الشكل 1: المتوسط الحسابي
لتركيز ذراري العصيات اللبنية ×106 بوجود تراكيز مختلف من الأحماض الصفراوية.
التأثير المعدل مناعياً للعصيات اللبنية المعزولة من لبن
محلي
على إنتاج الانترلوكين 10 لدى فئران BALB/c
Immunomodulatory
Effect of Lactobacillus Isolated from Locally Yoghurt on Production of Interluekin 10 in BALB/c Mice
د. لانا موسى، أ.د. ألفونسو رويس برافو، و أ.د. خليل
القوتلي
Lana Mousa*, Alfonso Ruiz Bravo**
and KhalilAl Kwatli*
*كلية الصيدلة، جامعة دمشق، **كلية الصيدلة جامعة غرناطة، اسبانيا
*Faculty of Pharmacy, Damascus
University
**Faculty of Pharmacy, Garnatta University
تتزايد الأبحاث حول
أهمية عضيات التعايش التكافلي Probiotics في إحداث تعديلات مناعية باستمرار، لذلك هدفت هذه الدراسة إلى
تقييم قدرات التعايش التكافلي والتعديل المناعي لجراثيم Lactobacillus المعزولة من عينات لبن محلي. تم عزل جراثيم Lactobacillus من 7 عينات لبن محلي على وسط MRS آغار، واستعراف الذراري المعزولة باستخدام شرائط التصنيف الجرثومي
API CHL 50 ثم إجراء اختبارين من اختبارات التكافل الحيوي (تحمل انخفاض باهاء
الوسط - مقاومة التراكيز المرتفعة للأحماض الصفراوية) ومن ثم حقن الذريتين الأكثر
تحملاً (حية-مقتولة) بجرعة أو بثلاث جرعات في بريتوان فئران BALB/c وتمت معايرة مستوياتIL 10 المصلية
بمقايسة ELISA.
أظهرت نتائج التصنيف
الجرثومي 3 ذراري L. plantarum، ذريتين L. paracasei،3 ذراري L. fermentum وذرية واحدة .L. delbruecki كانت L. plantarum الأكثر قدرة في اختباري التعايش التكافلي تليها L. paracasei. وتبين أن لكل من هاتين الذريتين (حية-مقتولة) القدرة على زيادة
تراكيز IL 10 وتزداد هذه القدرة بازدياد عدد الجرعات دون وجود
فرق معتد به بين الحية والمقتولة، وكانت L. paracasei أعلى قدرة على تحريضه.
Research on immunomodulatory effects of probiotics are
constantly increasing, so this study aimed to evolution the probiosisand immune-modulatory
potential of locally isolated Lactobacillus.
Lactobacillus were isolated from 7 local yogurt
samples on MRS agar, then strains were identified by API CHL 50. Then evaluated
for 2 of probiotic characterizations(low pH tolerance
and bile saltsresistance). The two most potent
strains were injected (alive- heat killed) single or three doses
intraperitoneal of BALB / c mice groups then measureIL
-10 serum levels by ELISA assay.
The results of the bacterial classification showed 3
strains L. plantarum, 2 strains L. paracasei, 3
strains L. fermentum and one L. delbruecki. L.
plantarum was the most potent at probiotic characterizations tests followed by
L. paracasei. Both of them (alive-killed) had
increased IL 10 serum concentrations. This capacity increases with the number
of doses and there was no significant difference between alive and killed, L. paraceasei was more able to stimulate its production.
الكلمات المفتاح Key Words: عضيات التعايش التكافلي probiotic, العصيات اللبنية Lactobacillus، الانترلوكين 10IL-10.
المقدمة
Introduction
يعود مصطلح probioticإلى
اليونانية 'pro bios'
التي تعني من أجل الحياة (1). وبحسب WHO \FAO
(2001) هي عضيات حية عندما
تعطى بكميات كافية تمنح فائدة صحية للمتلقي (2). لإدراج سلالة من الكائنات الحية
المجهرية ضمن عضيات التعايش التكافلي probiotic
يجب أن تكون خلية عالية العيوشية في الجهاز الهضمي بالتالي يجب
أن تكون:
I-
مقاومة للأحماض الصفراوية ولتغيرات الباهاء pH؛
II-
آمنة أي أنها غير مسرطنة وغير غازية وغير ممرضة؛
III-
قادرة على الالتصاق بظهارة الأمعاء وتقليل التصاق الجراثيم الممرضة؛
IV-
القدرة على استعمار القناة الهضمية أو البقيا فيها؛
V-
أن تكون قادرة على التفاعل مع الخلايا المناعة المرتبطة بالقناة الهضمية وإرسال
إشارات من خلالها إلى بقية الجملة المناعي؛
VI- تملك فعالية مضادة للجراثيم الممرضة
(2، 3).
تعود أغلب العضيات
المصنفة كجراثيم تعايش تكافلي إلى أنواع جراثيم حمض اللبن (LAB) Lactic Acid Bacteria
التي تتضمن بشكل رئيسي جنس العصيات اللبنية Lactobacillus وجنس الشقاء Bifidobactirum إضافة لبعض الأنواع الجرثومية غير LABوالخمائر.
وجراثيم حمض اللبن LAB
هي مجموعة جراثيم تنتج حمض اللبن كواحد من منتجات التخمير الرئيسية لاستقلاب
السكاكر (4). توجد العصيات
اللبنية بشكل طبيعي عند الإنسان في السبيل المعدي المعوي والمهبل وعلى الجلد، كما
تستخدم بعض أنواعها لإنتاج اللبن، الجبن، المخلل، النبيذ وغيرها من الأطعمة
المتخمرة (5). وهي عصيات إيجابية
الغرام، غير مبوغة، لا هوائية مخيرة، سلبية الكاتالازو غالباً ما تنمو تحت شروط
أليفة للهواء القليل (6).
تستطيع العصيات
اللبنية أن تعدل وظائف الجهاز المناعي المخاطي عبر التفاعل مع الخلايا الظهارية
والخلايا المناعية المخاطية (7)، وقد أثبتت العديد
من الدراسات أن هناك ذراري معينة من العصيات اللبنية قادرة على تعديل إنتاج
السيتوكينات (8)، فقد تبين أن
الإعطاء الفموي لـ L. plantarum
أدى لتناقص مستويات كل من السيتوكينات المحرضة للالتهاب IL-1β و IL-6 لدى فئران BALB/c
(9). وأيضا ًمن بين هذه
السيتوكينات التي يمكن أن يتعدل إنتاجها 10IL-
وهو سيتوكين منظم للوظائف المناعية عبر تأثيرات متعددة النمط الظاهر بحيث يثبط
قدرة الخلايا التغصنية والبلاعم على تقديم المستضد للخلايا التائية كما يثبط تكاثر
الخلايا التائية واصطناعها للسيتوكينات المحرضة للالتهاب أما تأثيره على
اللمفاويات البائية تحفيزي حيث يمنع الاستموات ويعزز التكاثر والتمايز تجاه
الخلايا البلازمية، كما يعزز فعالية القاتلات الطبيعية ويساند فعالية البلعمة
للوحيدات والبلاعم (10). حيث تبين أن L. Caseishirota
تعدل إنتاج كل من IL-10 و IL-12 وتبعاً لذلك تعدل الاستجابات المناعية الناتجة (11)، كما أن الإعطاء
الفموي L.
plantarum للفئران السليمة لمدة
أسبوعين بجرعة 1010 جرثومة/ مل أدى إلى تناقص مستويات TNFα و IL-1β وازدياد مستويات IL-
10
(12). لذلك هدفت دراستنا
إلى تحري قدرات التعايش التكافلي والتعديل المناعي لذراري عصيات لبنية معزولة من
عينات لبن محلي وذلك عند حقنها in vivo في بريتوان فئران BALB/c.
المواد والطرق Material
and Methods
§ حيوانات التجربة
تمت
الدراسة المناعية على فئران BALB/c إناث عمرها 4-6
أسابيع، تم إحضارها من مركز البحوث في دمشق واستغرقت مدة التجربة 3 أسابيع بقيت خلالها في حواضن كلية الصيدلة بدرجة
حرارة 22-24C° بشروط ملائمة ومتوافقة مع شروط الحضن المعتمدة.
§ الاعتيان Sampling
تم جمع ست
عينات لبن صناعة منزلية (ثلاث عينات مصدرها بقري وثلاث أخرى مصدرها غنم) وواحدة من
لبن بقري تجاري ليكون عدد العينات الكلي سبع.
§ عزل الجراثيم من عينات اللبن Bacterial isolation
وضع 1 غ لبن في أنبوب زجاجي يحوي 10 مل مرق MRS آغار (HiMEDIA الهندية) وحضن بالدرجة 37°C بوجود CO2 بنسبة (10-5%)
لمدة 24 ساعة. أخذت عينة من كل أنبوب وتم استفرادها على
سطح MRS
آغار حضنت بالشروط السابقة لمدة 24-48 ساعة. واختيرت
الأطباق التي ظهر عليها مستعمرات نامية لاستكمال الفحوص والتأكد من كونها عصيات
لبنية.
§ الاختبارات المرجعية المطبقة لانتقاء عزلات الجراثيم المنتمية لجنس العصيات
اللبنية
a) تم إجراء تلوين غرام وفق تعليمات الشركة المصنعة Abtek) في المملكة المتحدة).
b) اختبار الكاتلاز باستخدام ماء أكسجيني تركيزه 15%.
c) اختبار التبوغ باستخدام عتيدة تلوين الأبواغ من إنتاج (شركة Abtek).
d) اختبار الحركة في وسط آغار مغذي نصف صلب محضر في أنابيب.
وتم انتقاء العصيات إيجابية
الغرام، سلبية الكاتلاز، غير المشكلة للأبواغ وغير المتحركة.
§ تحديد هوية الذراري الجرثومية التي تنتمي لجنس العصيات اللبنية بواسطة
شرائط التصنيف الجرثومية
استخدمت عتيدة شرائط API50
CHL strips: من إنتاج (شركة Biomerieux الفرنسية) المعتمدة على قدرة الجرثومة على تخمير 50 نوعاً من السكاكروز
تم العمل بحسب تعليمات الشركة المصنعة وإدخال نتائج الاختبار إلى الحاسوب لاستعراف
الذراري المدروسة عنAPIWEB software.
§ اختبارات إمكانية تصنيف الذراري المعزولة ضمن البروبيوتيك
1- اختبار مقاومة
الأملاح الصفراوية: أخذ 100 مكرولتر من المعلق الجرثومي (تركيزه 1.6 x 109 جرثومة/ مل) لكل عزلة ووضعها في أنابيب مرق MRS يحوي تراكيز مختلفة من الأملاح الصفراوية (%0.5، %1.5، %3، 4%)
وحضنها لمدة 24 ساعة بدرجة 37°C بوسط CO2 (5-10%). ثم قياس كثافة النمو الجرثومي بمقياس الطيف الضوئي (نوع EPOCH إنتاج شركة BioTek
الأميركية) بموجة طولها 600 نانومتر.
2- اختبار تحمل انخفاض باهاء الوسط: أخذ 100 مكرولتر من المعلق الجرثومي (تركيزه 1.6 x 109 جرثومة/ مل) ووضعت في أنابيب تحوي مرق MRS تختلف الباهاء فيه وتكون بالدرجات التالية: (2، 3، 4، 5) وحضن
المرق بعدها لمدة 3 ساعات بدرجة 37°C بوسط CO2 (5-10%) تم قياس كثافة النمو الجرثومي
بمقياس الطيف الضوئي بموجة طولها 600 نانومتر.
§ بروتوكول حقن جراثيم العصيات اللبنية في بريتوان الفئران
تم
اختيار الذريتين الأكثر مقاومة للحموضة وللأملاح الصفراوية وتعليقها بوسط PBS لتطبيق الدراسة المناعية وحقنها بمقدار0.1 مل بتركيز 108
جرثومة/ مل في بريتوان
الفئران ذلك وفق المجموعات التالية (حيث كل مجموعة
تتكون
من ستة فئران)
المجموعة
الأولى: أخذت حقنة وحيدة من معلق (L. plantarum) الحية وتم تطبيق تتمة الدراسة
عليها
بعد 48 ساعة.
المجموعة
الثانية: أخذت ثلاث حقن من معلق (L. plantarum) الحية موزعة بفارق 48 ساعة عن بعضها وتمت الدراسة عليها بعد 72 ساعة من موعد إعطاء الحقنة الأخيرة.
المجموعة
الثالثة: أخذت حقنة وحيدة من معلق (L. plantarum) المقتولة بالحرارة (تم وضع المعلق الجرثومي بحمام مائي بدرجة
حرارة 100°C
لمدة 30 دقيقة) وتمت الدراسة عليها بعد 48 ساعة.
المجموعة
الرابعة: أخذت ثلاث حقن من معلق (L. plantarum) المقتولة بالحرارة موزعة بفارق 48 ساعة عن بعضها وتمت الدراسة عليها بعد 72ساعة من إعطاء الحقنة الأخيرة.
المجموعة
الخامسة: أخذت حقنة وحيدة من معلق (L. paracasei)الحية وتم تطبيق تتمة الدراسة عليها بعد 48ساعة.
المجموعة
السادسة: أخذت ثلاث حقن من معلق (L. paracasei) الحية بفارق 48 ساعة وتمت
الدراسة عليها بـ 72 ساعة من الحقنة الأخيرة.
المجموعة
السابعة: أخذت حقنة وحيدة من معلق (L. paracasei) المقتولة بالحرارة وتمت الدراسة عليها بعد 48 ساعة.
المجموعة
الثامنة: أخذت ثلاث حقن من معلق (L. paracasei) المقتولة بالحرارة موزعة بفارق 48 ساعة عن بعضها وتمت الدراسة عليها بعد 72 ساعة من إعطاء
الحقنة الأخيرة.
مجموعة
الشواهد: حقنت بـ 0.1 مل PBS وتمت الدراسة عليها بعد 48 ساعة.
§ معايرة الانترلوكين 10 في مصل دم الفئران BALB/c بعد حقنها بجراثيم العصيات اللبنية بحسب المجموعات
سحب الدم من وريد عين
الفأر باستخدام ممص باستور زجاجي وطبقت مقايسة الإنزيم المناعي الممتزELIASA بحسب التعليمات الواردة مع العتيدة (إنتاج شركة CUASBIO الصينية) وقياس النتائج باستخدام قارئ ELIASA.
الدراسة الإحصائيةStatistical Study
تم إجراء الحسابات الإحصائية للبحث باستخدام
برنامج الحزمة الإحصائية للعلوم الاجتماعية SPSS (Statistical Package for the Social Sciences) الإصدار 13,0. حيث
تم استخدام اختبار تحليل التباين أحادي الجانب ANOVA وإتباعه باختبار الفروق
الصغرى ذات الدلالة LSD (Least Significant Difference). اعتمدت قيمة P<0.05 كونها تدل على قيمة
إحصائية يعتد بها.
النتائج Results
v أظهرت
النتائج نمو مستعمرات على وسط MRS
آغار وظهرت العصيات في 6 عينات لبن من أصل 7 حيث لم يتم عزل
أي عصيات من عينة اللبن التجاري.
v
عدد الذراري النامية 9 ذراري (5 مصدرها لبن بقري صناعة منزلية-4 مصدرها لبن غنم صناعة منزلية)
v
وبعد استعرافها بواسطة API-CHL كانت النتيجة: ثلاث
ذراري L. plantarum،
ذريتين L. paracasei، ثلاث ذراري L.fermentum وذرية واحدة من نوع L.delbrueckii.
v
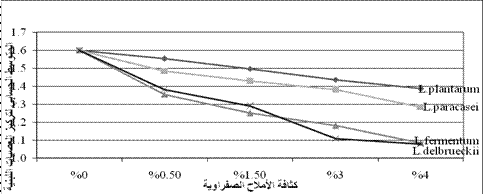
في اختبار تحمل الذراري للأحماض
الصفراوية عند أعلى قيمة 0.4% كانت النتيجة أن النمو الجرثومي كان الأعلى في كل من عزلات Lactobacillus Plantarum بمعدل بقيا 86.87% وعزلات
L. paracasei بمعدل بقيا 80.6% الشكل (1).
v وفي اختبار قدرة الذراري المعزولة على تحمل
انخفاض باهاء الوسط تبين أن الأكثر مقاومة كانت كل من عزلات L plantarum بمعدل بقيا 81.25% وعزلات L paracasei بمعدل بقيا 74.37%وذلك عند باهاء تساوي 2 الشكل 2.

الشكل 1: المتوسط الحسابي
لتركيز ذراري العصيات اللبنية ×106 بوجود تراكيز مختلف من الأحماض الصفراوية.
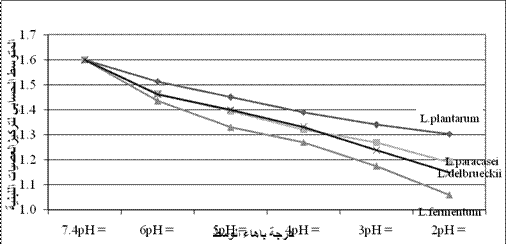
الشكل 2: المتوسط الحسابي
لتركيز ذراري العصيات اللبنية×106عند درجات PH مختلفة
vفي نتائج
تأثير حقن مجموعات فئران BALB/c بجراثيم ( L. plantarum,L.
paracasei) على مستويات الانترلوكين 10 في دمها حسب متوسط تراكيز IL-10 في كل مجموعة والانحراف المعياري له.
-
تم إجراء اختبار تحليل التباين أحادي الجانب ANOVA لدراسة دلالة الفروق في متوسط تركيز الانترلوكين IL10 (بيكوغرام/ مل)
بين مجموعات الفئران المدروسة. وكانت قيمة F المحسوبة 20.360 وP value>0.05
أي
أنه عند مستوى الثقة 95% توجد فروق ذات دلالة إحصائية في متوسط
تركيزIL-10
بين اثنتين على الأقل من المجموعات المدروسة.ولمعرفة أي المجموعات تختلف اختلافاً
جوهرياً عن الأخريات في متوسط تركيز IL10 تم إجراء
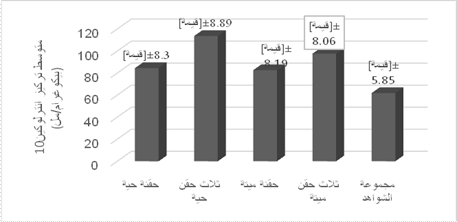
الشكل 3: مقارنة المتوسط
الحسابي لتركيز الانترلوكين IL10 (بيكوغرام / مل) بين مجموعات الفئران المحقونة
بـL. planrarum
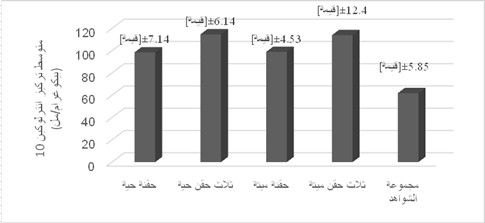
الشكل 4: مقارنة المتوسط
الحسابي لتركيز الانترلوكين IL10 (بيكوغرام / مل) بين
مجموعات الفئران المحقونة بـ L. paracasei
المقارنة الثنائية بين المجموعات
المدروسة وفقاً لطريقة LSD
وتبين من خلالها أن متوسط تركيز IL-10 لدى المجموعة الشاهدة (61.91±5.85
بيكو غرام/ مل) أقل من متوسطات المجموعات المحقونة بالعصيات اللبنية (حقنة L. plantarum
حية
84.55±8.3 بيكو غرام/ مل، حقنة L. paracasi
حية
98.53±7.1 بيكوغرام/
مل، حقنة L. plantarum مقتولة
82.71±8.19 بيكوغرام/ مل، حقنة L. paracasei
مقتولة
98.94±4.53 بيكو
غرام/ مل، ثلاث حقن L. plantarum
حية
113.63±8.89 بيكوغرام/
مل، ثلاث حقن L. paracasei حية
114.64±6.14 بيكوغرام/
مل، ثلاث حقن L. plantarum
مقتولة 97.66±8.06 بيكوغرام/ مل،
ثلاث حقن مقتولة L. paracasei113.96±12.42 بيكوغرام/
مل) والفارق يعتد به إحصائياً (P<0.05).
عند مقارنة متوسطات
المجموعات المحقونة بـL. plantarum مع بعضها نجد أن متوسط التركيز
لدىالمجموعة المحقونة بثلاث حقن حية113.63±8.89بيكوغرام/ مل أعلى من متوسط المجموعة
المحقونة بثلاث حقن مقتولة97.66±8.06
بيكوغرام/ مل بفارق معتد بهكما أن كلا المتوسطين أعلى بشكل معتد به من المحقونة
بحقنة واحدة حية84.55±8.3 بيكوغرام / مل والمحقونة بحقنة مقتولة82.71±8.19
بيكوغرام/ مل ولم يوجد فرق معتد به بين المجموعتين المحقونة بحقنة وحيدة حية
والمحقونة بحقنة وحيدة مقتولةالشكل(3).
وفي المجموعات المحقونة بـL. paracasi نجد أن متوسطي التركيز في المجموعتين المحقونتين
بثلاث حقن حية114.64±6.14 بيكوغرام/ مل وثلاث حقن ميتة 97.66±8.06
بيكوغرام/ مل كانا الأعلى بدون فارق معتد بينهما تلتهما المجموعات المحقونة بحقنة
وحيدة حية98.53±7.1 بيكوغرام/ مل، أو مقتولة 98.94±4.53 بيكو غرام/ مل وأيضا بدون فارق معتد به أي أنه لا فرق بين العصيات
الحية والمقتولة في زيادة تركيز IL-10
الشكل (4).
وأيضاً عند مقارنة
المتوسطات في المجموعات المحقونة بـ L. plantarum مع المحقونة بـ L.paracasi كل مجموعة مع مقابلتها من حيث كونها حية أو مقتولة ومن حيث عدد
الحقن كان الفرق المعتد به لصالح L.paracasi في المجموعات المحقونة بثلاث حقن مقتولة، المحقونة بحقنة واحدة
حية والمحقونة بحقنة وحيدة مقتولة.
المناقشة Discussion
v
أظهرت هذه الدراسة أن
العينات المأخوذة من لبن الصناعة المنزلية هي التي أعطت نمو للعصيات اللبنية وأما
عينة اللبن المأخوذ من ماركة تجارية لم تعط نمو وذلك لأن السلالات التجارية تتمتع
بمواصفات خاصة بالماركة التجارية ومنها ضعف النمو تدريجياً بتكرار مرات الزرع
وتلجأ الشركات التجارية إلى ذلك كي لايتم استعمال السلالات من قبل الشركات
المنافسة.
v
وبمقارنة نتيجة الذراري التي
عزلناها وهي L. plantarum،L. paracasei، L.fermentumوL.delbruki مع الذراري المعزولة في دراسة محمد يزدي التي تمت
على عينات اللبن في ايران2017والتي ظهرت فيها L. brevis،L. plantarum،L.fermentum وL. kefiri(13)ومع دراسة Sarah S Samuel وزملائها في الهند عام 2015 التي تمت على مشتقات لبنية كانت الذراري المعزولةL. casei subsp. casei ،L. plantarum،L. fermentum ،L. brevis،L. acidophilus، L. bulgaricus، L.rhamnosus
(14)، نلاحظ أن هناك ذراري مشتركة وأخرى مختلفة وبالتالي لكل منطقة في العالم
مجموعة من العصيات اللبنية تنمو في مشتقاتها اللبنية.
vفي
اختباري مقاومة الأملاح الصفراوية وتحمل الحموضة تقارب معدل بقيا L. plantarum و معدل بقيا L. paracasei في دراستنا مع دراسة نوال جمالي وزملائها في المغرب
عام 2011، كما توافقت نتائج دراستنا مع دراسة Babak Haghshenas التي جرت في إيران عام 2015 من حيث معدل بقيا L. plantarum لكن معدل
بقيا L. paracasei كان في دراستنا أعلى (15، 16). ويمكن تفسير ذلك بأن
خواص التكافل الحيوي تختلف من ذرية لأخرى حتى ضمن النوع ذاته. (1)
vوفي دراسة
الانترلوكين 10 ننوه إلى أن طريقة حقن (الذريتين L. plantarum وL. paracasei) في بريتوان الفئران لم يتم تطبيقها سابقاً و نجد أن
متوسطات تركيز IL-10 في جميع المجموعات المحقونة بالعصيات اللبنية أعلى من متوسطه في
المجموعة الشاهدة بفارق يعتد به إحصائياً أي أن الذريتين L. plantarum و L. paracaseiبشكليهما
(الحية-المقتولة بالحرارة) وسواءً بجرعة وحيدة أو ثلاث جرعات كانتا قادرتين على
رفع مستوياته وهذا توافق مع دراسة Gunaranjan Paturi وزملائه في استراليا عام 2008 التي تبين فيها أن الفئران التي أخذت L. paracasei فموياً زاد تركيز IL-10 في مصل دمها (17). ومع دراسة
H. Chon وزملائه في كوريا عام 2008 على خط وحيدات دم فأرية ex vivo التي أظهرت أن L. plantarum الحية والمقتولة بالحرارة زادت تركيز IL-10 بشكل ملحوظ و لم يظهر أي فرق معتد
به بينهما وأيضاً هذا توافق مع نتائجنا حيث أنه لم يوجد فرق معتد به بين المجموعة
المحقونة بحقنة حية والمجموعة المحقونة بحقنة مقتولة ولكنه اختلف في المجموعتين
المحقونتين بثلاث حقن حيث كان الفرق لصالح الحية (18). وفي المجموعات المحقونة بـ L. paracasei نجد
أن تركيز IL-10 يزداد بزيادة الجرعات هذا توافق مع دراسة Shen-Shih Chiang في
تايوان عام 2011(19)، ولم يتأثر سواء العصيات حية أو مقتولة وهذا أيضاً ما ظهر في دراسة Cross وزملائه على Lactobacillus casei Shirota حيث
لم يوجد فرق بين العصيات الحية والمقتولة في القدرة على تحريض إنتاج IL-10 (20). وهذا ما يمكن تفسيره بأن المكونات الجزيئية لعضيات التعايش التكافلي هي
التي تحدث الاستجابة البيولوجية (21).
vكانت L. paracasei أكثر قدرة من L. plantarum على تحريض إنتاج IL-10 وهذا ما اختلف مع دراسة C. Hessel في السويد عام 1999 التي تمت على وحيدات محيطية من دم الإنسان التي لم
يوجد فيها فرق بينها (22). وذلك يمكن أن يعود لاختلاف ظروف التجربة.
الاستنتاج Conclusion
أظهرت كل من الذراري
المعزولة من عينات اللبن المحلي (L. plantarum
و L. paracase) أنها قادرة على تحمل الأملاح صفراوية بتراكيز عالية وتحمل انخفاض
باهاء الوسط كما أن لها القدرة على تحريض إنتاج IL-10 المنظم للمناعة بشكليها (الحية-المقتولة بالحرارة) وبقدرة تتناسب
مع عدد الجرعات وبالتالي نقترح التوسع بدراسة تأثيراتهما المناعية مما قد يسمح
باستعمالهما بمجالات تطبيقية(غذائية-دوائية) مستقبلاً.
كلمة شكر: نشكر قسم المخابر في مشفى الأسد الجامعي ومركز اللشمانيا في جامعة دمشق
لإتاحة الفرصة وإتمام العمل.
المراجعReferences
1. Soccol CR, Porto L, Vandenberghe
DS, Spier MR, Bianchi A, Medeiros P. et al.
The Potential of Probiotics.
A Review. 2013; 48(4): 413-34.
2. Galdeano
CM, Leblanc ADM De, Vinderola G, Bonet MEB. and Perdigo G.
Minireview Proposed Model.
Mechanisms of Immunomodulation Induced by Probiotic Bacteria. 2007; 14(5): 485-92.
3. Armbrister
WL.
A Scientific Review. 2017; (Table 1): 2022-5.
4. Quinto
EJ, Jiménez P, Caro I, Tejero J. and Mateo J.
Probiotic Lactic Acid Bacteria.
A Review. 2014; (September): 1765-75.
5. Fijan
S.
Microorganisms with Claimed Probiotic Properties.
An Overview of Recent Literature. 2014; 4745–67.
6. Mattarelli
P, Holzapfel W, Franz CMAP, Endo A, Felis GE, Hammes W, et al.
Taxonomic Note Recommended minimal standards for description of new taxa
of the genera Bifidobacterium , Lactobacillus and related genera.
2017;(2014):1434–51.
7. Wells
JM.
Immunomodulatory mechanisms of lactobacilli.
Microb Cell Fact [Internet]. 2011;10(Suppl 1): S17.
Available from.
http://www.microbialcellfactories.com/content/10/S1/S17
8. Leblanc
ADM De, Carmen S, Zurita-turk M, Rocha CS, Guchte M Van De, Azevedo V, et
al.
Importance of IL-10 Modulation by Probiotic Microorganisms in
Gastrointestinal Inflammatory Diseases. 2011; 2011.
9. Cienfuegos
D, Puertollano A, Cruz-chamorro L, Gerardo A, Puertollano E, Ruiz-bravo A, et
al.
Orally administered Lactobacillus plantarum reduces pro-inflammatory
interleukin secretion in sera from Listeria monocytogenes infected mice. 2017; (2008):
819–25.
10. Couper KN, Blount DG. and Riley EM.
IL-10: The Master Regulator of Immunity to Infection. 2018;
11. Rumi Kaji et al.
Short communication: Probiotic induction of interleukin-10 and
interleukin-12 production by macrophages is modulated by co-stimulation with
microbial components.
Journal of dairy science.
12. Le B. and Yang SH.
Efficacy of Lactobacillus plantarum in prevention of in fl ammatory bowel
disease.
2018; 5(March): 314–7.
13. Kazem M. et al.
Characterisation and probiotic potential of lactic acid bacteria isolated
from Iranian traditional yogurts. 2017.
14. Samuel SS, Shukla S, Ramteke PW.
Isolation and identification of antagonistic Lactobacillus spp. isolated
from dairy products against selected pathogens. 2016; 5(1):8–13.
15. Jamaly N, Benjouad A, Bouksaim M.
Probiotic Potential of Lactobacillus strains Isolated from Known Popular
Traditional Moroccan Dairy Products. 2011; 1(4): 79–94.
16. Haghshenas B, Nami Y, Haghshenas M,
Abdullah N, Rosli R.
Bioactivity characterization of Lactobacillus strains isolated from dairy
products. 2015; 803–13.
17. Paturi G. and Phillips M.
Effect of Probiotic Strains Lactobacillus acidophilus LAFTI L10 and
Lactobacillus paracasei LAFTI L26 on Systemic Immune Functions and Bacterial
Translocation in Mice.
2008; 71(4): 796–801.
18. Chon H, Choi B, Lee E, Lee S. and
Jeong G.
Immunomodulatory effects of specific bacterial components of Lactobacillus
plantarum KFCC11389P on the murine macrophage cell line RAW 264 Æ 7.
2009;107(Il):1588–97.
19. Marranzino G. et al.
Stimulation of macrophages by immunobiotic Lactobacillus strains :
influence beyond the intestinal tract.
2012;(July):771–81.
20. Taverniti V. and Guglielmetti S.
The immunomodulatory properties of probiotic microorganisms beyond their
viability (ghost probiotics : proposal of paraprobiotic concept).
2011; 261–74.
21. Adams CA.
The probiotic paradox : live and dead cells are biological response
modifiers.
2018; (2010): 37-46.
22. Hessle C.
Lactobacilli from human gastrointestinal mucosa are strong stimulators of
IL-12.
1999; 276-82.