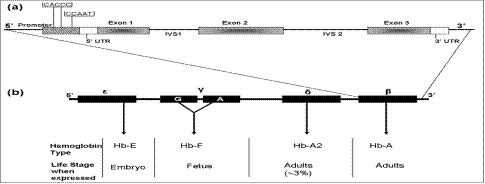
الشكل 1: تمثيل توضيحي لجينة الغلوبين بيتا (a) وموقعه إلى جانب جينات الغلوبينات المتوضعة على الجينة ذاته (b) (8).
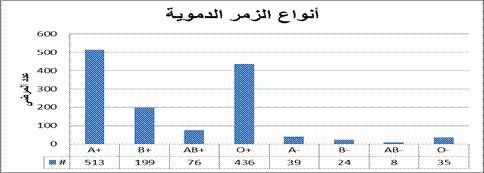
الشكل 2: توزع مرضى الثلاسيمية بيتا المراجعين لمركز
الثلاسيمية تبعاً لزمرهم الدموية.
ارتباط الزمر الدموية بطفرات الثلاسيمية بيتا لدى مرضى
سوريين
Correlation of ABO Blood
Groups with frequency of
β-thalassemia mutations in Syrian Patients
أحمد
شجاع1، ياسر مخللاتي2، حسام مراد3 و فايزة
القبيلي1
Shoujaa
A.1; Mukhalalaty Y.2; Murad H.3
and Al-Quobaili F.1
1 كلية الصيدلة،
جامعة دمشق، سورية، 2 مركز الثلاسيمية، وزارة الصحة، دمشق
3 هيئة الطاقة الذرية السورية، دمشق،
سورية
1 Faculty of Pharmacy -
Damascus university- Syria
2Thalassemia Center – Ministry
of Health – Damascus
3Atomic Energy of Syrian Commission , Damascus, Syria
تعد متلازمة
الثلاسيمية بيتا أحد أمراض فقر الدم الوراثي الناجمة عن عيب في جينة الغلوبين
بيتا، يوجد أكثر من 922 من تنوعات الثلاسيمية المعروفة، ويتوزع العديد منها في
مناطق جغرافية معينة في العالم. تمت دراسات عدة حول تواتر طفرات الثلاسيمية بيتا
في المجتمع السوري، دون إدخال أي متغير في حالة المريض. لذلك هدفت دراستنا إلى
استقصاء إمكانية الربط بين الزمر الدموية وطرز الطفرة لدى مرضى ثلاسيمية بيتا سوريين.
شملت الدراسة 197 مريضاً سورياً تراوحت أعمارهم بين 2 و 57 عاماً. تمت مقارنة وقوع
الطفرات بين المرضى تبعاً لزمرهم الدموية. وجد
أن نسب تواتر الطفرات الأكثر شيوعاً للمصابين بالثلاسيمية بيتا والحملة لزمرة الدم
A على الشكل
التالي: الطفرة IVS-I-110
(G→A)
بنسبة 34.3%،
تلتها IVS-I-1 (G→A) بنسبة 18%. وبالنسبة لحاملي زمرة الدم B، كانت الطفرة IVS-I-110
(G→A)
بنسبة 26.1%،
أتت بعدها IVS-I-1 (G→A) بنسبة 23.2%. أما بالنسبة لحاملي لزمرة الدم AB، فقد جاءت الطفرة IVS-I-110
(G→A)
بنسبة 50%، تلتها كلاً منCodon 39
(C→T)
و IVS-I-6
(T→C)
بنسبة 14.3%. وأخيراً كانت نسب تواتر الطفرات بالنسبة للمرضى
الحملة لزمرة الدم O كالتالي: IVS-I-110
(G→A)
بنسبة 27.4%، تلتها Codon 39 (C→T) بنسبة 17.1%. تظهر
نتائجنا مجتمعةً أن معرفة زمرة الدم الخاصة بمريض الثلاسيمية بيتا، تتيح لنا
المعرفة المبدئية في التوجه إلى اكتشاف الطفرة المُسبّبة، موفرين بذلك الوقت
والجهد والتكلفة المبذولين لمعرفتها، مما يعطي قيمةً مضافةً في مجال كشف طفرات
الثلاسيمية بيتا.
Beta-thalassemia syndrome is one of an inherited
disease, which caused by a defect in the beta-globin gene. There are more than 890 known thalassemia variants, many
of which are distributed in certain geographical regions of the world. Several
studies have identified the frequency of beta thalassemia mutations in beta
thalassemia Syrian population, without introducing any variable in the patient
case. Hence our study aimed to investigate the possibility of a correlation
between blood groups and the pattern of mutation in Syrian patients with beta
thalassemia. The study included 197 Syrian patients aged between 2
and 57 years. The incidence of mutations was compared among patients according
to their blood groups.
With blood group A, the frequency of the most frequent
mutations was found As follows:
IVS-I-110 (G → A) 34.3%, followed by IVS-I-1 (G → A)
18%. For those with blood group B, the IVS-I-110 (G → A) was 26.1%, followed by
IVS-I-1 (G → A) with 23.2%. As for the patients with blood group AB: IVS-I-110
(G → A) 50%, followed by Codon 39 (C → T) and IVS-I-6 (T → C) by 14.3%.
Finally, the frequency of mutations for patients with blood group O was:
IVS-I-110 (G → A) 27.4%, followed by Codon 39 (C → T)
17.1%.
Our combined results show that knowing the blood group
of the beta thalassemia patient provide us with initial knowledge of the trend
to detect the mutation, providing the time, effort and cost, which give us an
added value in detecting beta thalassemia mutations.
الكلمات المفتاح Key
words: ثلاسيمية بيتا Beta thalassemia، طفرة Mutation، زمرة دموية Blood
group.
المقدمة
Introduction
تعد متلازمة
الثلاسيمية بيتا أحد أمراض فقر الدم الوراثية المتباينة ومختلفة الشدة، فالكريات
الحمر فيها ناقصة الصباغ. وينجم هذا عن عيب وراثي بسبب استبدال أو حذف (كلي أو
جزئي) في مورثات سلسلة الغلوبين بيتا (1). وهنالك أكثر من 922 تبدلاً معروفاً للثلاسيمية ويتوزع العديد
منها في مناطق جغرافية معينة في العالم (2).
تتوضع الجينة
المسؤولة عن إنتاج السلسلة بيتا على الذراع القصيرة (p) من الصبغي11 في الموقع 15.5.
وعلى نحوٍ أدق، تقع هذه الجينة HBB بين الزوج أساس 5,203,271
و 5,204,876 على الصبغي 11 (3).
وينجم مرض الثلاسيمية
بيتا عن طفرات في جينة الغلوبين بيتا، حيث تؤدي معظم هذه الطفرات إلى استبدال Substitution في بنية طاق الـ DNA ضمن أو بالقرب من هذه الجينة (4).
وتقوم طفرات أخرى بإدراج أو حذف عدد قليل من النوكليوتيدات في جينة الغلوبين بيتا (4).
وتدعى حالة طفرات هذه الجينة التي تقلل من إنتاج الغلوبين بيتا بـ +β Thalassemia،
وتدعى الطفرات التي تمنع الخلايا من إنتاج الغلوبين بيتا بـ 0β Thalassemia
(4). ولا يمكن تشكيل هيموغلوبين كافٍ من دون الكميات المناسبة من
الغلوبين بيتا، كما أن نقص الهيموغلوبين يعطل التطور الطبيعي لخلايا الدم الحمر،
ويؤدي هذا النقص في خلايا الدم الحمراء الناضجة إلى منع هذه الخلايا من تقديم ما
يكفي من الأكسجين لتلبية احتياجات الطاقة في الجسم، وبالتالي فإن نقص الأكسجين في
أنسجة الجسم يمكن أن يؤدي إلى ضعف النمو وأذية عضوية وغيرها من المشاكل الصحية
المرتبطة بالثلاسيمية بيتا (5). إن تحليل الـ DNA متاح للتحقق من الحذف والطفرات في المورثات المنتجة للغلوبين بيتا
(6). تحتوي جينة الغلوبين بيتا على ثلاثة إكسونات exons و متواليتين إعتراضيتين intervening sequences (إنترونين introns) (IVS2
و IVS1)، حيث يتكون الإكسون الأول من 142 نوكليوتيد والإكسون الثاني من
223 نوكليوتيد، أما الإكسون exon الثالث فيتكون من 261 نوكليوتيد، في حين
يتألف الإنترون الأول من 130 نوكليوتيد و الإنترون الثاني من 850 نوكليوتيد (7).
بالإضافة إلى المناطق غير المترجمة(UTRs) Untranslated
regions (الشكل 1(. وتُنظّم عملية
ترجمة هذه الجينة عبر منطقة المعزاز 5' الذي يحتوي على TATA،CCAAT التقليدية والـboxes CACCC . بالإضافة إلى تواجد باقي الغلوبينات الموضحة في الشكل 1.
يتوزع مرض الثلاسيمية
بيتا في العالم بدرجات متفاوتة، وتكثر الإصابة به في دول حوض المتوسط، لذلك يطلق
عليه فقر دم البحر المتوسط أو يطلق على البلدان اسم "حزام
الثلاسيمية" Thalassemia Belt.
وصل عدد المرضى
السوريين في عام 2008 إلى 7785 مريضاً وكان عدد المرضى الجدد خلال العام نفسه 786
مريضاً (9). وتشير الإحصائيات المستمدة من مركز الثلاسيمية في دمشق إلى وجود
حوالي 1330 مريض ثلاسيمية بيتا يراجع المركز شهرياً حتى تاريخ 2018/3/1.
ولقد توزعت زمرهم الدموية كما هو مبين في الشكل
2.

الشكل 1: تمثيل توضيحي لجينة الغلوبين بيتا (a) وموقعه إلى جانب جينات الغلوبينات المتوضعة على الجينة ذاته (b) (8).

الشكل 2: توزع مرضى الثلاسيمية بيتا المراجعين لمركز
الثلاسيمية تبعاً لزمرهم الدموية.
تمت دراستان سابقتان (10،
11) قد حددتـا تواتر طفرات الثلاسيمية بيتا في المجتمع السوري، حيث كانت
الطفرة IVS-I-110
(G>A) هي الأكثر
تواتراً. تلتها الطفرة IVS-I-1 (G>A)، في حين كانت بقية الطفرات ( مثل codon 39
(C>T) و IVS-II-1
(G>A) و IVS-I-5 (G>C) و-30
(T>A) ...الخ) بتواترٍ
أقل.
هدفت
دراستنا إلى معرفة نسبة تواتر تلك الطفرات تبعاً للزمر الدموية الأكثر انتشاراً
لمرضى الثلاسيمية بيتا.
علماً أن هنالك
تشابهاً في تواتر الطفرة الأكثر شيوعاً بين المجتمع السوري والمجتمعات الأخرى مثل
لبنان والأردن وهي IVS-I-110 (G>A)
بينما حصل الاختلاف بتواتر الطفرات التالية لها حيث أتت IVS-II-1
(G>A). في المرتبة
الثانية من حيث الانتشار في الأردن بينما استمر التشابه مع لبنان من حيث تواتر
الطفرة IVS-I-1
(G>A)، أما في العراق
فقد كانت الطفرة IVS-II-1 (G>A) هي الأكثر شيوعاً ومن ثم الطفرة IVS-I-1
(G>A) وبعدها codon
8 (-AA) (12).
المواد والطرقMaterials
and Methods
الاعتيان: شملت
الدراسة 197 مريضاً سورياً تراوحت أعمارهم بين 2 و57 عاماً وكان متوسط العمر 17
عاماً. كانت شروط الاشتمال أخذ عينات من المرضى السوريين المعتمِدين على نقل الدم
بشكلٍ دوري في مركز الثلاسيمية والذين لم يجرَ لهم الفحص الجيني، كما أُخذت الموافقة
المستنيرة لإجراء الدراسة، ثم جُمعت معلومات تتعلق بالعمر والوزن والطول وزمرة
الدم ومكان الإقامة. بُزلت عينة دم وريدي (2.5 مل على مضاد تخثر الـ EDTA). وعُزل الدنا DNA لكل مريض باستخدام عتيدة جاهزة QIAamp DNA
Blood kit من شركة Qiagen الألمانية، وتم اتباع خطوات العمل وفقاً لتعليمات الشركة
المصنّعة. وجرى تعيين مردود ونقاوة الدنا المستخلص باستخدام قياس الامتصاص الضوئي
في أمواج أطوالها 260 nm و280nm،
باستخدام مقياس الطيف الضوئي Spectrophotometer، ثم جرى ترحيل الـ DNA على هلامة الأغاروز بتركيز 1%.
حُللت
عينات DNA المعزولة باستخدام نظام تضخيم الطفرة المعندة ARMS (13)،
باستعمال جهاز التفاعل السلسلي للبوليميراز PCR
(من شركة Applied Biosystems) وفق البرنامج التالي: تمسخ أولي
بحرارة 94
Cᵒ
لمدة 5 دقائق، متبوعاً بـ 25 دورة بحرارة 94 Cᵒ لمدة دقيقة واحدة، ثم حرارة 64 Cᵒ لمدة دقيقة واحدة، ثم 72 Cᵒ لمدة دقيقة واحدة ويجرى التمديد
النهائي بحرارة 72
Cᵒ لمدة 5 دقائق. جرى تصميم مشارع
primers نوعية لكل طفرة من الطفرات (13). وفُصلت منتجات التضخيم بالرحلان
على هلامة أغاروز تركيزها %2 في دارئة الرحلان مع تريس (TAE
"X1") للتأكد من وجود منتج التضخيم. حُدد حجم العصابة المفصولة
باستعمال معياري DNA 100 bp. ثم قُرئت النتائج عبر Gel Documentation System (شركة Bio-Rad).
جرى العمل بتعاون مشترك بين كلية الصيدلة ومركز الثلاسيمية وهيئة الطاقة الذرية
السورية. قمنا بتعيين نسب تواتر الطفرات الشائعة في سورية ضمن مجموعات زمر الدم (A, B, AB, O)، وتمت المقارنة بين هذه المجموعات حسب تواتر الطفرات، وقورنت
العلاقة بين متغيرات المجموعات باختبار Nonparametric
Chi-square. واعتُمدت
قيم P<0.05 للاعتداد الإحصائي للفروقات وذلك باستخدام برنامج SPSS الإصدار 22.0.
النتائج Results
يبين الجدول 1 نسب
تواتر الطفرات الأكثر شيوعاً للمصابين بالثلاسيمية بيتا والحملة لزمرة الدم A (89 مريضاً). حيث جاءت الطفرة IVS-I-110
(G→A) بنسبة 34.3%،
أتت بعدها الطفرة IVS-I-1 (G→A)
بنسبة 18%، تلتها الطفرة Codon 39 (C→T)
بنسبة 11.8%،
ثم الطفرة Codon 8 (-AA)بنسبة 11.2%،
تلتها (T→A) -30 وكانت نسبتها 9.6%
ومن ثم الطفرة IVS-II-1 (G→A) بنسبة 6.2%،
وبعدهاIVS-I-6
(T→C) نسبتها 4.5%،
وقد جاءت كل من الطفرتين IVS-I-5 (G→C) و Codon 5 (-CT)
بنسبة 2.2% لكلٍ منها.
ولقد تبين أن هذه
الفروق بنسب الطفرات يعتد بها إحصائياً (P<
0.001).
يبين الجدول 2 نسب
تواتر الطفرات الأكثر شيوعاً للمصابين بالثلاسيمية بيتا والحملة لزمرة الدم B (35 مريضاً). حيث جاءت الطفرة IVS-I-110
(G→A) بنسبة 26.1%،
أتت بعدها الطفرة IVS-I-1 (G→A)
بنسبة 23.2%، ومن ثم IVS-II-1 (G→A) بنسبة 20.3%، وبعدها الطفرة IVS-I-6 (T→C) نسبتها 8.7%، تلتها كلاً من Codon 39 (C→T) و (T→A)-30 بنسبة 5.8% ثم Codon 5 (-CT)
بنسبة 4.3% وقد جاءت كل من الطفرتين Codon 8 (-AA)
و IVS-I-5 (G→C) بنسبة 2.9% لكلٍ منها.
ولقد تبين لنا أن هذه
الفروق بنسب الطفرات يعتد به إحصائياً (P<
0.001).
كما يبين الجدول 3
نسب تواتر الطفرات الأكثر شيوعاً للمصابين بالثلاسيمية بيتا والحملة لزمرة الدم AB (14 مريضاً). حيث جاءت الطفرة IVS-I-110
(G→A) بنسبة 50%، تلتها
كلاً من Codon
39 (C→T) و IVS-I-6
(T→C)
الجدول 1 : تواتر
طفرات الثلاسيمية بيتا للمرضى الحملة للزمرة A (n=89).
|
Blood Group |
Mutation |
Allele # |
Allele % |
|
A |
IVS-I-110 (G→A) |
61 |
34.3 |
|
IVS-I-1 (G→A) |
32 |
18.0 |
|
|
IVS-II-1 (G→A) |
11 |
6.2 |
|
|
Codon 39 (C→T) |
21 |
11.8 |
|
|
IVS-I-5 (G→C) |
4 |
2.2 |
|
|
IVS-I-6 (T→C) |
8 |
4.5 |
|
|
Codon 8 (-AA) |
20 |
11.2 |
|
|
Codon 5 (-CT) |
4 |
2.2 |
|
|
-30 (T→A) |
17 |
9.6 |
|
|
Total |
178 |
100 |
الجدول 2: تواتر
طفرات الثلاسيمية بيتا للمرضى الحملة للزمرة B (n=35).
|
Blood Group |
Mutation |
Allele # |
Allele % |
|
B |
IVS-I-110 (G→A) |
18 |
26.1 |
|
IVS-I-1 (G→A) |
16 |
23.2 |
|
|
IVS-II-1 (G→A) |
14 |
20.3 |
|
|
Codon 39 (C→T) |
4 |
5.8 |
|
|
IVS-I-5 (G→C) |
2 |
2.9 |
|
|
IVS-I-6 (T→C) |
6 |
8.7 |
|
|
Codon 8 (-AA) |
2 |
2.9 |
|
|
Codon 5 (-CT) |
3 |
4.3 |
|
|
-30 (T→A) |
4 |
5.8 |
|
|
Total |
69 |
100 |
الجدول 3: تواتر
طفرات الثلاسيمية بيتا للمرضى الحملة للزمرة AB (n=14).
|
Blood Group |
Mutation |
Allele # |
Allele % |
|
AB |
IVS-I-110 (G→A) |
14 |
50.0 |
|
IVS-I-1 (G→A) |
2 |
7.1 |
|
|
IVS-II-1 (G→A) |
1 |
3.6 |
|
|
Codon 39 (C→T) |
4 |
14.3 |
|
|
IVS-I-5 (G→C) |
0 |
0.0 |
|
|
IVS-I-6 (T→C) |
4 |
14.3 |
|
|
Codon 8 (-AA) |
1 |
3.6 |
|
|
Codon 5 (-CT) |
0 |
0.0 |
|
|
-30 (T→A) |
2 |
7.1 |
|
|
Total |
28 |
100 |
بنسبة 14.3%، ومن ثم IVS-I-1
(G→A) و (T→A)-30 بنسبة 7.1%، وأتت كل من الطفرتين IVS-II-1
(G→A) و Codon
8 (-AA) بأقل نسبة وهي
3.6%. في حين لم نجد أياً من الطفرات IVS-I-5 (G→C) و Codon 5 (-CT)
لدى المرضى الحملة لزمرة الدم هذه. كما تبين لنا أن هذه الفروق بنسب الطفرات يعتد
به إحصائياً (P<
0.001). ويظهر الجدول 4 نسب تواتر الطفرات الأكثر شيوعاً
للمصابين بالثلاسيمية بيتا والحملة لزمرة الدم O
(59 مريضاً). حيث جاءت الطفرة IVS-I-110 (G→A) بنسبة 27.4%، تلتها Codon 39 (C→T) بنسبة 17.1%، ومن ثم جاءت الطفرة IVS-I-1 (G→A) بنسبة 15.4%، وأتت الطفرة Codon 5 (-CT) بنسبة 9.4%، ومن ثم كل من الطفرتين IVS-I-6 (T→C) و Codon 8 (-AA)
بنسبة
6.8%، وأتت كل من الطفرتين IVS-II-1 (G→A) و (T→A)-30 بنسبةٍ وهي 6%. في حين كانت نسبة الطفرة IVS-I-5 (G→C) هي 5.1%. ولقد تبين لنا أن هذه الفروق بنسب الطفرات يعتد به
إحصائياً (P< 0.001).
الجدول 4 : تواتر
طفرات الثلاسيمية بيتا للمرضى الحملة للزمرة O (n=59).
|
Blood Group |
Mutation |
Allele # |
Allele % |
|
O |
IVS-I-110
(G→A) |
32 |
27.4 |
|
IVS-I-1
(G→A) |
18 |
15.4 |
|
|
IVS-II-1
(G→A) |
7 |
6.0 |
|
|
Codon
39 (C→T) |
20 |
17.1 |
|
|
IVS-I-5
(G→C) |
6 |
5.1 |
|
|
IVS-I-6
(T→C) |
8 |
6.8 |
|
|
Codon
8 (-AA) |
8 |
6.8 |
|
|
Codon
5 (-CT) |
11 |
9.4 |
|
|
-30
(T→A) |
7 |
6.0 |
|
|
Total |
117 |
100 |
المناقشة Discussion
من المثير للاهتمام
ظهور اختلاف تواتر الطفرات بحسب الزمرة الدموية، رغم أن الطفرة IVS-I-110
(G→A) كانت هي السائدة بين
جميع الطفرات لكل زمر المرضى، كون هذه الطفرة هي الأكثر شيوعاً ضمن المجتمع السوري
(10،11)، إلا أنه تبين لنا وجود IVS-I-1(G→A) في المرتبة الثانية، من حيث نسبة انتشارها بالنسبة للزمرتين A و B بالنسب 18% و 23.2%، على الترتيب،
وتوافق هذا مع الدراستين السابقتين على مرضى سوريين (10،11)
من حيث الترتيب، في حين كانت الطفرة Codon 39 (C→T) هي الأكثر شيوعاُ بعد الطفرة IVS-I-110
(G→A) لدى المرضى أصحاب الزمر AB و O
بالنسب 14.3% و 17.1%، على الترتيب، وهذا لم يتوافق مع الدراستين (10،11) من حيث
الترتيب، علماً أن الطفرة IVS-I-6 (T→C) قد تساوت في نسبة انتشارها مع Codon 39
(C→T) بالنسبة للزمرة AB، وهنا بدأ الاختلاف من حيث ترتيب الانتشار وتأثير نوع زمرة الدم
على ترتيب تواتر الطفرات.
ولقد احتلت الطفرة Codon
39 (C→T) المرتبة الثالثة
من حيث الانتشار بالنسبة لأصحاب زمرة الدم A، حيث كانت نسبتها 11.8%،
وتوافق هذا مع الدراسة (11) ولم يتوافق مع الدراسة (10)، في حين جاءت الطفرة IVS-II-1
(G→A) لدى أصحاب الزمرة
B بنسبة 20.3%
وIVS-I-1
(G→A) لأصحاب الزمر AB و O
بالنسب 7.1% و 15.4%، على الترتيب، مع العلم أيضاً بأن الطفرة (T→A)-30 قد تساوت في نسبة انتشارها مع IVS-I-1
(G→A) لدى المرضى ذوي الزمرة
AB، وهذا أيضاً لم يتوافق مع الدراستين(10،11) من حيث نسبة التواتر.
وبعدها كانت الطفرة Codon
8 (-AA) لدى حاملي زمرة الدم A في المرتبة الرابعة من حيث الانتشار بنسبة 11.2%،
والطفرة IVS-I-6
(T→C) لدى حاملي زمرة الدم B بنسبة 8.7%،
وكلاً من الطفرتين IVS-II-1 (G→A)
و Codon 8 (-AA)
لدى حاملي زمرة الدم AB بنسبة 3.6%،
أما عند حاملي زمرة الدم O فجاءت الطفرة Codon 5 (-CT) بنسبة 9.4%،
وهذا لم يتوافق مع الدراستين (10،11). ثم كانت الطفرة (T→A)-30 في المرتبة الخامسة لدى حاملي الزمر A و B
بالنسبتين 9.6% و 5.8%، على الترتيب، وقد شاركتها نفس نسبة الانتشار
(5.8%) الطفرة Codon
39 (C→T) عند
حاملي الزمرة B فقط وهذا يتوافق مع الدراسة (10)، ولم يكن هنالك أي طفرات أخرى من
الطفرات المدروسة لدى حاملي الزمرة AB، وأتت كل من الطفرتين IVS-I-6
(T→C) و Codon 8 (-AA) بنسبة الانتشار نفسها (6.8%) ضمن هذه المرتبة لدى المرضى الحملة لزمرة
الدم O،
وهذا أيضاً يتوافق مع الدراسة(11). ثم جاءت بالدرجة السادسة من حيث التواتر الطفرة
IVS-II-1 (G→A) بالنسبة للزمرة A (6.2%) وهذا توافق مع الدراسة(10) ولم يتوافق مع الدراسة (11)، و
الطفرة Codon 5 (-CT) بالنسبة للزمرة B (4.3%)، وكلاً من IVS-II-1 (G→A) و (T→A)-30 بالنسبة للزمرة O بنسبة (6%)، وهو لم يتوافق مع كلتا الدراستين(10،11).
وبعدها
جاءت الطفرة IVS-I-6 (T→C) بالنسبة لحاملي الزمرة A (4.5%) وكلاً من IVS-I-5 (G→C) و Codon 8 (-AA) بالنسبة للزمرة B (2.9%) وفقط الطفرة IVS-I-5 (G→C) بالنسبة للزمرة O (5.1%). وأخيراً جاءت كل من الطفرتين IVS-I-5
(G→C) و Codon 5 (-CT) بالنسبة للمرضى الحملة للزمرة A (2.2%). وهذا أيضاً لم يتوافق مع كلتا الدراستين (10، 11). وتفسر
النتائج السابقة باختلاف ترتيب الطفرات من حيث التواتر بسبب علاقتها باختلاف الزمر
الدموية للمرضى الحملة لتلك الطفرات، ومنه لا يمكن تعميم انتشار الطفرات نسبةً
لحدوثها فقط، إنما يجب علينا أن نكون أكثر دقة في تحديدها تبعاً
لعدة متغيرات تابعة للمريض نفسه ومنها الزمرة الدموية.
وكاستنتاج،
إن هذه الدراسة هي لإغناء قاعدة البيانات لمرضى الثلاسيمية بيتا في سورية، ومن
الممكن مستقبلاً الحصول على علاقة هذه الطفرات بمتغيراتٍ أخرى تساعد في ذلك
الإغناء من خلال بعض الواصمات الأساسية البسيطة.
المراجع References
1-Origa R; Adam MP; Ardinger HH. and Pagon RA. et al.
Beta-Thalassemia.
GeneReviews® [Internet]. Seattle (WA): University of Washington, Seattle, 25/1/2018.
2-http://globin.bx.psu.edu/hbvar/menu.html December 18, 2018.
3-Toufexis M; Lewin AB; Storch EA; DeOleo C.
and Murphy TK.
A Possible
Link Between Tic Disorders Associated with Beta Thalassemia Minor and Sickle
Cell Disease.
J Clin Case Rep; 3: 244, 2013.
4-Thein SL.
The molecular
basis of β-thalassemia.
Cold Spring Harbor perspectives in medicine. 3(5), a011700, 2013.
5-http://ghr.nlm.nih.gov/gene/HBB December. 18, 2018.
6-Mahdieh N. and Rabbani B.
An overview of
mutation detection methods in genetic disorders.
Iranian
journal of pediatrics; 23(4),
375-88, 2013.
7-Gaeke V.
A
Database-Driven Website of β-Thalassemia Mutations.
SJSU; 287, 2012.
8-Lahiry P; Al-Attar SA. and Hegele RA.
Understanding
Beta-Thalassemia with Focus on the Indian Subcontinent and the Middle East.
Open Hematol J; 2: 5-13, 2008.
9-Al-Zir KN.
Prevention of
hemoglobinopathies in Syria.
Hemoglobin; 33(S1): S25-27, 2009.
10-Kyriacou K; Al Quobaili F; Pavlou E; Christopoulos G; Ioannou P.
and Kleanthous M.
Molecular
Characterization of beta-thalassemia in Syria.
Hemoglobin, 24(1), 1-13, 2000.
11-Murad H; Moasses
F; Dabboul A; Mukhalalaty Y;
Bakoor AO; Al-Achkar W. and
Jarjour RA.
Geographical
distribution of β-globin gene mutations in Syria.
Hematology, 1-8, 2018.
12-De Sanctis V.
β-thalassemia
distribution in the old world: a historical standpoint of an ancient disease.
Mediterranean Journal of Hematology and Infectious Diseases. 9(1), e2017018, 2017.
13-Atanasovska B; Bozhinovski
G; Plaseska-Karanfilska D. and Chakalova L.
Efficient Detection of Mediterranean β-Thalassemia Mutations by Multiplex Single-Nucleotide Primer Extension.
PLoS ONE, 7(10): e48167,
2012.