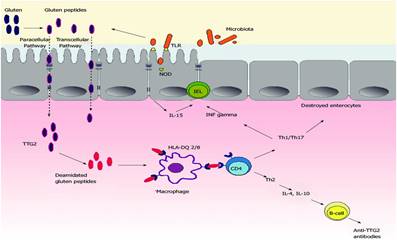
7- IL 15: يلعب IL-15 دوراً هاماً في المحافظة على وظيفة أنواع متعددة من الخلايا، وعلى
الرغم أن التعبير عن IL-15 يتم ضبطه بدقة، إلا أنه تم تسجيل زيادة إنتاج IL-15 في العديد من الأنسجة الخلوية أو الأعضاء التي تستهدف من قبل
أمراض المناعة الذاتية مثل التهاب المفاصل الرثياني، الداء الزلاقي، التصلب
اللويحي المتعدد. كما تعتبر الاضطرابات الالتهابية المعوية الحاصلة بسبب التعرض
للغلوتين وزيادة التعبير عن IL-15 في المخاطية المعوية هي السمة المميزة للداء
الزلاقي حيث أن IL-15 يعمل على أنواع مختلفة من الخلايا كما يؤثر
على العديد من المكونات والسبل المناعية لتعطيل الاستتباب المناعي المعوي (10).
اقترحت
عدة آليات تشرح دور IL-15 في اضطرابات المناعة الذاتية وتتضمن هذه
الآليات تحفيز بقاء خلايا الذاكرة CD8+ T Cell بما فيها الخلايا التائية ذاتية التفاعل،
وتفعيلها مع إفراز السيتوكينات الالتهابية الإضافية من قبل الخلايا المجاورة،
وتفعيل الخلايا البائية، إضافة لتفعيل مستقبلات الخلايا القاتلة الطبيعية على
الخلايا التائية CD8+ و CD4+ (32).
التشخيص Diagnosis
تختلف
الموجودات المخبرية في الداء الزلاقي وكذلك الأعراض والعلامات باختلاف شدة الإصابة
وامتدادها، وتبقى الاختبارات الجينية أكثر الفحوص دقة، بينما تكون الفحوصات
المصلية وخزعات الأمعاء الدقيقة هي الأكثر شيوعاً. قد يكون فحص البراز،
والاختبارات الكيمياوية والدموية، والدراسات الشعاعية غير طبيعية لكنها غير نوعية؛
لأن الاضطرابات نفسها تشاهد غالباً في الأمراض الأخرى المسببة لسوء الامتصاص.
1- فحص البراز: إذا
كان سوء الامتصاص كافياً لحدوث إسهال دهني فإن البراز يكون مائياً أو كتلياً، فاتح
اللون أو مائلاً إلى الرمادي، لماعاً، ذو رائحة كريهة. ويجري التقييم المجهري
لمحتوى البراز من الدسم بعد التلوين بالسودان sudan III و IV الذي
يساعد في التشخيص (46).
2- الاختبارات الدموية والكيميائية الحيوية: يمكن أن نجد العديد من الاضطرابات الدموية والكيميائية الحيوية
في المصابين بالداء الزلاقي غير المعالج، متضمنة نقص الحديد وحمض الفوليك
وڤيتامين D. وتعكس هذه الاضطرابات حالة العوز الغذائي التالي لسوء الامتصاص
الناجم عن اعتلال الأمعاء.
كما يمكن
أن يظهر فيلم الدم المحيطي الخلايا الهدفية وأجسام هينز، أو أجسام هول جولي
الناجمة عن الضمور الطحالي.
على
الرغم من أن هذه الاختبارات مهمة في تقييم المرضى وتدبيرهم فإنها تفتقر إلى
الحساسية والنوعية الكافية لاستخدامها وسيلة تشخيصية.
3- اختبار امتصاص الكزيلوز-D: قد يكون
هذا الاختبار مضطرباً في الداء الزلاقي غير المعالج ولكنه أيضاً لا يعطي تشخيصاً
نوعياً ولم يعد له مكان في الاختبارات الروتينية للداء الزلاقي. بالإضافة إلى ذلك
فإن امتصاص D-xylose واطراحه يمكن أن يكون طبيعياً في 20% من
المصابين غير المعالجين (47).
4- أضداد ضد الغليادين Anti-gliadin
antibody (AGA)
إن أضداد
الغليادين AGA (IgA وIgG) موجهة
ضد جزء
الغليادين في بروتين القمح والبروتين الموجود في الشيلم والشعير. إن حساسية ودقة
اختبارات أضداد الغليادين تتراوح بين 80% و90% مع قيمة تنبؤية إيجابية أقل من 30%.
تكون هذه الأضداد إيجابية في حالات أخرى مثل التهاب المريء والتهاب المعدة
والالتهابات المعوية المعدية وداء الأمعاء الالتهابي والتليف الكيسي وعدم تحمل
بروتين حليب البقر (48).
5- أضداد غمد الليف العضلي
Endomysial antibody EMA-IgA
تتمتع
اختبارات أضداد غمد الليف العضلي بحساسية أكبر ودقة أكثر من اختبارات أضداد
الغليادين. إن اختبار أضداد غمد الليف العضلي موجه ضد الترانس غلوتاميناز 2
الموجود خارج الخلايا، ويُكتشف بواسطة اختبار التألق المناعي الذي يستخدم إما
الحبل السري البشري أو مريء القرد كركيزة نسيجية. ميزة اختبار EMA-IgA أنه يتمتع بالحساسية والدقة معاً (49).
تكشف الدراسات أن نسبة حساسية اختبار EMA-lgA لدى الأطفال تتراوح بين 83% و 100% بأغلبية
>90% وتبلغ نسبة الدقة 95-100% بأغلبية >95%. تكمن مساوئ الاختبار بكونه
مكلف أكثر ويتطلب إجراؤه وقتا أطول، كما أن الاختبار معرض لنتائج سلبية وإيجابية كاذبة
(50).
6- أضداد ناقلة الغلوتامين
النسيجية
Tissue transglutaminase antibodies Ttg-IgA
إن إنزيم
ناقلة الغلوتامين النسيجية (وبالتحديد Ttg 2) هي
المستضد الذاتي في الداء الزلاقي الذي أدى إلى تطور اختبارات أضداد Ttg. يتم إجراء الاختبار عادة بواسطة مقايسة الممتز المناعي المرتبط
بالإنزيم ELISA. ولكن يمكن إجراؤه أيضا بواسطة المقايسة
المناعية الشعاعية (RIA). تتمتع Ttg-lgA بحساسية ودقة جيدين وتبين بأنها تتمتع بحساسية أكبر من EMA-lgA، في حين أن الدقة مشابهة لتلك في EMA-lgA. من المزايا الإضافية للـ Ttg على الـ EMA قلة تكلفةTtg (51). من المحتمل أن تترافق مستويات عالية من Ttg-lgA مع ضمور زغابي أكثر من المستويات المنخفضة أو الحدية. يمكن
استخدام اختبار Ttg-lgG للتحري عن الداء الزلاقي في المرضى المعروف
عنهم افتقارهم لـلـ lgA. إن حساسية الاختبار المعتمد على lgG تكون أدنى من تلك في الاختبار المعتمد على lgA، مع تقديرات بحوالي 45% وتتراوح بنسبة قليلة تبلغ 12.6%. على كل
حال يظهر في الأفراد الذين يعانون من عوز lgA دليل بأن أداء Ttg-lgG يكون جيداً وذو حساسية ودقة عاليتين (52).
7- أضداد ببتيد الغليادين
المنزوع الأمين
Deaminated Gliadin
Peptide Antibodies DGP:
إن
الأضداد الموجهة ضد DGP هي الاختبار المصلي الأكثر تطوراً حالياً
للداء الزلاقي. DGPs هي ببتيدات صنعية مصممة لتحاكي تأثير Ttg على ببتيدات الغليادين في الجسم. تخضع ببتيدات الغليادين في الداء
الزلاقي لعملية نزع مُحدثة بـ Ttg، في حين يتم تحويل جزيئات معينة من الغلوتامين
إلى حمض الغلوتاميك (52). تزيد هذه العملية الشحنة السلبية للببتيد والذي يحفز
بدوره قبط وارتباط الببتيد بالخلايا المقدمة للمستضد وهي مرحلة حساسة في الإمراض
المناعي للداء الزلاقي. إن حساسية ودقة DGPs عادة ما تكون أفضل من تلك في اختبارات AGA
الأصلية كما أن الفروقات أقل. إضافة إلى ذلك، تظهر الدراسات بأن DGP-lgG ذو دقة متوافقة مع تلك في EMA-lgG ومن سلبيات DGPs أنها أقل حساسية من اختبارات Ttg-lgA أو EMA-lgA (53).
8- اختبار أضداد ضد
الريتيكولين
Anti-Reticulin
antibody
إن هذا
الاختبار لا يتمتع بذات حساسية ودقة الأضداد الذاتية الأخرى. يتواجد لدى حوالي 60%
من الناس المصابين بالداء الزلاقي وحوالي 25% من أولئك المصابين بالتهاب الجلد
الهربسي الشكل ومن النادر طلب إجراؤه
(54).
9- أضداد الاكتين الخيطي Anti-F-actin
هي المكون الأساسي لما سمّي بأضداد العضلة الملساء
(ASMA).
تعد هذه الأضداد نوعية تجاه مكوِّن الأكتين الخيطي لهيكل الخلية. قد يساعد وجود
أضداد الأكتين الخيطي lgA لدى المرضى المشخصين سريرياً بالداء الزلاقي
في تقدير احتمالية وجود ضمور زغابي معوي خطير (55).
يبين
الجدول 1 حساسية ونوعية بعض الطرق المصلية المستخدمة في تشخيص الداء الزلاقي.
الجدول 1: حساسية ونوعية بعض الطرق المصلية
المستخدمة في تشخيص الداء الزلاقي
|
Specificity %
|
Sensitivity %
(Reported Range)
|
Test
|
|
90 (47-94)
|
85 (57-100)
|
AGA-Ig
A
|
|
80 (50-94)
|
85 (42-100)
|
AGA-Ig G
|
|
99 (94.7-100)
|
95 (82.6-100)
|
EMA-Ig A
|
|
98 (78-100)
|
98 (73.9-100)
|
tTG-IgA
|
|
95 (86.3-100)
|
70 (12.6-99.3)
|
tTG-IgA
|
|
95
(90-99)
|
88 (74-100)
|
DGP-IgA
|
|
98 (90-99)
|
80 (63-95)
|
DGP-IgG
|
10- البروتين REG Iα:
تلعب بروتينات REG ((Regenerating Gene
دوراً مهماً في تكاثر خلايا الكبد، البنكرياس، المعدة
والأمعاء ومن ضمن بروتينات هذه العائلة هنالك البروتين REG Iα الذي تمت دراسته كمستضد ذاتي
وعامل نمو في العديد من الأمراض المناعية الذاتية مثل الداء السكري من النمط الأول
والداء الزلاقي (56).
ولقد وجدت الدراسات أن مستويات هذا البروتين ترتفع عند
بداية الإصابة بالداء الزلاقي بسرعة قبل إنتاج الأضداد الذاتية النوعية، وتنخفض
هذه المستويات عند الالتزام بحمية خالية من الغلوتين ويترافق ذلك مع انخفاض أضداد
ناقلة الغلوتامين النسيجية، كما يعد بروتين REG Iα منظم للنمو الخلوي الضروري لتوليد
والمحافظة على بنية الزغابات المعوية كما أن مستوياته في المصل تعكس شفاء الغشاء
المخاطي في الأمعاء.
وبالتالي يمكن
أن يستخدم هذا البروتين كواسم حيوي جديد في تأكيد التشخيص بخاصة عند المرضى الذين
لديهم مستويات منخفضة أو عدم قدرة على اصطناع Ig A وتقييم ومطاوعة الحمية الخالية من
الغلوتين (56).
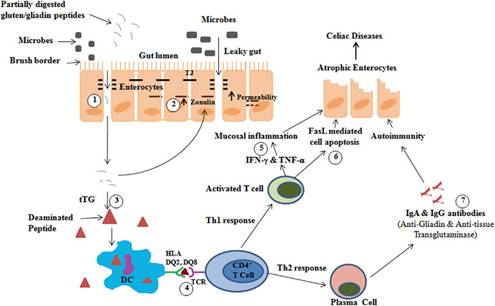
11- البروتين HMGB1 (High mobility group box 1)
هو بروتين نووي عصاري خلوي Cytosolic واسع الانتشار واسم للالتهاب
ويعزز الاستجابة المناعية الفورية للضرر النسيجي كما أنه يلعب دور إشارة اختطار
ينظم الاستجابة الدفاعية في الأنسجة الهدف (57).
عند الإصابة بالداء الزلاقي تقوم الخلايا المتضررة
بتحرير HMGB1 الذي يقوم بدوره
بالارتباط بالمستقبلات الشبيهة بالتول 4 و 2 Toll-like receptor ومستقبل المنتجات
النهائية للغلكزة المتقدمة receptor
for advanced glycation end-products ويؤدي ذلك إلى تفعيل السيتوكينات الداعمة للالتهاب (IL-1;IL-6;IL-8)، زيادة لصوقية المطرس الخلوي، تغيير نفاذية
الأمعاء وزيادة التهاب المخاطية (58).
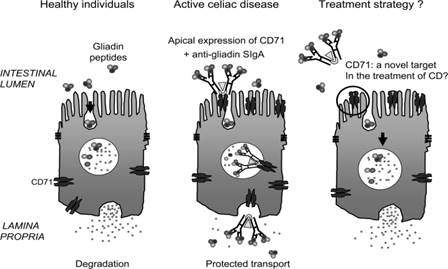
12-
ببتيدات الغلوتين المستمنعة:
تتفاعل بعض ببتيدات الغلوتين المقاومة لعملية الهضم
المعدية المعوية مع الجهاز المناعي لمرضى الداء الزلاقي، وتحرض الاستجابة المناعية
ضد ناقلة الغلوتامين والمستضدات الأخرى. يتم لاحقاً امتصاص جزء من هذه الببتيدات
في السبيل المعدي المعوي ويتم إطراحها لاحقاً في البول أو البراز، حيث يتم التحري
عن هذه الببتيدات باستخدام تقنية الاستشراب المناعي وباستخدام الأضداد وحيدة
النسيلة ضد α-gliadin (59-60).
وجدت الدراسات أن هنالك علاقة بين مستويات ببتيدات
الغلوتين وشفاء مخاطية الأمعاء أو الضرر في بطانية الأمعاء، كما وجدت الدراسات أن
التحري عن GIP يفيد في تقييم فعالية
الأدوية التجريبية للداء الزلاقي والالتزام بالحمية الخالية من الغلوتين قبل أي
ضرر نسيجي (61).
13- اختبار HLA: تكمن أهمية هذا الاختبار في نفي الإصابة بالداء الزلاقي حيث أن غياب
النمط الجيني له قيمة تنبؤيه سلبية تزيد على 99%، حيث ستستبعد النتيجة السلبية
اختطار الإصابة بمرض الداء الزلاقي. هذا الاختبار هو الأكثر استخداماً عند الأطفال
المعرضين للاختصار لتفادي الحاجة إلى إجراء الاختبارات المصلية بشكل دوري (62).
نقوم
بإجراء اختبار HLA في الحالات التالية:
• لدى
المرضى الذين تكون لديهم نتائج مصلية أو نسيجية مختلفة.
• المرضى
الذين يُشك بمعاناتهم من مرض الداء الزلاقي العنيد حيث يبقى التشخيص الأصلي لمرض
الداء الزلاقي موضع تساؤل
• يتم
إجراء تنميط HLA في بعض الأحيان لدى المرضى المعرضين لاختطار كبير
للإصابة بمرض الداء الزلاقي (على سبيل المثال، وجود تاريخ عائلي من مرض الداء
الزلاقي) (63).
14- HLA-DQ غلوتين تيترامير: هو اختبار جديد لـِ HLA-DQ معتمد على التيترامير والذي يتحرى الخلايا التائية الخاصة بالغلوتين
في الدم. ومن الممكن تحديد المرضى الذين يعانون من مرض الداء الزلاقي، بغض النظر
عما إذا كان الاختبار يتم على نظام غذائي خال من الغلوتين. وفي حين أظهر الاختبار
درجة عالية من الدقة في عدد من الدراسات، إلا أن النتائج تتطلب التحقق قبل أن تكون
قابلة للاستخدام سريرياً (64).
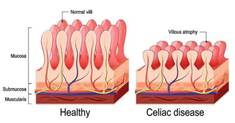
15- الخزعة المعوية: يمكن الحصول على الخزعات عن طريق التنظير، ويجب أخذ عدة خزعات من
العفج القاصي (الجزء الثاني أو الثالث) لتجنب تشوه البناء الهندسي للمخاطية الناجم
عن وجود غدد برونر، ولتجنب التغيرات المسببة بالتهاب العفج القرحي (65).
وحالياً
تستخدم تقنية التنظير الداخلي باستخدام المحفظة، حيث يمكن أن يُظهر التنظير
الداخلي الغشاء المخاطي للأمعاء الدقيقة، إلا أنه يجب ألا يُستخدم للتشخيص الأولي
باستثناء المرضى الذين لديهم اختبارات مصلية إيجابية خاصة بمرض الداء الزلاقي
والذين يكونون غير راغبين أو غير قادرين
على
الخضوع للتنظير العلوي مع أخذ خزعة (66).
أخيراً
يمكن لمجموعة من الاضطرابات الهضمية الأخرى ذات الأعراض والتشريح المرضي المماثل
محاكاة الداء الزلاقي وينبغي النظر فيها من حيث التشخيص التفريقي، لذلك ينبغي
إجراء التشخيص التفريقي وإجراء تحري مفصل باستخدام نهج مختلف في التشخيص يعتمد على
التحاليل النوعية للداء الزلاقي، خاصة أن هذا المرض يعد عبئاً اقتصادياً
واجتماعياً هاماً وهو يتظاهر بأعراض هضمية أو غير هضمية وقد لا يتظاهر بأي نوع من
الأعراض ويبقى صامتاً أو كامنأ لسنوات طويلة ، وينبغي التحري عن الداء الزلاقي
وتشخصيه لا لتحسين الحالة العامة للمريض فقط وإنما للوقاية من اختلاطات هذا الداء
على المدى البعيد خاصة أن إصابة أحد الأفراد من الأسرة هو عاملٌ إنذاريٌ يثير
الهلع لدى باقي أفراد الأسرة.
المراجع References:
1. Adams
F.
The extant works of Aretaeus the Cappadocian;
London Sydenham Society; 1856.
2. Booth
C.
History of coeliac
disease.
BMJ; 298 (6672): 527; 1998.
3. Haas
SV.
Celiac disease; its
specific treatment and cure without nutritional relapse.
JAMA; 99: 448; 1932.
4. Dicke WK.
Simple dietary treatment
for the syndrome of Ghee Herter.
Ned. Tijdschr
Geneeskd; 85: 1715; 1941.
5. Rubio-Tapia
A. and Murray JA.
Celiac disease.
Curr Opin Gastroenterol. 26:
116-122; 2010.
6. Fasano
A.
Clinical presentation of
celiac disease in the pediatric population.
Gastroenterology. 128: S68-S73; 2005.
7. Green
PH. and Cellier C.
Celiac disease.
N Engl
J Med. 357:
1731-1743; 2007.
8. Peter
R. Shewry ASTDDK
Cereal proteins and
coeliac disease.
In: Michael N Marsh.; editor.
Coeliac Disease. Oxford: Blackwell Scientific Publications; 305-348; 1992.
9. Kagnoff MF.
Celiac disease. A
gastrointestinal disease with environmental; genetic; and immunologic
components.
Gastroenterol Clin North
Am; 21: 405;
1992.
10. Schuppan D.
Current concepts of celiac
disease pathogenesis.
Gastroenterology; 119: 234; 2000.
11. Petronzelli F; Bonamico M; Ferrante P. et al.
Genetic contribution of
the HLA region to the familial clustering of coeliac disease.
Ann Hum Genet; 61: 307; 1997.
12. Houlston RS; Tomlinson IP; Ford D. et al.
Linkage analysis of
candidate regions for coeliac disease genes.
Hum Mol Genet; 6: 1335; 1997.
13. Greco
L; Corazza G; Babron MC. et
al.
Genome search in celiac
disease.
Am J Hum Genet, 1; 62: 669; 1998.
14. Kaukinen K; Partanen J; Mäki M. and Collin P.
HLA-DQ typing in the
diagnosis of celiac disease.
Am J Gastroenterol; 97: 695; 2002.
15. Al-Toma
A; Goerres MS; Meijer JW. et al.
Human leukocyte
antigen-DQ2 homozygosity and the development of refractory celiac disease and
enteropathy-associated T-cell lymphoma.
Clin Gastroenterol Hepatol; 4: 315; 2006.
16. Pietzak MM; Schofield TC; McGinniss MJ. and Nakamura
RM.
Stratifying risk for
celiac disease in a large
at-risk United States
population by using HLA alleles.
Clin Gastroenterol Hepatol; 7: 966; 2009.
17. Liu E;
Lee HS; Aronsson CA. et al.
Risk of pediatric celiac
disease according to HLA haplotype and country.
N Engl
J Med; 371:
42; 2014.
18. Romanos J; van Diemen CC; Nolte IM. et al.
Analysis of HLA and
non-HLA alleles can identify individuals at high risk for celiac disease.
Gastroenterology; 137: 834; 2009.
19. Trynka G; Zhernakova A; Romanos
J. et al.
Coeliac disease-associated
risk variants in TNFAIP3 and REL implicate altered NF-kappaB
signalling.
Gut; 58: 1078; 2009
20. Hunt
KA; Zhernakova A; Turner G. et al.
Newly identified genetic
risk variants for celiac disease related to the immune response.
Nat Genet; 40: 395; 2008.
21. Pittschieler K. and Ladinser B.
Coeliac disease: screened
by a new strategy.
Acta Paediatr
Suppl; 412:
42; 1996.
22. Dieterich
W; Ehnis T; Bauer M. et al.
Identification of tissue
transglutaminase as the autoantigen of celiac disease.
Nat Med; 3: 797; 1997.
23. Dieterich
W; Laag E; Schöpper H. et
al.
Autoantibodies to tissue
transglutaminase as predictors of celiac disease.
Gastroenterology; 115: 1317; 1998.
24. Sulkanen S; Halttunen T; Laurila
K. et al.
Tissue transglutaminase
autoantibody enzyme-linked immunosorbent assay in detecting celiac disease.
Gastroenterology; 115: 1322; 1998.
25. Volta
U; Granito A; Parisi C. et
al.
Deamidated gliadin peptide
antibodies as a routine test for celiac disease: a prospective analysis.
J Clin Gastroenterol; 44: 186; 2010.
26. Molberg O; Mcadam SN; Körner
R. et al.
Tissue transglutaminase
selectively modifies gliadin peptides that are recognized by gut-derived T
cells in celiac disease.
Nat Med; 4: 713; 1998.
27. Schuppan D; Dieterich W. and Riecken EO.
Exposing gliadin as a
tasty food for lymphocytes.
Nat Med; 4: 666; 1998.
28. van
de Wal Y; Kooy Y; van Veelen
P. et al.
Selective deamidation by
tissue transglutaminase strongly enhances gliadin-specific T cell reactivity.
J Immunol; 161: 1585; 1998.
29. Anderson
RP; Degano P; Godkin AJ. et
al.
In vivo antigen challenge
in celiac disease identifies a single transglutaminase-modified peptide as the
dominant A-gliadin T-cell epitope.
Nat Med; 6: 337; 2000.
30. Vader
W; Kooy Y; Van Veelen P. et
al.
The gluten response in
children with celiac disease is directed toward multiple gliadin and glutenin
peptides.
Gastroenterology; 122: 1729; 2002.
31. Arentz-Hansen H; McAdam SN; Molberg. et al.
Celiac lesion T cells
recognize epitopes that cluster in regions of gliadins rich in proline
residues.
Gastroenterology; 123: 803; 2002.
32. Maiuri L; Ciacci C; Ricciardelli
I. et al.
Association between innate
response to gliadin and activation of pathogenic T cells in coeliac disease.
Lancet; 362: 30; 2003.
33. Schuppan D; Esslinger B. and Dieterich W.
Innate immunity and
coeliac disease. Lancet; 362: 3; 2003
34. Jabri
B; Kasarda DD. and Green PH.
Innate and adaptive
immunity: the yin and yang of celiac disease.
Immunol Rev; 206: 219; 2005.
35. Londei M; Ciacci C; Ricciardelli
I. et al.
Gliadin as a stimulator of
innate responses in celiac disease.
Mol Immunol; 42: 913; 2005.
36. Nikulina M; Habich C; Flohé
SB. et al.
Wheat gluten causes
dendritic cell maturation and chemokine secretion.
J Immunol; 173: 1925; 2004.
37. Palová-Jelínková L; Rozková D; Pecharová B. et al.
Gliadin fragments induce
phenotypic and functional maturation of human dendritic cells.
J Immunol; 175: 7038; 2005.
38. Cinova J; Palová-Jelínková L; Smythies
LE. et al.
Gliadin peptides activate
blood monocytes from patients with celiac disease.
J Clin Immunol; 27: 201; 2007.
39. Halttunen T. and Mäki M.
Serum immunoglobulin A
from patients with celiac disease inhibits human T84 intestinal crypt
epithelial cell differentiation.
Gastroenterology; 116: 566; 1999.
40. Esposito
C; Paparo F; Caputo I. et al.
Anti-tissue
transglutaminase antibodies from coeliac patients inhibit transglutaminase
activity both in vitro and in situ.
Gut; 51: 177; 2002.
41. Dieterich
W; Trapp D; Esslinger B. et al.
Autoantibodies of patients
with coeliac disease are insufficient to block tissue transglutaminase
activity.
Gut; 52: 1562; 2003.
42. Esposito
C; Paparo F; Caputo I. et al.
Expression and enzymatic
activity of small intestinal tissue transglutaminase in celiac disease.
Am J Gastroenterol; 98: 1813; 2003
43. Forsberg
G; Hernell O; Melgar S. et
al.
Paradoxical coexpression of proinflammatory and down-regulatory
cytokines in intestinal T cells in childhood celiac disease.
Gastroenterology; 123: 667; 2002.
44. Brown
I; Mino-Kenudson M; Deshpande V. and Lauwers GY.
Intraepithelial
lymphocytosis in architecturally preserved proximal small intestinal mucosa: an
increasing diagnostic problem with a wide differential diagnosis.
Arch Pathol
Lab Med; 130:
1020; 2006.
45. Lammers
KM; Lu R; Brownley J. et al.
Gliadin induces an
increase in intestinal permeability and zonulin
release by binding to the chemokine receptor CXCR3.
Gastroenterology; 135: 194; 2008.
46. Khouri
MR; Huang G. and Shiau YF.
Sudan stain of fecal fat: new
insight into an old test.
Gastroenterology. 96: 421-427; 1989.
47. Rolles CJ; Nutter S; Kendall MJ. and Anderson CM.
One-hour blood-xylose
screening-test for coeliac disease in infants and young children.
Lancet. 2(7837): 1043-1045; 1973.
48. Leffler
DA. and Schuppan D.
Update on serologic
testing in celiac disease.
Am J Gastroenterol. 105: 2520-2524; 2010.
49. Hill
ID; Dirks M; Colletti R. et al.
Guideline for the
diagnosis and treatment of celiac disease in children: recommendations of the
North American Society for Pediatric Gastroenterology; Hepatology and
Nutrition.
J Pediatr
Gastroenterol Nutr. 40: 1-19; 2005.
50. Giersiepen K; Lelgemann M; Stuhldreher
N. et al.
Accuracy of diagnostic
antibody tests for coeliac disease in children: summary of an evidence report.
J Pediatr
Gastroenterol Nutr. 54: 229-241; 2012.
51. Rostom
A; Dube C; Cranney A. et al.
The diagnostic accuracy of
serologic tests for celiac disease: a systematic review.
Gastroenterol.128(4): S38-S46; 2005.
52. Korponay-Szabo IR; Dahlbom I; Laurita K. et al.
Elevation of IgG
antibodies against tissue transglutaminase as a diagnostic tool for coeliac
disease in selective IgA deficiency.
Gut. 52: 1567-1571; 2003.
53. Husby S; Koletzko S; Korponay-Szabo
IR. et al.
European Society for
Pediatric Gastroenterology; Hepatology; and Nutrition guidelines for the
diagnosis of celiac disease.
J Pediatr
Gastroenterol Nutr. 54: 136-160; 2012.
54. Rostom
A; Murray JA. and Kagnoff MF.
American
Gastroenterological Association (AGA) Institute technical review on the
diagnosis and management of celiac disease.
Gastroenterology.131: 1981-2002; 2006.
55. Murray
JA; Herlein J; Mitros F. et
al.
Serologic testing for
celiac disease in the United States: results of a multilaboratory
comparison study.
Clin Diagn Lab Immunol.7: 584-587; 2000.
56. Planas R; Pujol-Autonell I; Ruiz E. et al.
Regenerating gene Ia is a biomarker for diagnostic and monitoring of celiac
disease: a preliminary study.
Transl Res.158: 140-145; 2011.
57. Harris
HE. and Raucci A.
Alarmin(g) news about
danger: workshop on innate danger signals and HMGB1.
EMBO Rep 7: 774-8; 2006.
58. Yu M;
Wang H; Ding A. et al.
HMGB1 signals through
Toll-like receptor TLR4 and TLR 2.
Shock; 26: 174-9; 2006.
59. Shan
L; Qiao SW; Arentz-Hansen H.
et al.
Identification and
analysis of multivalent proteolytically resistant peptides from gluten: implications
for celiac sprue.
J Proteome Res; 4: 1732-41; 2005.
60. Shan
L; Molberg O; Parrot I. et al.
Structural basis for
gluten intolerance in celiac sprue.
Science; 297: 2275-9; 2002.
61. Moreno
ML; Cebolla Á; Muñoz-Suano
A. et al.
Detection of gluten
immunogenic peptides in the urine of patients with coeliac disease reveals
transgressions in the gluten-free diet and incomplete mucosal healing.
Gut; 66: 250-7; 2017.
62. Stankovic
B; Radlovic N; Lekovic Z; Ristic D; Radlovic V; Nikcevic G; Kotur N; Vucicevic K; Kostic T; Pavlovic S.
and Zukic B.
HLA genotyping in
pediatric celiac disease patients.
Bosn J Basic Med Sci. 14: 171-176; 2014.
63. Kaukinen K; Partanen J; Mäki M. and Collin P.
HLA-DQ typing in the
diagnosis of celiac disease.
Am J Gastroenterol; 97: 695; 2002.
64. Sarna
VK; Lundin KEA; Mørkrid L. et al.
HLA-DQ-Gluten Tetramer
Blood Test Accurately Identifies Patients with and Without Celiac Disease in
Absence of Gluten Consumption.
Gastroenterology; 154: 886; 2018.
65. Rubio-Tapia
A; Hill ID; Kelly CP. et al.
ACG clinical guidelines: diagnosis
and management of celiac disease.
Am J Gastroenterol; 108: 656, 2013.
66. Rokkas T. and Niv Y.
The role of video capsule
endoscopy in the diagnosis of celiac disease: a meta-analysis.
Eur J Gastroenterol Hepatol; 24: 303; 2012.